右美托咪定對腦缺血再灌注損傷小鼠糖萼的影響
馬海波 楊迎春 劉晶晶 穆東亮 夏瑞


[摘要] 目的 探討右美托咪定對腦缺血再灌注損傷小鼠糖萼的影響。 方法 將C57BL6/J雄性成年小鼠45只按隨機數字表法分為假手術組、生理鹽水組和右美托咪定組,每組各15只。假手術組僅切開右側頸部皮膚,暴露右側頸總動脈。右美托咪定組為造模前30 min,腹腔注射右美托咪定40 μg/kg,然后建立缺血60 min再灌注24 h后急性腦缺血再灌注損傷模型。生理鹽水組為造模前30 min,腹腔注射等容量生理鹽水,然后建立缺血60 min再灌注24 h后急性腦缺血再灌注損傷模型。采用TTC染色法計算腦梗死體積百分比;采用酶聯免疫吸附法(ELISA)檢測腫瘤壞死因子-α(TNF-α)和白介素-6(IL-6)表達;采用ELISA檢測氧化應激相關蛋白[丙二醛(MDA)、超氧化物歧化酶(SOD)]表達。 結果 與生理鹽水組比較,右美托咪定組的腦梗死體積顯著減小,神經功能缺損評分顯著降低,差異有統計學意義(P < 0.05或P < 0.01)。與生理鹽水組比較,右美托咪定組的活動時間和活動距離顯著延長,差異有統計學意義(P < 0.05或P < 0.01)。與生理鹽水組比較,右美托咪定組的HPSE/β-actin、TNF-α/β-actin、NF-κB/β-actin水平均顯著降低,SDC-1/β-actin、Tie-2/β-actin水平均顯著升高,差異有高度統計學意義(P < 0.01)。與生理鹽水組比較,右美托咪定組的TNF-α和IL-6水平均顯著降低,差異有高度統計學意義(P < 0.01)。與生理鹽水組比較,右美托咪定組的MDA水平顯著降低,SOD水平顯著升高,差異有高度統計學意義(P < 0.01)。 結論 右美托咪定對腦缺血再灌注損傷糖萼具有良好的保護作用,且具有腦保護作用,可減輕炎癥和應激反應。
[關鍵詞] 右美托咪定;腦缺血再灌注損傷;糖萼;炎性因子;氧化應激
[中圖分類號] R-332? ? ? ? ? [文獻標識碼] A? ? ? ? ? [文章編號] 1673-7210(2020)05(a)-0008-06
Effect of Dexmedetomidine on glycocalyx in mice with cerebral ischemia-reperfusion injury
MA Haibo1? ?YANG Yingchun2? ?LIU Jingjing3? ?MU Dongliang4? ?XIA Rui5▲
1.School of Medicine, Yangtze University, Hubei Province, Jingzhou? ?434023, China; 2.Department of Anesthesiology, Beijing Fengtai Hospital, Beijing? ?100071, China; 3.Department of Anesthesiology, Beijing Armed Police Corps Hospital, Beijing? ?100027, China; 4.Department of Anesthesiology, the First Hospital of Peking University, Beijing? ?100034, China; 5.Department of Anesthesiology, the First Hospital of Yangtze University, Hubei Province, Jingzhou? ?434000, China
[Abstract] Objective To investigate the effect of Dexmedetomidine on glycocalyx in mice with cerebral ischemia-reperfusion injury. Methods Forty-five C57BL6/J male adult mice were randomly divided into sham operation group, normal saline group and Dexmedetomidine group, with 15 mice in each group. In sham operation group, only the skin of the right neck was cut and the right common carotid artery was exposed. In Dexmedetomidine group, 40 μg/kg Dexmedetomidine was injected intraperitoneally 30 minutes before the establishment of the model. The mice in normal saline group were injected with equal volume of normal saline 30 minutes before modeling, and then acute cerebral ischemia-reperfusion injury model was established 24 hours after 60 minutes of ischemia-reperfusion. The percentage of infarct volume was calculated by TTC staining, the expression of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) were detected by enzyme-linked immunosorbent assay (ELISA), and the expression of oxidative stress-related proteins (malondialdehyde [MDA], superoxide dismutase [SOD]) were detected by ELISA. Results Compared with normal saline group, the infarct volume and neurological deficit score of Dexmedetomidine group were significantly reduced, the differences were statistically significant (P < 0.05). Compared with normal saline group, the activity time and distance of Dexmedetomidine group were significantly lengthened, the differences were statistically significant (P < 0.05 or P < 0.01). Compared with normal saline group, the levels of HPSE/β-actin, TNF-α/β-actin and NF-κB/β-actin in Dexmedetomidine group were significantly decreased, and the levels of SDC-1/β-actin and Tie-2/β-actin in Dexmedetomidine group were significantly increased, the differences were highly statistically significant (P < 0.01). Compared with normal saline group, the levels of TNF-α and IL-6 in Dexmedetomidine group were significantly reduced, the differences were highly statistically significant (P < 0.01). Compared with normal saline group, MDA level of Dexmedetomidine group was significantly decreased, and SOD level of Dexmedetomidine group was significantly increased, the differences were highly statistically significant (P < 0.01). Conclusion Dexmedetomidine can protect glycocalyx from cerebral ischemia-reperfusion injury, reduce inflammation and stress response.
[Key words] Dexmedetomidine; Cerebral ischemia-reperfusion injury; Glycocalyx; Inflammatory factors; Oxidative stress
缺血性腦卒中占腦卒中的大多數,具有較高致殘率和致死率[1-2]。當出現缺血性腦卒中時,腦組織細胞在缺血缺氧后恢復血液灌注,從而導致組織損傷或功能障礙,其功能并未減輕或恢復,反而加重,稱為腦缺血再灌注損傷[3-4]。隨著我國老齡化社會的到來以及醫學技術的進步,外科手術的復雜性和難度逐步提高,使圍術期腦缺血再灌注損傷成為麻醉醫師關注的熱點和難點[5-6]。近年來,發現腦血管內皮細胞糖萼成為研究腦缺血再灌注損傷的一個新方向,并且能夠作為腦損傷程度評估的新的生物標志物之一,還能夠作為靶點預防以及治療圍術期腦缺血再灌注損傷[7]。右美托咪定是一種新型輔助麻醉藥物,其能夠通過與腎上腺素受體結合發揮鎮痛作用,且證實其具有腦保護作用[8-9]。本研究旨在探討右美托咪定對腦缺血再灌注損傷小鼠糖萼的影響。
1 材料與方法
1.1 實驗動物
C57BL6/J雄性成年小鼠45只,SPF級,8~12周齡,體重25~30 g。小鼠被安置在無菌環境中的(25±2)℃,濕度(55±5)%,12 h的光照循環,實驗前至少7 d由專業動物員飼養,實驗小鼠購自湖北省疾病預防控制中心[動物合格證號:NO.42000600034352;許可證號:SYXK(鄂)2009-0027],飼養于長江大學醫學部動物實驗中心,所有實驗方案經過長江大學醫學倫理委員會同意,實驗過程遵循《實驗動物福利倫理審查指南》。
1.2 主要試藥
乙酰肝素酶(HPSE)、多配體聚糖-1(SDC-1)、血管生成素受體-2(Tie-2)、腫瘤壞死因子-α(TNF-α)、核因子κB(NF-κB)抗體均購自美國CST公司(#14669S、#12922S、#4224S、#3707S、#8242S),RIPA裂解液及BCA蛋白定量試劑盒購自碧云天生物科技公司,TNF-α及白介素-6(IL-6)試劑盒購自武漢賽維爾生物科技有限公司,丙二醛(MDA)及超氧化物歧化酶(SOD)試劑盒購自上海晶抗生物有限公司,鹽酸右美托咪定購自江蘇恒瑞醫藥股份有限公司。
1.3 實驗方法
1.3.1 實驗分組及處理方法? 按照隨機數字表法將小鼠分為假手術組、生理鹽水組和右美托咪定組,各15只。生理鹽水組與右美托咪定組建立缺血60 min再灌注24 h急性腦缺血再灌注損傷模型。假手術組僅切開右側頸部皮膚,暴露右側頸總動脈。右美托咪定組為造模前30 min,腹腔注射右美托咪定40 μg/kg。生理鹽水組為造模前30 min,腹腔注射等容量生理鹽水。
1.3.2 腦缺血模型制備? 術前8 h禁食,允許進水。3%異氟醚吸入麻醉,取仰臥位,頸部備皮消毒后,于小鼠頸部正中切口,且對組織進行逐層鈍性分離,右側迷走神經和頸總動脈充分暴露且小心分泌,以及盡可能避免損傷迷走神經,再向上分離至右側頸總動脈Y型分叉處。小鼠右側頸外動脈與右側頸總動脈近心端分別應用絲線縫扎,小動脈夾夾閉右側頸內動脈。于頸總動脈近心端剪一破口,再將線栓于小鼠右側破口處插入,輕輕插入右側頸內動脈,插入9 mm左右,線栓妥善固定。阻塞60 min后將線栓拔出恢復灌注,縫合傷口。模型成功標準:小鼠清醒后出現損傷對側肢體癱瘓以及站立不穩,并且提尾時向損傷對側旋轉為其成功標準。
1.3.3 神經功能缺損評分及行為學實驗? 神經功能缺損評分采用Longa評分法,由雙盲觀察者與再灌注24 h后進行評定。從0~4分細分5個等級,0分為正常,無明顯神經功能缺失,4分最為嚴重,小鼠無法自發行走或有意識障礙。以Homecage監測系統評價腦缺血再灌注24 h后于30 min內小鼠自發活動時間與活動距離。
1.3.4 血清和腦組織標本采集? 24 h后再次麻醉,16號鈍性針頭插入心臟至主動脈根部,血管鉗固定針頭取血,每只小鼠采血量4~5 mL,常溫靜置30 min后,離心4000 r/min×10 min,離心半徑10 cm,分離血清,-80℃下儲存。再用生理鹽水50 mL迅速灌注,見肝臟變白,立即斷頭取腦,冰上取腦組織,-80℃下儲存。
1.4 觀察指標
1.4.1 各組小鼠腦梗死體積變化? 切除小腦和腦干然后以冠狀面均勻切片,切片層厚為2 mm,以新鮮配制的1.5%TTC染色。Image J 圖像處理軟件計算腦梗死體積百分比。
1.4.2 各組小鼠糖萼損傷情況? Western blot檢測SDC-1、HPSE、Tie-2表達。取“1.3.4”項下腦組織標本,加入0.8 mL細胞裂解液中,放置于低溫條件下超聲勻漿,離心,取上清液,于-20℃保存備用。采用BCA法檢測各組蛋白含量。樣品中加入上樣緩沖液,充分混勻后于95℃變性處理5 min。上樣,以β-actin作為內參,按0.1 mL/cm2加入一抗溶液,于4℃下過夜。加入二抗孵育1 h,采用Western blot檢測蛋白表達灰度值。
1.4.3 各組小鼠炎性因子表達? 取“1.3.4”項下血清標本,采用酶聯免疫吸附測定(ELISA)法檢測TNF-α和IL-6表達。
1.4.4 各組小鼠氧化應激相關蛋白表達? 取“1.3.4”項下血清標本,采用ELISA檢測MDA、SOD表達。
1.5 統計學方法
采用Graphpad Prism 8對實驗數據進行分析,計量資料用均數±標準差(x±s)表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析,進一步兩兩比較采用Tukey′s檢驗。以P < 0.05為差異有統計學意義。
2 結果
2.1 各組小鼠腦缺血再灌注損傷后梗死體積、神經功能缺損評分及行為學實驗結果比較
與生理鹽水組比較,右美托咪定組的腦梗死體積顯著減小,神經功能缺損評分顯著降低,差異有統計學意義(P < 0.05或P < 0.01)。與生理鹽水組比較,右美托咪定組的活動時間和活動距離顯著延長,差異有統計學意義(P < 0.05或P < 0.01)。見圖1。
2.2 各組小鼠腦缺血再灌注損傷后糖萼相關分子及炎癥相關分子表達水平比較
與生理鹽水組比較,右美托咪定組的HPSE/β-actin、TNF-α/β-actin、NF-κB/β-actin水平均顯著降低,SDC-1/β-actin、Tie-2/β-actin水平均顯著升高,差異有高度統計學意義(P < 0.01)。見圖2。
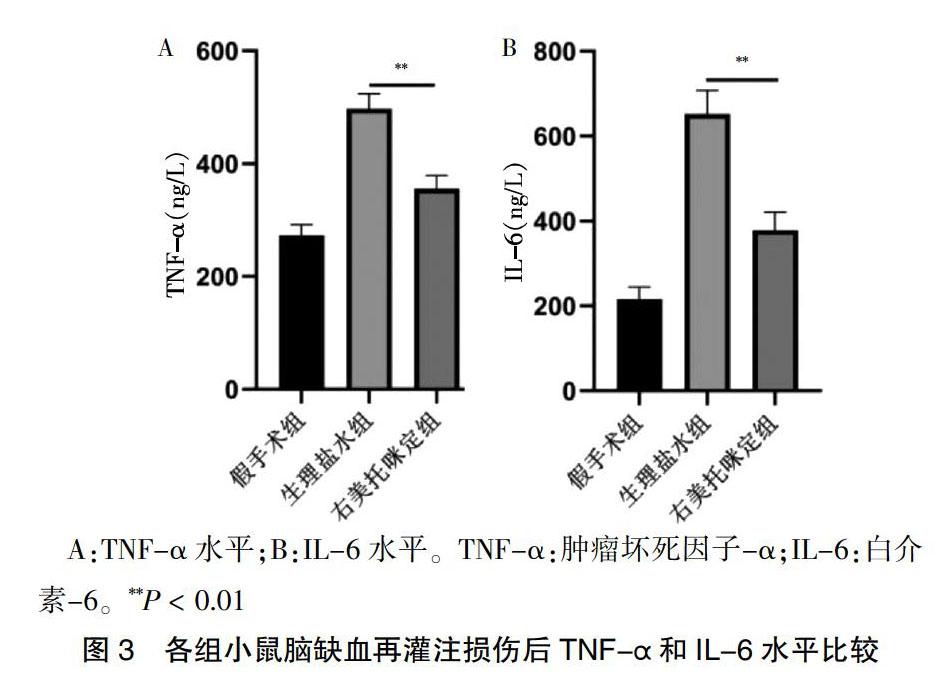
2.3 各組小鼠腦缺血再灌注損傷后TNF-α和IL-6水平比較
與生理鹽水組比較,右美托咪定組的TNF-α和IL-6水平均顯著降低,差異有高度統計學意義(P < 0.01)。見圖3。
A:TNF-α水平;B:IL-6水平。TNF-α:腫瘤壞死因子-α;IL-6:白介素-6。**P < 0.01
2.4 各組小鼠腦缺血再灌注損傷后氧化應激相關蛋白表達水平比較
與生理鹽水組比較,右美托咪定組的MDA水平顯著降低,SOD水平顯著升高,差異有高度統計學意義(P < 0.01)。見圖4。
3 討論
右美托咪定是在手術室和重癥監護室中廣泛使用的一種新型、高效、高選擇性α2-腎上腺素能受體激動劑[10-11]。右美托咪定幾乎不引起呼吸抑制,可安全用于機械通氣和自主呼吸患者[12]。右美托咪定的腦保護作用已經過臨床驗證,然而其機制尚不清楚。右美托咪定保護腦功能的機制是復雜的[13]。研究表明,右美托咪定可能通過抑制氧化應激和炎性反應,減輕大鼠腦缺血再灌注損傷[14]。另有研究表明,右美托咪定可減少炎癥介質和神經內分泌激素的釋放,維持顱內勻漿平衡,減輕缺血性腦損傷,具有腦保護作用[15]。有文獻報道,右美托咪定能夠抑制神經元自噬,保護鼠腦免于缺血再灌注損傷[16]。研究發現,右美托咪定通過抑制TLR4信號通路減輕新生兒大鼠腦缺血再灌注損傷[17]。
腦血管內皮細胞被一層糖萼分子層所覆蓋,因含有硫酸化的糖胺聚糖側鏈而帶有負電荷,從而調節血管滲透性[18]。腦內皮糖萼作為內皮細胞的表面結構,阻隔了血小板、白細胞與血管內皮的的黏附分子接觸,通過結合糖胺聚糖可減少白細胞激活,減輕腦缺血再灌注損傷。HPSE抑制劑通過抑制內皮糖萼的降解,可減少內生HPSE、炎性壞死因子和促纖維化因子的表達,從而減輕腦缺血再灌注損傷。缺血再灌注損傷容易導致內皮糖萼的脫落,而內皮細胞的激活和內皮糖萼的脫落大大增加了缺血再灌注損傷中免疫反應、血栓形成和組織損傷的風險[19]。因此,腦血管內皮糖萼在圍術期腦缺血再灌注損傷的預防、治療和改善預后均有重要意義。而右美托咪定在腦缺血再灌注損傷中是否對內皮糖萼有保護作用尚不清楚。血管生成素-1(Ang-1)/Tie-2系統在血管完整性和穩定性中起重要作用。研究報道顯示,鞘內注射右美托咪定可以通過抑制缺血再灌注引起的金屬蛋白酶(可降解糖萼成分)釋放,增加Ang-1/Tie-2系統活性,從而保護血脊髓屏障不受缺血再灌注損傷[20]。
NF-κB及TNF-α作為重要的炎性蛋白,在腦卒中后的炎性反應中起著非常重要的作用[21-22]。炎性因子在腦缺血再灌注損傷中發揮著重要作用,腦缺血后神經元可發生壞死,釋放炎性介質,影響腦損傷的轉歸。其中TNF-α及IL-6作為重要的炎癥蛋白,在腦缺血再灌注的炎性反應中起著非常重要的作用[21-22]。
MDA含量是反映機體抗氧化潛在能力的重要參數,可以反映機體脂質過氧化速率和強度,也能間接反映組織過氧化損傷程度。SOD是生物體內存在的一種抗氧化金屬酶,它能夠催化超氧陰離子自由基歧化生成氧和過氧化氫,在機體氧化與抗氧化平衡中起到至關重要的作用,與很多疾病的發生、發展密不可分。MDA和SOD作為重要的氧化應激指標在腦缺血再灌注損傷中有重要意義。
綜上所述,右美托咪定對腦缺血再灌注損傷糖萼具有良好的保護作用,且具有腦保護作用,減輕炎癥和應激反應。但本研究仍存在一些不足之處,觀察小鼠相對較少,未觀測糖萼脫落的其他相關指標,觀察機制相對較少,因經費原因,未設置糖萼基因敲除對照組,還需在后續作多中心、多樣本深入研究,提供可靠的參考價值。
[參考文獻]
[1]? Zhai ZY,Feng J. Constraint-induced movement therapy enhances angiogenesis and neurogenesis after cerebral ischemia/reperfusion [J]. Neural Regen Res,2019,14(10):1743-1754.
[2]? Bu J,Shi S,Wang HQ,et al. Acacetin protects against cerebral ischemia-reperfusion injury via the NLRP3 signaling pathway [J]. Neural Regen Res,2019,14(4):605-612.
[3]? 閔冬雨,李紅巖,關樂,等.腦心清對腦缺血再灌注損傷模型大鼠的保護機制[J].中國組織工程研究,2020,24(2):215-222.
[4]? Wang Y,Luo J,Li SY. Nano-curcumin simultaneously protects the blood-brain barrier and reduces m1 microglial activation during cerebral ischemia-reperfusion injury [J]. ACS Appl Mater Interfaces,2019,11(4):3763-3770.
[5]? 楊翠娥,王慧.銀杏黃酮對腦缺血再灌注損傷大鼠腦組織的保護作用[J].卒中與神經疾病,2019,26(6):660-663.
[6]? Feng J,Chen X,Guan B,et al. Inhibition of peroxynitrite-induced mitophagy activation attenuates cerebral ischemia-reperfusion injury [J]. Mol Neurobiol,2018,55(8):6369-6386.
[7]? 沈俊逸,趙智明,劉春麗,等.人參皂苷對大鼠腦血管內皮細胞MEG3表達的干預作用及促進血管新生的研究[J].中華中醫藥雜志,2019,34(8):3418-3421.
[8]? 李鄭琛,賈英萍,王媛,等.右美托咪定后處理對大鼠腦缺血再灌注損傷組織的保護作用[J].鄭州大學學報:醫學版,2019,54(3):439-442.
[9]? 宋文英,鄭偉,宋宇龍,等.右美托咪定對腦缺血再灌注損傷大鼠認知功能及神經功能的保護作用研究[J].臨床和實驗醫學雜志,2019,18(1):18-21.
[10]? 許位,石秋艷,孫原,等.亞低溫聯合右美托咪定對大鼠腦缺血再灌注損傷的保護作用[J].貴州醫藥,2018,42(8):934-937.
[11]? 邢娜,李平樂,張建文,等.右美托咪定對腦缺血再灌注損傷大鼠神經的保護作用及機制[J].中國老年學雜志,2018,38(12):3011-3015.
[12]? 林生,周廣利,傅志儉.右美托咪定預先給藥對大鼠局灶性腦缺血再灌注時谷氨酸和γ-氨基丁酸含量的影響[J].中華麻醉學雜志,2018,38(7):886-888.
[13]? 曹立梅,李強,董智強,等.右美托咪定后處理對大鼠局灶性腦缺血-再灌注損傷的保護作用及機制研究[J].河北醫學,2018,24(5):705-711.
[14]? 薄立軍,于沛霞,黃立寧,等.右美托咪定對腦缺血缺氧新生大鼠神經功能的影響[J].河北醫科大學學報,2017, 38(9):1068-1071.
[15]? 徐璐丹,樊騰,張紅偉,等.不同劑量右美托咪定預處理對大鼠局灶性腦缺血再灌注損傷的影響[J].南京醫科大學學報:自然科學版,2018,38(7):973-977.
[16]? 方潔.不同劑量右美托咪定對大鼠腦缺血再灌注損傷腦組織TNF-α、IL-1β及ICAM-1表達的影響[J].中國老年學雜志,2018,38(3):713-715.
[17]? 蘭琛,曹江北.右美托咪定對大鼠局灶性腦缺血-再灌注損傷后抗氧化能力的影響[J].臨床麻醉學雜志,2016,32(5):488-490.
[18]? 吳從印,陳娟,馮光球,等.老年缺血性腦血管病患者血管內皮細胞功能指標與沉默信息調節因子1的相關性分析[J].中國醫藥,2019,14(4):549-552.
[19]? 王良芳,陳志武.低氧損傷下調大鼠腦血管內皮細胞中硫化氫及其介導的Rho A-ROCK通路激活[J].安徽醫科大學學報,2019,54(1):50-55.
[20]? Fang B,Li XQ,Bi B,et al. Dexmedetomidine attenuates blood-spinal cord barrier disruption induced by spinal cord ischemia reperfusion injury in rats [J]. Cell Physiol Biochem,2015,36(1):373-383.
[21]? Jin R,Yang G,Li G. Inflammatory mechanisms in ischemic stroke:role of inflammatory cells [J]. J Leukoc Biol,2010,87(5):779-789.
[22]? Schilling M,Besselmann M,Muller M,et al. Predominant phagocytic activity of resident microglia over hematogenous macrophages following transient focal cerebral ischemia:an investigation using green fluorescent protein transgenic bone marrow chimeric mice [J]. Exp Neurol,2005,196(2):290-297.
(收稿日期:2020-01-10? 本文編輯:李亞聰)

