紅花黃素A 調控核受體TR3 胞內移位抑制氧化應激對心肌細胞的損傷
駱杰爐 梁 儉 梁文能
(廣州中醫藥大學第一附屬醫院 藥學部, 廣東 廣州510405)
氧化應激是心肌缺血后導致病情惡化的關鍵因素之一,心肌在缺血供氧不足的情況下,由于側支循環再灌注,在恢復供氧的過程中產生大量氧自由基,超出細胞清除氧化物的能力,從而導致心肌組織進一步損傷和凋亡[1]。有研究表明,核受體TR3(Thyroid-steroid receptor 3,TR3) 的胞內定位與氧化應激對細胞的損傷有著密切關系,TR3 從細胞核移位至線粒體是促進心肌細胞凋亡的重要機制[2-3]。
紅花Carthamus tinctorius L.屬于菊科植物,作為藥材最早見于東漢張仲景的《金匾要略》,記載其有活血化瘀、行氣通脈的功效[4]。紅花色素是藥材紅花的主要活性成分,包含有多種水溶性查爾酮成分,其中紅花黃色素A 占比最高,目前已提取制作成單一成分的注射液在臨床上主要用于治療穩定型心絞痛等心血管疾病,具有顯著的療效[5]。研究表明,紅花黃色素A 能夠抑制缺氧再灌注過程中產生的氧自由基的水平,降低氧化應激對心肌細胞的損傷,但其具體作用機制尚未完全明確[6]。本研究以H2O2模擬氧自由基對H9c2 心肌細胞的氧化應激損傷,研究紅花黃色素A 對TR3 的胞內定位及凋亡信號通路的影響[7],進一步闡明紅花黃色素A 保護缺血心肌的作用機制。
1 材料
1.1 藥物與試劑 紅花黃素A(批號111637-201812,純度>99.0%)、4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI,批號023K1925)、TritonX-100(批號118K0177) 購自美國Sigma 公司;CCK-8 試劑盒(批號KTC011001購自日本Dojindo Lab 公司;高糖DMEM 培養基(批號966185)、特級胎牛血 清(FBS,批號1315148) 購自美國Gibco 公司;BCA 蛋白定量試劑盒(批號P0019)、丙二醛(Malondialdehyde,MDA,批號S0131)、超氧化物歧化酶(Superoxide Dismutase,SOD,批號S0101) 檢測試劑盒購自碧云天生物技術研究所;AnnexinV-FITC/7-AAD 細胞凋亡檢測試劑盒(批號BD556547) 購自美國BD公司;線粒體/細胞核提取試劑盒(批號KGA828)購于南京凱基生物科技發展有限公司;Bcl-2(稀釋度1∶1 000,批號15071)、Bax(稀釋度1∶1 000,批號2772)、TR3 核受體(稀釋度1∶1 000,批號3960)、cl caspase-9(稀釋度1∶1 000,批號9504)、β-actin(稀釋度1∶1 000,批號4967) 兔抗鼠一抗、HRP 偶聯羊抗兔二抗(稀釋度1∶5 000,批號7074)、線粒體綠色熒光探針(MitoTracker? Green FM) 購自美國Cell Signaling Technology 公司;Alexa Fluor 594(紅色熒光,稀釋度1∶400,批號A00131) 羊抗兔二抗購自美國Invitrogen 公司。
1.2 細胞株 鼠源性心肌細胞株H9c2 由廣州中醫藥大學中藥學院藥理實驗室中心提供。
1.3 儀器 Thermo Forma 3951 細胞培養箱、Sorvall ST 40 臺式離心機均購自美國Thermo 公司;FACS Calibur型流式細胞儀(美國BD 公司);iMark 680 酶標儀、Western blot 轉膜儀(美國Bio-Rad 公司);TCS SP8 激光共聚焦顯微鏡(德國Leica 公司)。
2 方法
2.1 H9c2 心肌細胞培養 用含10% FBS 高糖DMEM 培養液,于37℃、5% CO2、95% 飽和濕度條件下培養細胞。細胞生長滿皿約80% 時進行傳代,棄去舊培養液,PBS 沖洗,加入0.25% 胰酶消化2~3 min,再加含血清培養液終止消化,用滴管輕輕吹打至細胞從皿底完全脫落,按實驗需求接種于培養板或培養瓶內待用。
2.2 細胞存活率檢測 將培養好的細胞接種于96孔板中,在細胞生長狀態良好時,按實驗需要進行不同的處理。模型組加入終濃度為50 μmol/L H2O2造模,3個藥物組在加入H2O2基礎上分別加入終濃度為10、20、40、80 μmol/L 紅花黃色素A,空白組只更換培養基,不作任何處理。各組作用24 h,每孔加入10 μL CCK-8 試劑,37℃孵育2 h,用酶標儀測定各孔450 nm 波長OD。每組設5個復孔,細胞存活率=(OD實驗組/OD空白組) ×100%。
2.3 細胞凋亡率檢測 將細胞接種于6 孔板中,分組處理后,棄去培養液,PBS 洗滌2 次,每孔加入0.25% 胰蛋白酶(不含EDTA) 于37℃消化2~3 min,每孔加入含血清的培養液終止消化。細胞懸浮液以1 000 r/min 離心10 min,棄去上清,收集細胞。按照試劑盒提供的步驟進行AnnexinVFITC/7-AAD 染色,流式細胞儀檢測H9c2 細胞凋亡率。凋亡率=右上象限細胞百分比+右下象限細胞百分比。
2.4 氧化應激水平檢測 將H9c2 心肌細胞接種于6 孔板中,分組處理后,去除細胞培養液,PBS洗滌2 次,加入細胞裂解液作用30 min 制作細胞勻漿,按MDA、SOD 檢測試劑盒說明書操作檢測,按公式將吸光度值換算成MDA(μmol/g Prot) 和SOD(U/mg Prot)。
2.5 線粒體熒光染色 將培養好的細胞接種于6孔板中,分組處理后,去除細胞培養液,加入以細胞培養液(1∶1 000) 稀釋配制好的MitoTracker?Green FM 工作液,37℃孵育30 min。在染色后,用PBS 洗滌3 次,加入4%多聚甲醛固定液,室溫靜置30 min。
2.6 TR3 熒光免疫染色 將固定好的細胞加入0.5% TritonX-100 室溫破膜10 min,吸棄TritonX-100,PBS 洗滌3 次。5% BSA 在37℃下封閉30 min,吸棄封閉液。3% BSA 稀釋一抗,每皿加200 μL,4℃搖床孵育過夜。吸棄各皿一抗,PBS洗滌3 次。每孔加入PBS 稀釋的二抗200 μL,室溫避光在搖床上孵育60 min。
2.7 細胞核熒光染色 將固定好的細胞以PBS 洗滌2 次,加入DAPI 溶液(0.5 μmol/L),室溫避光輕搖30 min,棄去染色液,PBS 洗滌后用熒光顯微鏡在364 nm 激發波長下觀察染色情況。
2.8 線粒體與細胞核提取分離 將細胞接種于6 孔板中,分組處理后,去除細胞培養液,PBS洗滌,加入細胞裂解液作用30 min 制作細胞勻漿,按說明書采用密度梯度分離法在4℃下離心操作,先以2 700 r/min 離心5 min 沉淀細胞核,上清液轉移至梯度溶液中,20 000 r/min 離心20 min,從濃度梯度交界處吸取線粒體樣品。
2.9 Western blot 法檢測蛋白表達 按照“2.8”項下方法分離線粒體和細胞核,加入預冷的裂解液作用30 min,以微孔過濾器去除細胞碎片等雜質,取上清液,BCA 法測定蛋白濃度。用12% SDS-聚丙烯酰胺凝膠電泳分離總蛋白,然后轉移到聚偏二氟乙烯膜上,5% BSA 封閉90 min,加入稀釋好的一抗,在4℃條件下孵育過夜。TBST 洗膜后,加入二抗,37℃孵育1 h,洗滌2 次,ECL 發光試劑顯影,采用凝膠成像系統軟件分析膠片中蛋白條帶組的灰度面積,將空白組各蛋白與內參β-actin 的比值設為基準值1.0,其余各組蛋白均除以基準值的計算相對表達量。
2.10 統計學分析 采用SPSS 19.0 軟件進行分析,數據以() 表示,多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗,以P≤0.05 為差異有統計學意義。
3 結果
3.1 紅花黃色素A 對H9c2 細胞存活率的影響 如圖1 所示,與模型組比較,細胞存活率隨紅花黃色素A 濃度(40~80 μmol/L) 增加而逐漸升高(P<0.05,P<0.01),但當紅花黃色素A 濃度達到100 μmol/L 時,細胞存活率開始下降,表明此時藥物濃度過高,對細胞的培養環境產生影響,不利于細胞生長,因此后續實驗僅以40、60、80 μmol/L 3個濃度作進一步研究。
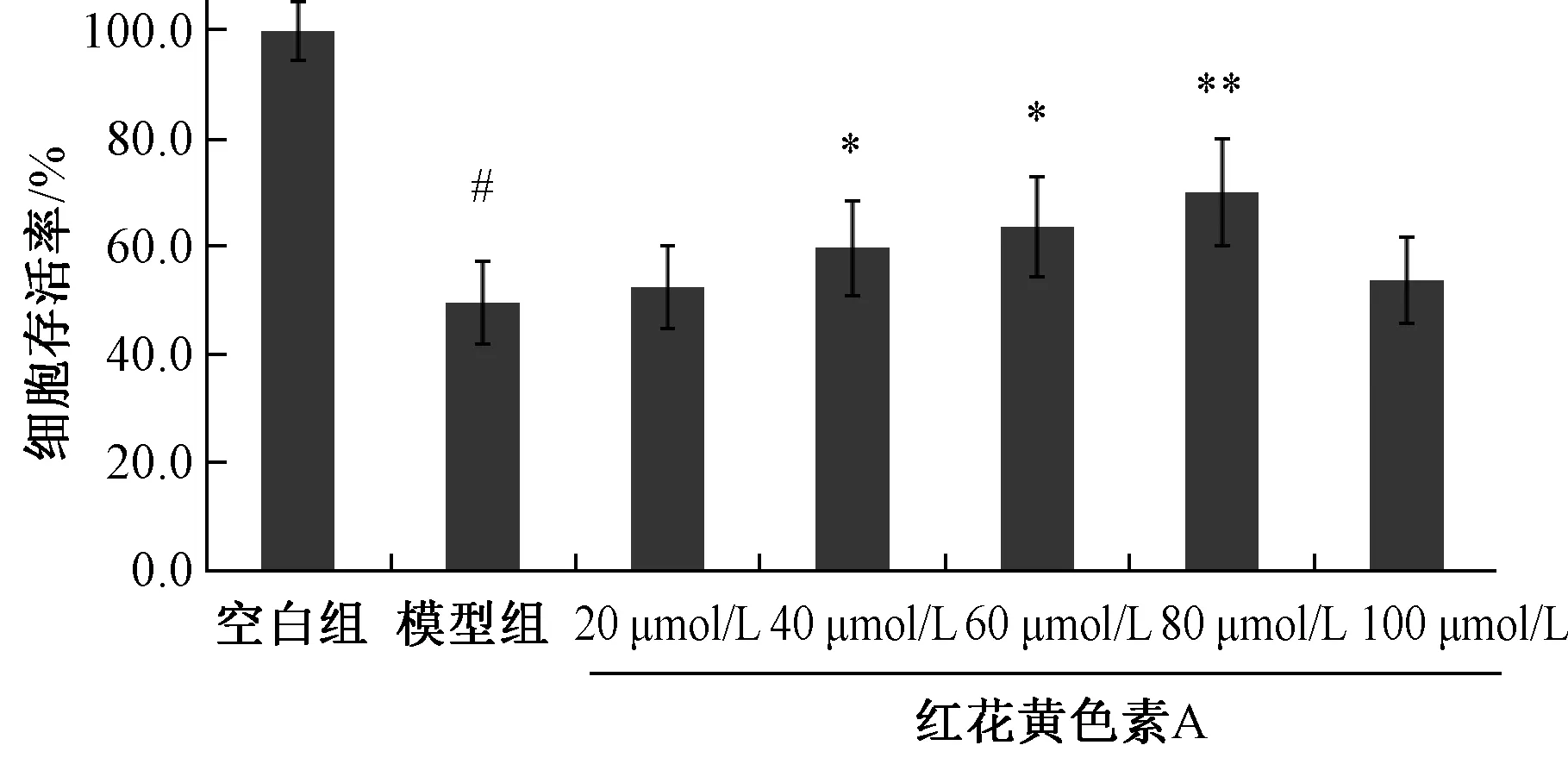
圖1 紅花黃色素A 對H9c2 細胞存活率的影響Fig.1 Effects of safflor yellow A on the survival rate of H9c2 cells
3.2 紅花黃色素A 對H9c2 細胞凋亡率的影響 與空白組相比,模型組凋亡率增加(P<0.05);與模型組比較,紅花黃色素A組細胞凋亡率下降(P<0.05,P<0.01),呈濃度依賴性。見表1、圖2。
表1 紅花黃色素A 對H9c2 細胞凋亡率的影響(,n=5)Tab.1 Effects of safflor yellow A on the apoptosis rate of H9c2 cells(, n=5)

表1 紅花黃色素A 對H9c2 細胞凋亡率的影響(,n=5)Tab.1 Effects of safflor yellow A on the apoptosis rate of H9c2 cells(, n=5)
注:與空白組比較,# P <0.05;與模型組比較,* P <0.05,**P<0.01。
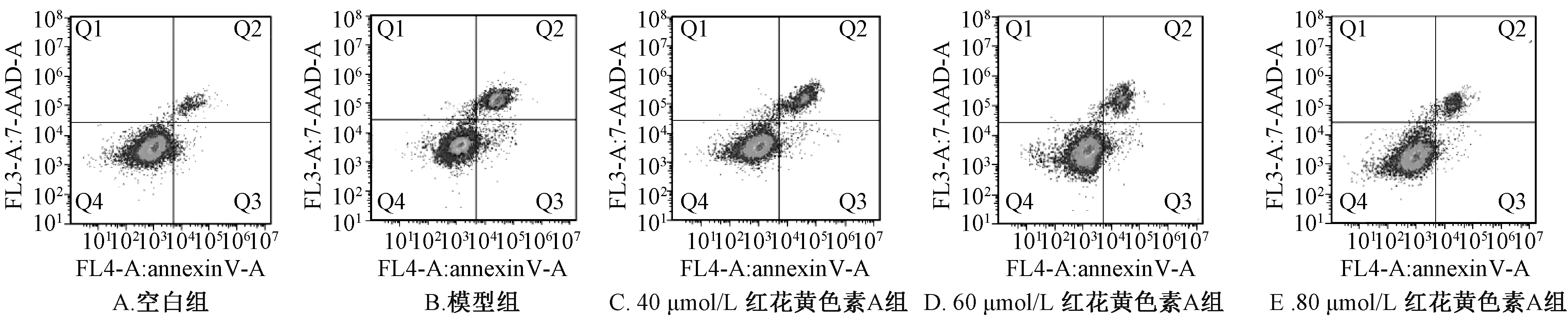
圖2 流式細胞檢測各組細胞的凋亡率Fig.2 Apoptosis rate of cells in each group by flow cytometry
3.3 紅花黃色素A 對H9c2 細胞氧化應激水平的影響 與空白組比較,模型組SOD 水平降低,而MDA 水平升高(P<0.05)。與模型組比較,紅花黃色素A組SOD 水平升高,MDA 水平下降(P<0.05,P<0.01),呈濃度依賴性。見表2。
表2 紅花黃色素A 對H9c2 細胞氧化應激水平的影響(, n=5)Tab.2 Effects of safflor yellow A on the level of oxidative stress in H9c2 cells(, n=5)
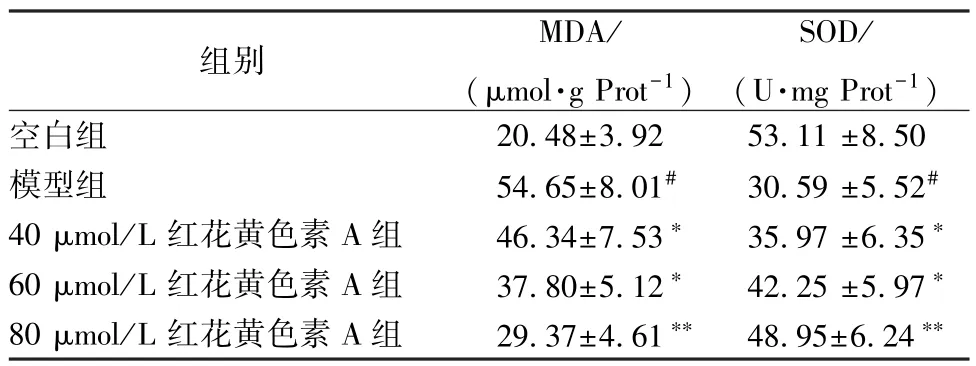
表2 紅花黃色素A 對H9c2 細胞氧化應激水平的影響(, n=5)Tab.2 Effects of safflor yellow A on the level of oxidative stress in H9c2 cells(, n=5)
注:與空白組比較,# P <0.05;與模型組比較,* P <0.05,**P<0.01。
3.4 TR3 核受體的細胞內定位 以下每一組細胞的染色圖像均分別以3 種不同波長的發生光通過共聚焦顯微鏡進行拍攝,其中左上方小圖為DAPI 著色的細胞核,右上方小圖為熒光單抗結合的TR3核受體,左下方小圖為附著熒光探針的線粒體,右下方小圖為前3個圖片的疊加成像。從圖3 可觀察到,相對于空白組,模型組TR3 核受體開始從細胞核擴散移位,并與線粒體的位置重疊,而隨著紅花黃色素A 的濃度增加,TR3 核受體的移位逐漸減小并聚集在細胞核附近,較少與線粒體位置重疊。
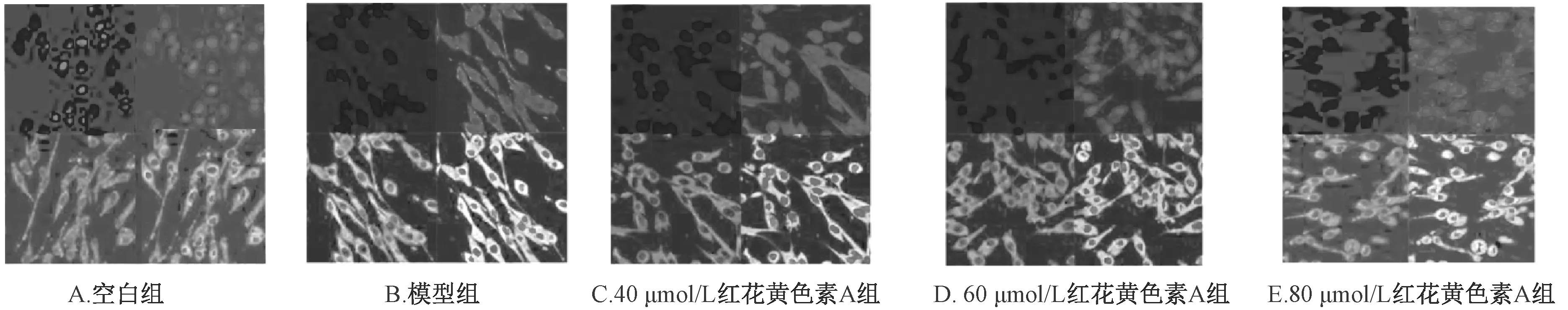
圖3 各組TR3 核受體的細胞內定位Fig.3 Intracellular localization of TR3 nuclear receptors in each group
3.5 紅花黃色素A 對H9c2 細胞Bax、Bcl-2、cl caspase-9、TR3 蛋白表達影響 與空白組相比,模型組Bax、cl caspase-9 蛋白表達增 加(P<0.05),而Bcl-2 蛋白表達降低(P<0.05),線粒體上TR3 蛋白表達比細胞核更高(P<0.05)。與模型組相比,紅花黃色素A組Bax、cl caspase-9 蛋白表達下降,Bcl-2 蛋白表達上升,線粒體上TR3蛋白表達減少,而細胞核上的TR3 蛋白表達增加(P<0.05,P<0.01)。見圖4。
4 討論
TR3 屬于甲狀腺激素受體超家族,由于其配體尚未確定,因此被歸類為孤兒受體。TR3 在細胞中的表達可受到多種因素影響,包括炎癥因子、生長因子和應激反應。TR3 具有多種生理功能,可通過表達調節、翻譯后修飾及亞細胞定位發揮各種不同的生理作用,包括細胞增殖、分化、生長、凋亡、代謝及免疫。關于TR3 的研究較多涉及腫瘤學方面,研究表明其對多種腫瘤細胞的生長增殖均可產生促進作用;而在神經元和心肌等正常細胞中,在缺氧再灌注并產生氧化損傷的情況下,TR3 則充當誘導細胞凋亡的關鍵因子,促使凋亡通路的執行[8]。研究指出,TR3 之所以能夠產生截然相反的生物效應與其在細胞內的定位密切相關,在細胞核內TR3 可通過激活DNA 轉錄而促進細胞的增殖和生長,是大多數腫瘤細胞過度增殖、轉移、耐藥的關鍵因素之一[9],但對于正常組織的細胞,在外界有害因素的刺激下,TR3 轉移離開細胞核則可誘導細胞凋亡。有學者研究報道,在離體心肌細胞應激損傷模型中,TR3 從胞核到線粒體的轉位是開啟細胞凋亡通路的重要機制,當其定位于線粒體上,可與Bcl-2 結合引起構象變化,同時上調Bax的表達,從而激活細胞質中的cl caspase-9,啟動線粒體凋亡途徑導致細胞死亡[10]。當細胞處于應激損傷的狀態下TR3 離開細胞核的機制尚未完全清晰,目前有研究指出TR3 離開細胞核的過程與MAPK(有絲分裂原激活的蛋白激酶) 通路密切相關,MAPK 的信號通路可促進TR3 的磷酸化使其與DNA 分離轉移至核外的細胞器[2]。
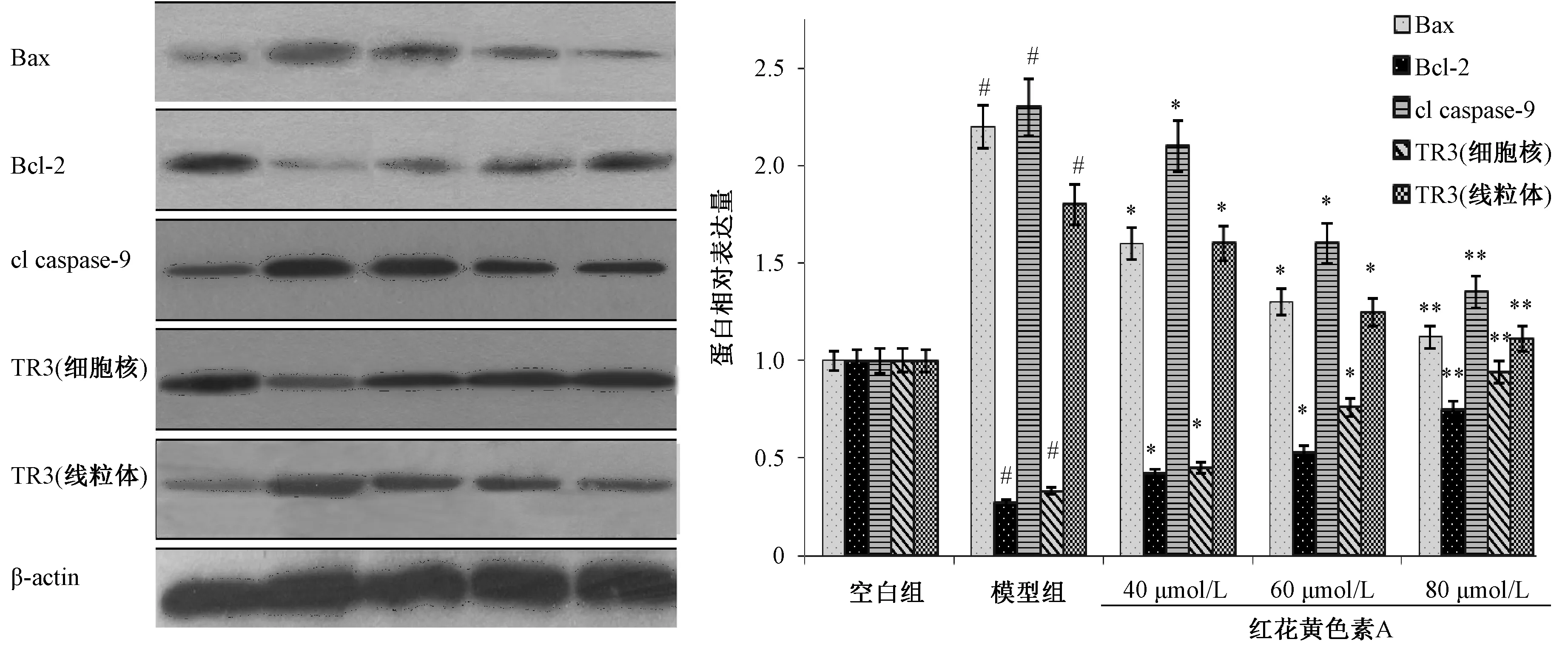
圖4 紅花黃色素A 對H9c2 細胞Bax、Bcl-2、cl caspase-9、TR3 蛋白表達影響Fig.4 Effects of safflor yellow A on Bax,Bcl-2,cl caspase-9 and TR3 protein expression in H9c2
中藥紅花為一年生或者一年兩生菊科植物藥材,原產自西亞和歐洲等地區,現中國河南和新疆等地均有種植,一般以管狀花入藥,屬珍貴藥材資源。據中醫藥古籍《湯液本草》 記載,紅花性溫、味辛,陰中之陽,無毒,歸入心、肝經。《本草匯言》 記載,紅花為化瘀、行血、活血、調血之藥,可治胸悶心痛、口唇青紫、血滯經閉、產后瘀阻、跌打損傷等瘀血證諸癥[11]。現代天然藥物化學研究表明,紅花中具有治療心血管疾病的藥效成分,主要為黃酮類化合物,包括紅花黃素A、紅花黃素B、山柰酚苷、槲皮素苷、木犀草素、蘆丁等物質,其中水溶性查爾酮類化合物紅花黃色素A 是主要藥效組分[12]。紅花黃色素A 有明顯增加冠脈血流量,改善心肌供血作用,其單成分注射液和復方注射液血必凈在臨床上常作為冠心病或冠脈支架術后的輔助用藥。從化學結構分析,紅花黃色素A帶有多個酚羥基,因而具有良好的還原性,研究表明,紅花黃色素A 能有效降低心肌缺血-再灌注模型血漿中乳酸脫氫酶(LDH) 和丙二醛(MDA)水平,提高過氧化物歧化酶(SOD) 活性,加速自由基的消除,從而產生良好的抗氧化作用[13]。氧化應激損傷心肌細胞的機制與MAPK 通路密切相關,細胞實驗研究表明在H2O2建立的氧化損傷模型中,MAPK 通路相關的蛋白均參與到促進細胞凋亡的過程,而抗氧化能力較強的天然化合物包括黃酮和皂苷,皆可調控MAPK 通路而對模型細胞產生保護作用[14-15]。綜合本文各項實驗結果和相關文獻的研究結論進行分析,可以初步推測紅花黃色素A 抑制氧化應激對心肌損傷的機制是通過降低氧自由基對細胞器的脂質成分和蛋白的氧化損傷,抑制MAPK 通路誘導TR3 受體離開細胞核移位至線粒體,抑制其與Bcl-2 結合,逆轉Bax 與Bcl-2的表達比例,降低下游凋亡蛋白caspase-9 的活化,阻滯細胞線粒體損傷介導的凋亡程序執行,從而發揮保護心肌細胞的作用[16]。
核受體TR3 移位離開細胞核后,除了定位于線粒體還可以結合到內質網上,這是TR3 介導細胞凋亡的另一重要途徑。研究表明,氧自由基可通過該途徑引起內質網應激反應,使內質網應激內部蛋白質發生錯誤折疊并過度聚集,同時又促進內質網大量釋放Ca2+,造成胞漿內鈣離子超載,激活鈣依賴性蛋白酶Calpain,最終觸發caspase 12 誘導的凋亡程序[17-18]。紅花黃色素A 能否通過影響內質網應激介導的凋亡程序也產生抑制氧化應激對心肌細胞的損傷作用,這將會是本課題組的下一個研究重點。

