動態調控:一種高效的細胞工廠工程化代謝改造策略
葉健文 陳江楠 張旭 吳赴清 陳國強
(清華大學生命科學學院,北京 100084)
代謝工程改造是構建工業化細胞工廠的一種重要的合成生物學手段。微生物則是目前代謝工程改造的主要研究對象之一。其合成的豐富的代謝產物涵蓋了食品、醫療、燃料、高分子材料等應用領域。目前,基于代謝工程改造構建的微生物細胞工廠已被廣泛應用到萜類化合物[1]、聚酮類化合物[2]、生物塑料制品[3]等高值產品的生產中。除此之外,工程化改造的微生物在活體功能材料、水土修復等眾多領域均具有較好的應用潛力。因此,細胞工廠的工程化改造無論在高值產物合成還是在功能化微生物的改造中,都有著重要的工業化應用價值。然而,由于微生物自身復雜的代謝途徑和調控關系,給細胞工廠的理性改造帶來很多挑戰與不確定性。因此開發高效的代謝工程改造方法,不僅可以有效地提升細胞工廠構建的效率,而且還可以進一步強化工程化細胞的工作效能。
隨著分子生物學、合成生物學[4-5]、基因組學和蛋白組學[6]等領域的快速發展,新的代謝工程改造技術也不斷被開發、豐富,涵蓋了代謝通路構建、表達,復雜且精細的通路調諧、調控,以及代謝網絡重構分析等基于系統與合成生物學的新技術[7]。而靜態調控改造策略是目前研究最多、應用最廣的細胞改造策略。近年來,隨著前沿生物技術的創新推動和工業生物產業的不斷發展,動態調控策略在代謝工程領域的作用和優勢逐漸凸顯出來[8-9]。因此,本文將重點綜述關于動態調控的原理、特征,以及在代謝工程領域的應用范例,同時總結了動態調控系統設計與構建的關鍵步驟及其在未來細胞工廠改造中的潛在應用方式。
1 代謝工程中的調控方式
1.1 靜態調控
靜態調控是指通過設計和改造遺傳編碼組件對目標代謝通路進行靜態優化的代謝工程改造策略[10]。這種改造方式的最大特征是定向、不可逆性,改造后的細胞在生長過程中不具備感應指定信號而做出特定調整的能力。目前,靜態調控主要涵蓋了基因插入和敲除[11-12],單/多基因的表達水平的調諧如啟動子工程以調控轉錄水平[13]、核糖體結合位點(Ribosome binding site,RBS)改造以實現翻譯水平調節[14],引入蛋白支架[15-16],代謝流平衡分析[17]等方面(圖1-A)。
其中,敲除影響菌株目標代謝物積累量的基因是構建工程化菌株的重要手段之一,也是典型的靜態調控方式[18]。例如,Alper和 Stephanopoulos等[19]報道了一種基于全局化學計量學分析的單基因和多基因敲除的合理設計方法。該方法以大腸桿菌為出發菌,以番茄紅素為目標產物,經組合構建了64個基因敲除突變株,篩選分析后番茄紅素的產量得到極大的提高。此外,通過構建底盤菌的代謝網絡模型來進行需敲除基因的預測,從而實現目標代謝產物的高效合成[20],是近年來基于系統與合成生物學開發的一種更高效的方法。而且,隨著計算工具的進一步發展,代謝網模型可用于預測基因敲除引起的全局基因表達水平的變化[21],進而可以系統地評估基因敲除對產物合成和細胞生長的影響。該方法甚至還能用于計算上調、下調及微調目的基因表達水平后的代謝水平變化[22],從而預測菌株改造的變異性,提高菌株改造的效率[23]。相關研究工作如提高琥珀酸、丁二醇等在大腸桿菌中的產量[24]及乙醇在酵母中產量[25]等是該研究領域的典型范例。
除基因敲除外,啟動子工程和RBS改造也是靜態調控中較常用的方法。該方法可有效地調節代謝通路相關基因表達過程中的轉錄和翻譯水平,從而控制通路中相關代謝物的合成或消耗速率。如通過基因簇表達量的調控,在谷氨酸棒桿菌(Cornyebacterium glutamicum)中實現賴氨酸的高產[26]。然而為了應對更復雜的代謝通路表達量調諧,許多研究在不同的生物底盤中開發了多種啟動子和RBS庫,從而實現多基因表達調諧的高通量建庫篩選[13-14]。此外,Salis等[27]利用翻譯初始化的熱力學模型,通過減少具有抑制性的RNA二級結構的引入,從而實現RBS與核糖體結合能的預測和設計,從而理性設計和調控基因表達過程中的翻譯水平。
靜態調控因其易操作、周期短、效果顯著、設計簡單等特點,在合成生物學領域被廣泛應用。以基于嗜鹽單胞菌合成聚(3-羥基丁酸-4羥基丁酸)P(3HB4HB)為例,首先實現4-羥基丁酸輔酶A(4HB-CoA)合成通路的構建及驗證,然后對相關的旁路基因進行敲除,最后對4HB-CoA合成路徑的代謝通量進行調諧,從而提高P34HB的產量(圖1-B)[11-12]。然而,在細胞生長過程中,由于細胞代謝物或目標代謝產物的組成和濃度會隨著培養基營養物質的組成、生長環境(主要是溶解氧濃度)以及細胞生長速率的變化而發生改變,所以靜態調控所獲得的突變株無法感應細胞生長過程中的代謝變化從而進行自身的細胞活動調節。因此,單一地減少或增加關鍵蛋白的表達量可能會對細胞生長產生不可逆的副作用,盡管突變菌株相對于出發菌株具有更高水平的產物積累能力,但受到細胞生長率抑制、生長魯棒性差、代謝紊亂等因素影響,使得目標產物的合成未達到最優化水平,且在后期放大生產過程中也可能面臨眾多挑戰[28-29]。

圖1 靜態調控概覽
1.2 動態調控
由于目標產物的產率和產量往往受到細胞代謝失衡的限制難以被進一步提升。因此,若只采用靜態調控,相關基因表達水平過低,會導致產物合成的代謝流不足,而過高的表達量則不僅會導致較多冗余的mRNA、蛋白質或中間產物積累,而且還可能對細胞生長有一定的抑制作用,如細胞生長遲緩或產生適應性不良反應,從而降低產量[10]。為了適時地平衡產物合成所需的基因表達與全局代謝水平之間的關系,動態調控基因通路的引入能夠實時響應代謝信號,并及時進行反饋調節,以便適應宿主內部代謝或環境的變化[30-32],實現穩定合成所需產物,提高發酵培養的穩定性和可放大性。
通常,動態調控是通過設計與構建基因通路單元,使重組細胞可以動態地感應并處理特定信號,從而根據信號的改變進行適應性調控,達到產物合成或目標系統的最優化狀態[33]。該系統中的特定信號可以是代謝通路中的中間產物、細胞系統的代謝物或蛋白等因子,也可以是外源引入合成的信號分子等。相比于靜態調控,動態調控是一個以信號響應為基礎的動態調控過程,因此可以在線感知細胞狀態并進行實時代謝調控[34]。該策略已經在較多研究中得以應用并實現目標產物的大幅度增產,如番茄紅素、脂肪酸、氨基酸、肌醇等高附加值生物合成制品[35-36]。
2 動態調控系統
根據構建原理或響應機制不同,動態調控系統可以分為代謝物依賴型動態調控和非代謝物依賴型動態調控;而根據其調控方式不同,又可以分為單向動態調控和雙向動態調控。其中,代謝物依賴型動態調控是以目標通路的代謝產物以及因引入目標通路而引起變化的內源代謝物為響應信號的調控方式。而非代謝物依賴型動態調控是以外界環境因素或外源引入的與細胞系統正交的調控因子作為響應信號的調控方式(圖2)。單向動態調控是基于響應信號對目標基因表達只進行單一上調或下調調節[37],而雙向動態調控則可以實現上調和下調同時調節。表1中列出了近年來動態調控用于代謝工程改造的典型應用案例,包括了產物產量優化、調控網絡構建、嵌段大分子合成等。
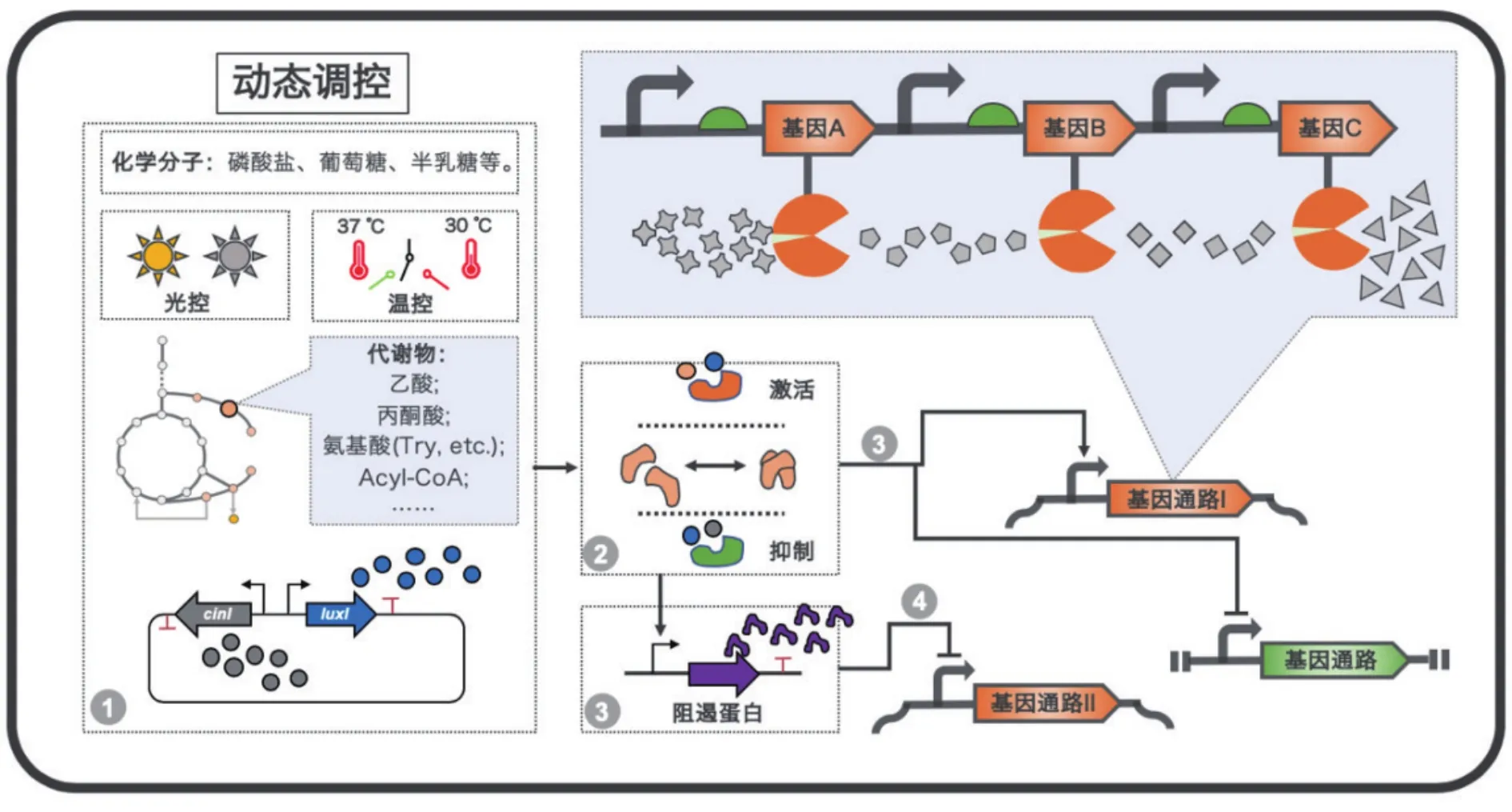
圖2 動態調控系統概覽

表1 動態調控應用于代謝工程改造的典型范例。
2.1 代謝物依賴型動態調控
代謝物依賴型動態調控通常是通過構建生物傳感器感應代謝物的濃度,從而該傳感器輸出信號可直接或間接調控目標基因的表達[44-45]。如番茄紅素的高效合成就是一個典型的研究案例。因為大腸桿菌生長過程中葡萄糖的過量供給會導致乙酸的積累,不僅抑制細胞生長,而且削弱了番茄紅素合成通路的代謝流通量,從而降低番茄紅素在大腸桿菌中的產率。研究發現,磷酸烯醇丙酮酸合成酶(Pps)是控制細胞內甘油醛-3-磷酸酯和丙酮酸之間平衡的關鍵,而異戊烯基焦磷酸異構酶(Idi)是番茄紅素合成通路中的限速步驟。而在糖酵解通路中,乙酰磷酸是從丙酮酸生成乙酸的中間產物,因此構建以乙酰磷酸分子為響應信號的生物傳感器是實現番茄紅素合成通路動態調控的關鍵。為此,研究者構建響應乙酰磷酸濃度的動態調控開關,在胞內乙酰磷酸出現異常累積的情況下,上調磷酸烯醇丙酮酸合成酶(Pps)和異戊烯基焦磷酸異構酶(Idi)的表達水平,從而將丙酮酸逆向轉化成番茄紅素的上游合成前體磷酸烯醇丙酮酸,同時由于異戊烯基焦磷酸異構酶(Idi)的過表達,番茄紅素合成的關鍵酶表達量增加,增強了番茄紅素的代謝流通量,從而起到減少乙酸積累和增強番茄紅素合成的目的。通過對比發現,基于動態調控所獲得的番茄紅素滴定產量比簡單的基因過表達方式所合成的產量提高18倍,同時產率也得到較顯著的提升[46]。
因此,此類動態調控系統的關鍵有兩點:一是找到與目標代謝通路關聯且影響顯著的代謝物;二是構建以該代謝物作為響應信號的生物傳感器[47]。有趣的是,細胞系統內通常天然存在各種各樣的動態調控系統,用于調節自身的細胞活動。因此,我們可以通過分子生物學和合成生物學手段對這種類型的生物傳感器進行挖掘和二次開發,變成實際代謝工程改造中所適用的動態調控元件[48]。如研究發現脂肪酸合成通路中的關鍵中間產物脂肪酰輔酶A能與配體響應型轉錄調控因子FadR蛋白結合,解除FadR蛋白對轉錄起始位點的抑制作用[49]。因此,有研究者通過啟動子工程改造獲得具有更嚴謹轉錄調控性能的響應開關,建立基于脂肪酰輔酶A響應的動態調控系統,從而實現生物柴油合成通路中各基因模塊的動態調控,平衡目標通路代謝物在胞內的有效流通,減少宿主細胞的代謝壓力并提高生物柴油合成的穩定性和滴定產量[50-51]。
這種基于天然調控因子改造而來的動態調控系統,可以有效地拓寬動態調控的應用范圍,如拓展至其他代謝途徑的代謝物,可應用于多種宿主進行調控等。經研究表明,大腸桿菌內至少有36種此類配體響應型轉錄因子可供開發使用[50]。另外,來自其他生物體的配體響應型轉錄因子也非常多。例如,氨基酸響應的轉錄因子[52-53],葡萄糖[54]、乙酸[55-56]、磷酸根應答型轉錄調控蛋白等[57]。基于這些轉錄因子組成的動態調控系統可以用于宿主或異源宿主的代謝工程改造中,以實現目標代謝物合成關聯基因的動態調控,從而提高產物產量和重組菌株的魯棒性。
2.2 非代謝物依賴型動態調控
非代謝物依賴型動態調控是通過感應外界環境因素或與宿主細胞系統正交的信號分子而實現基因表達的動態調控。與代謝物依賴型動態調控相比,該調控方式的要點在于不依賴目標代謝通路,通用性強,但需重點評估外源信號引入對宿主代謝的影響。目前,該類型動態調控大致包括群體感應[58]、光控[41]、非編碼 RNA[39,59]、溫控[60]等(圖 2)。
群體感應是細胞群體中,由于特定信號分子(如內酯類)隨著細胞生長而不斷積累,在一定生長密度下積累的信號分子可以誘導或關閉特定基因表達,是細胞生長過程中響應細胞密度的典型調控方式之一,目前已被廣泛用于代謝調控領域[61-62]。利用群體感應系統對導向內源代謝路徑的代謝通量進行可控限制,以增加碳源進入目標產物合成路徑的代謝通量,進而動態地控制大腸桿菌中糖酵解過程和產物合成途徑的代謝流,以平衡細胞生長和產物合成的協同,達到較優的產物滴定度。該方法已用于合成莽草酸、葡萄糖二酸、肌醇、甜沒藥烯等[40,63-64]。
近年來,光遺傳工具的開發也取得了較大的進展,并逐步解決動態調控中響應速度慢、便攜性差、動態表達能力低等難題。光感應蛋白可以通過響應不同波長的光源形成單聚體或多聚體結構,從而改變蛋白和特定核酸序列的結合能,實現基因表達的可控調控。最近,研究報道在酵母中通過構建光控動態雙向調控系統,大幅提升異丁醇和2-甲基-1-丁醇的產量,其小試發酵罐產量分別高達8.49 g/L和2.38 g/L[41]。目前,光控系統還被用于控制蛋白發生快速、可逆的相分離,從而提高代謝通路中相關酶的催化效率以及實現更精細的代謝調控,以脫氧紫色桿菌素的合成為模型的驗證實驗表明,最終產量提高6倍,產品特異性提高18倍,效果顯著[65]。
此外,基于溫度響應的動態調控系統也可被用于細胞代謝工程改造的相關研究。例如溫敏阻遏蛋白(CI857)是被研究和應用最廣泛的。它在30oC時以單聚體的形式存在,從而結合并抑制lamda啟動子的轉錄活性;在37℃時,該蛋白形成二聚體從啟動子區釋放出來,轉錄活性得以恢復。研究通過將重組細胞的培養溫度從37oC轉換到30℃,使得細胞在37℃表達保持細胞的正常生長所需的異檸檬酸脫氫酶,生長期結束后調整溫度至30℃,抑制異檸檬酸脫氫酶的表達,以減少細胞代謝中α-酮戊二酸合成對目標產物合成的分流,因此細胞也將從生長期轉移到生產階段實現產量提升[60]。
目前,光控和溫控調控系統得益于其本身輸入信號的可移除性,在代謝工程中有著更廣泛的潛在應用價值。但由于需要光敏和溫敏蛋白的表達,其表達水平對宿主全局代謝以及目標代謝通路可能存在的影響需要謹慎評估,盡量減少系統噪音。其次,由于光控設備引入以及光在放大過程中的非均一性分布,也限制了光控在更大培養體系中的應用。而基于群體感應系統構建的動態調控線路,對于細胞密度的敏感性控制難度大,在放大培養中容易失活,但易于實現自調控。相對而言,基于代謝物響應的動態調控系統與宿主有較好的相容性,也便于實現自調控,但響應信號分子的篩選及其對應生物傳感器的改造難度大。
2.3 動態雙向調控
前文提到的單向動態調控系統是目前研究最多、應用最廣的調控方式之一。而相比于單向動態調控,雙向動態調控可以同時實現不同基因或代謝路徑的激活和抑制表達[66]。近年來,因為雙向動態調控可實現更復雜的控制邏輯,為代謝調控提供更多元化的選擇,在代謝工程改造中有較好的靈活性,關于雙向動態調控的研究報道也越來越多[67-69]。
目前,動態雙向調控主要應用于解決細胞前期生長和后期產物合成的矛盾,實現目標合成通路及與其競爭的生長依賴型代謝通路之間的分段式調控,實現細胞生長和產物積累的最大化[70-72]。如研究結合光控動態表達系統和非門基因電路設計的動態雙向調控在酵母中實現異丁醇的高產[41]。此外,Dinh等[62]通過組合基于同一種內酯分子(OC6)響應的抑制型和激活型兩種群體感應系統,構建了感應細胞密度的雙向動態自調控系統,分別在重組大腸桿菌中實現柚皮素和水楊酸的高效合成。
除此之外,動態雙向調控目前還可以被用于合成人工定制化的生物大分子(圖3-B),比如嵌段型蛋白復合體[43]、高分子生物聚酯材料等。
3 動態調控系統的構建及表征
3.1 動態調控系統的構建
動態調控系統一般主要由3部分組成,包括輸入信號,信號處理模塊(生物傳感器),信號輸出(或執行機構)[73-75]。其中,這3個部分元件的選擇、改造以及組合方式,決定著動態調控系統的功能與性能。輸入信號可以為直接添加的化學分子(如阿拉伯糖、半乳糖、乙酸等)、外界物理條件(如光、溫度等)或者通過基因通路設計合成的生物分子(如群體感應分子、RNA、脂肪酸、氨基酸等),如圖2所示。而生物傳感器的設計是整個動態調控系統的關鍵[76]。目前主要的構建方法包括響應蛋白突變改造[77-78]、響應蛋白復合體的組合設計[79-80]、響應蛋白與核酸結合區域的設計[49]等,這類型方法均可以改變生物傳感器的“輸入-響應”曲線,從而改變生物傳感器對輸入信號的響應范圍和靈敏度、輸出值的動態范圍、響應閾值等參數(圖4-A),以匹配實際的應用需求。
動態調控系統在控制上一般需要滿足兩個要求,分別是可定時控制[81]和可控值輸出。定時控制可以很好地平衡細胞生長和產物合成之間的關系,可控值輸出可以為目的產物合成提供適配的胞內蛋白豐度的同時,盡可能實現細胞系統能效轉換的最大化。
隨著合成生物學的發展,動態調控在精細化生物合成中的作用將日趨重要,優勢顯像。因此,動態調控單元的組合使用,理論上將實現更為復雜多樣的控制邏輯。但是,目前受限于對細胞系統的深入認知,多層級(>3層)信號傳遞的調控系統在實際應用中容易出現信號衰減甚至丟失而導致控制系統失活的現象[82]。因此,在動態調控系統的設計過程中,充分考量其簡單易用性,能很好地保障其性能發揮的穩定性和生物工程應用的可放大性。此外,目前低層級信號級聯(≤3層)動態調控系統的開發與應用仍具有重要的意義,因其不僅可以為未來復雜的動態調控系統奠定豐富的元件庫和研究基礎,而且還能啟發研究者更好地理解生命系統錯綜復雜的代謝調控網絡。
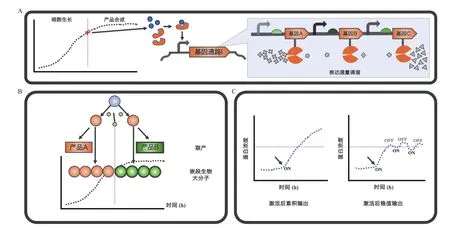
圖3 動態調控的應用展望
3.2 基于報告基因的系統表征
由于調控系統一般涉及復雜的信號傳遞,因此很難確定信號的識別和反饋控制。為了解決這個問題,很多研究通常引入熒光報告基因編碼的熒光蛋白或基因簇(如綠色、紅色、黃色熒光蛋白等),通過檢測熒光蛋白的表達量,實現響應性能表征。一般來講,基因元件的基礎表征對于元件的利用是極其重要的。元件本身的特性直接影響其在實際使用中的表現。例如,當傳感器在無輸入狀態下的背景輸出較大時,不適用于對低表達敏感的基因的控制等[12]。
對于動態調控系統,除了傳感器本身的“輸入-響應”關系表征外,還需要考慮傳感器在細胞不同生長期的響應表現[83],以及響應速度等特征(圖4-B)。因為動態調控在實際代謝工程的應用中容易受細胞培養濃度的影響,往往在高細胞密度條件下失去功能。而傳感器對輸入的響應速度對信號級聯式控制也至關重要[82]。最后,系統地評估傳感器與宿主之間的相容性,有利于改善因引入外源系統帶來的系統噪音影響[83]。目前,可以通過轉錄組學、蛋白組學等系統生物學方法對全局代謝系統進行差異分析,以評估影響的顯著性[83]。同時,基于細胞生長表型,如生長的趨勢、營養物代謝速率等參數,來進行綜合性生物學評價[12]。結合以上評估方法,可以有效地提高動態調控系統在不同培養規模下的可用性和穩定性。
4 展望
動態調控的關鍵點在于輸入信號響應,既包括響應特定代謝物的生物傳感器構建,也包括生物傳感器在更高細胞濃度下的有效響應,這兩個技術難點目前仍是動態調控的核心挑戰。尤其對于細胞生長進入平臺期后的基因表達調控。因為在大多數胞內外產物積累末期,實現細胞形態變化[84]或誘導裂解細胞釋放產品[85]便于下游分離提純,可以很大程度上解決細胞人工破壁的成本。除此之外,信號的快速輸入與移除,也將影響動態調控的效率。如溫控的均一性好,但升溫降溫響應存在滯后;而光控的輸入快,但是均一性差,且放大過程中裝置的設計或改造難度大。綜上所述,動態調控在構建可工業化應用的細胞工廠中仍存在很多挑戰,并需要進一步研究探索。但動態調控仍然是代謝工程領域的一個高效、創新的重要技術方向。
最近,根據 RNA 調控[86]和“蛋白 - 蛋白”調控[87]等研究表明,動態調控未來有實現轉錄后或翻譯后調控的可能,從而減少目前基于中心法則的長行程基因表達帶來的噪音和遲滯引發的不穩定性,同時也可以實現更快速、精準的輸入和輸出響應,強化代謝調控的特異性。
另外,動態調控與其他代謝工程改造方法的創新性組合使用也有利于細胞工廠在產物合成中產量、轉化率和產率(TYP:Titer,Yield,Productivity)的進一步提升[88]。如結合靜態和動態調控的各自優點,實現基因表達在時間和表達水平上的最優化組合。靜態調控可以通過基因敲除、啟動子或RBS改造等方法,將目標合成路徑的代謝流進行調諧,有效地導引底物向產物的催化轉化,減少副產物或中間產物的積累;而動態調控可以控制激活合成通路和抑制競爭旁路的時機。從而當依據靜態調控水平去激活目標基因表達時,既保證了細胞在對數期的正常生長,又實現細胞工廠高效的產物積累(圖3-A)。以大腸桿菌合成肌醇和葡萄糖二酸為例,研究者已通過構建感應細胞密度的生物傳感器,調控葡萄糖-6-磷酸(G6P)的下游代謝分流。即在低細胞密度的條件下,葡萄糖-6-磷酸進入糖酵解和磷酸戊糖途徑供給細胞生長,在高細胞密度下,葡萄糖-6-磷酸則作為肌醇合成的底物,從而提高肌醇和葡萄糖二酸的產量[40]。因此,被激活的肌醇或葡萄糖二酸的合成通路可以先通過基因表達調諧來確定合適的表達強度,然后再通過細胞密度傳感器來激活表達,以減少過量表達導致細胞出現過載的代謝負荷(圖 3-A)[89]。
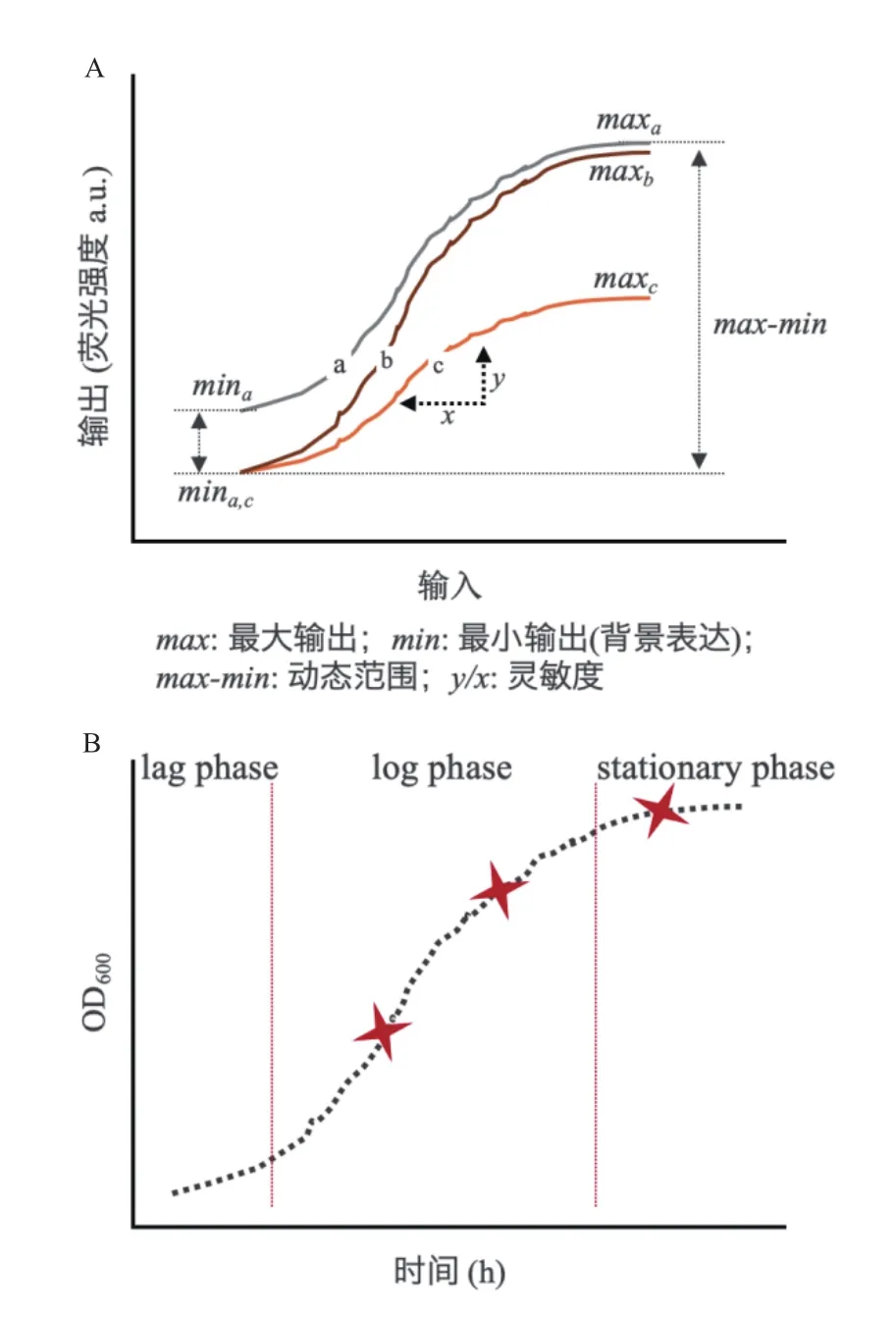
圖4 生物傳感器的表征
此外,從光控誘導合成異丁醇的生物發酵過程可得,動態調控系統與基因振蕩器聯用控制目標基因表達也可能帶來更好的產品積累量。研究基于光控動態表達系統對酵母中乙醇和異丁醇的合成通路的關鍵酶進行定時的激活和抑制控制[41]。有趣的是,在小試發酵實驗中,在特定時間激活異丁醇合成通路表達后,間歇式的光控誘導所合成的產物濃度比持續性的誘導方式要高。因此,在激活未經調諧的代謝通路時,采用間歇式的轉錄調控方式可以減少細胞內目的蛋白的過度積累,從而維持細胞正常的代謝水平和提高產物合成效率(圖3-C)。
除代謝工程改造以外,動態調控系統還可以用于研究微生物群落[90-93]、細胞靶向藥物釋放[94]、細胞表型變化[95]、相分離控制[65]等領域。尤其是多個動態調控單元級聯的復雜調控網絡構建[42],既可用于構建仿細胞代謝調控的網絡動態[96],也有利于研究者深入探索和解析復雜的細胞代謝調控網絡機制。隨著更多生物傳感器的開發,以及工程化理性設計的發展,結合日漸豐富先進的生物技術,如高通量自動化平臺、DNA合成及測序等,細胞工廠的工程化改造將實現快周期、智能化、高效率的革命性突破。

