擬南芥EBP1蛋白與RNA相互作用的初步研究
李曉燕 李馳宇 于峰 廖紅東
(湖南大學生物學院,長沙 410082)
基因表達調控是分子生物學研究的重要領域,主要包括轉錄調控、轉錄后調控、mRNA翻譯、翻譯后調控4個方面[1]。隨著RNA-seq、RNA免疫共沉淀(RNA immunoprecipitation,RIP)、紫外交聯免疫沉淀(Crosslinking-immunprecipi tation,CLIP)等技術的成熟,RNA轉錄后調控機制成為新的研究熱點[2]。轉錄后調控包括RNA包裝加工、RNA可變剪接、RNA定位、RNA穩定性、RNA翻譯等過程[3],每個環節都需要RNA結合蛋白(RBPs)的參與調節[4]。RBPs廣泛存在于微生物、植物、動物體內[5]。在微生物中,普城沙雷氏菌G3的RNA結合蛋白Hfq(a host factor for RNA phage)促進YadA(Yersinia adher-ence protient)和InvA(Invasion on associated protein)mRNA與核糖體的結合,進而促進了兩種粘連蛋白YadA和InvA的產生,增強菌體的適應性[6]。在植物中,RNA結合蛋白HOS5(High Osmotic Stress Gene Expression 5) 結 合RS40(Serine/arginine-rich proteins) 的 前 體 mRNA, 調節其可變剪切,確保水稻對鹽脅迫的耐受[7];甘氨酸富集的RNA結合蛋白AtRZ-1b結合FLC(Flowering Locus)的mRNA促進FLC第一個內含子高效剪接從而促進擬南芥植物開花[8]。在動物中,人類線粒體RNA結合蛋白C6orf203抑制OXPHOS(Oxidative phosphorylation)mRNA 與 核糖體結合,進而抑制OXPHOS蛋白的合成[9]。直腸癌細胞RNA結合蛋白HUR(Hu antigen R)通過腸上皮的核仁磷酸蛋白調節Rac1(Ras-related C3 botulinum toxin substrate 1)mRNA 的 核 質 穿 梭[10]。另 外,EBP1蛋 白 通 過 與AR(Androgen receptor)mRNA 3'-UTR富含UC的motif相互作用,促進ARmRNA的降解,同時EBP1還與ARmRNA 5'編碼區的CAG莖環結合,抑制AR的翻譯,從而抑制前列腺癌細胞的生長[11]。
EBP1是受體酪氨酸激酶ErbB3(Erythroblastic leukemia viral oncogene homolog)的磷酸化底物,是調控動植物生長發育、應激反應重要的DNA和RNA結合蛋白。在動物中,EBP1作為DNA結合蛋白與E2F1(E2F transcription factor1)基因的啟動元件相互作用,抑制E2F1基因轉錄,進而抑制細胞生長[12]。另外,EBP1也可作為RNA結合蛋白,以核糖核蛋白的形式發揮功能,不僅參與不同種類rRNA的成熟過程[13],也可以綁定mRNA并調控其翻譯。例如,人類EBP1蛋白通過富含賴氨酸的基序361SASRKTQKKKKKKAS375與口蹄疫病毒的核糖體進入位點(The internal ribosome entry site,IRES)相互作用,促進48S起始復合物的形成[14];EBP1也可以通過σ70-like motif(46-54氨基酸)結合5S rRNA,調控其成熟過程[15]。EBP1蛋白在動物和植物中結構和功能高度保守,已有報道EBP1在植物中也可以直接綁定DNA[16]。擬南芥EBP1蛋白直接綁定CML38啟動子片段,抑制CML38基因表達[16]。最新質譜結果顯示擬南芥EBP1參與核糖體生物生成、蛋白質翻譯等過程,可以綁定mRNA、rRNA、snoRNA、tRNA等多種RNA[17]。但已報道的EBP1的靶基因甚少,EBP1綁定RNA的結構域、參與轉錄后調控具體機制目前仍不清楚。本研究通過RNAEMSA(RNA electrophoretic mobility shift assay) 等實驗證實EBP1體外結合RNA,并通過生物信息學預測了EBP1結合RNA的結構域,RIP實驗找到 了 3個靶基 因 RNA(AT1G24792、AT3G25211、AT3G24320)。為了研究EBP1對靶RNA的轉錄后調控,蟲草素處理實驗發現,EBP1促進AT1G24792、AT3G24320的mRNA的降解,而對AT3G25211的mRNA穩定性沒有影響。通過核糖體提取實驗發現EBP1抑制AT1G24792、AT3G24320的mRNA與核糖體結合,而促進AT3G25211的mRNA與核糖體結合。以上實驗結果表明,擬南芥EBP1作為一個RNA結合蛋白,參與調控下游靶基因mRNA穩定性與翻譯速率,為研究該蛋白的生物學功能提供了新的方向。
1 材料與方法
1.1 材料
1.1.1 主要材料 擬南芥野生型Col-0、ebp1-1(SALK_030408)、ebp1-2(SALK_052695)、ebp1-3(CS854731)、35S∷EBP1-GFP植物材料以及EBP1-pGEX-4T-1 BL21的菌種由中南大學生命科學學院李馳宇提供。將擬南芥種子經表面消毒后,點播在pH為5.8、含0.8%瓊脂的1/2 MS固體培養基上,4℃春化3 d后,于22℃,長日照(16 h光照/8 h黑暗)垂直放置培養7 d進行后續實驗。
1.1.2 主要試劑 GST-Resin(貨號:B074B)購于徐州博天生物有限公司;異丙基-β-D-硫代半乳糖(IPTG)(貨號:A100487-0005)、卡那霉素(貨號:A506636-0025)以及氨芐青霉素(Amp)(貨號:410V033)、還原性谷胱甘肽(貨號:A100399-0025)、PMSF(貨號 :4100745-0005)均購于生工生物工程上海有限公司;Protein GFP Trap(貨號:SA070005)購于常州天地人和生物有限公司;蛋白酶抑制劑(貨號:B14001)、磷酸酶抑制劑(貨號:B15001)購于Selleck Chemicals;RNA酶抑制劑(貨號:N251A)、SYBR PremixTaqkit(貨號 :SQ121)均購于一諾唯真生物公司,Thermo逆轉錄試劑盒(貨號:K168);FITC修飾探針擎科生物公司合成,其他生化試劑為國產分析純。
1.2 方法
1.2.1 生物信息學分析 EBP1一級結構域預測:將 TAIR網 站(https://www.arabidopsis.org/)查 找的擬南芥EBP1(AT3G51800)的氨基酸序列導入Pfam網站(http://pfam.xfam.org)預測EBP1蛋白質結構域。EBP1晶體結構預測:將EBP1氨基酸序列 輸 入 Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2)網站進行EBP1晶體三維結構預測分析,通過PyMOL軟件進行顏色、結構旋轉等修飾。RNA多序列比對分析:利用NCBI網站(https://blast.ncbi.nlm.nih.gov/Blast.cgi) 的BLAST功 能, 以“GUCUCUCACUGCGACGGCUU”序列為模版,進行RNA多序列比對,獲得包含此RNA序列的潛在靶基因,并下載包含“GUCUCUCACUGCGACGGCUU”長度為60 bp的潛在靶mRNA序列,用Clustal X軟件(Invitrogen公司)進行Alignment比對(參數為Multiple Mode Alignment、Font size10)導出 Fasta文件,再用Bio-Edit進行顏色、字體、間距的美化。RIP實驗引物設計:在TAIR網查找以上潛在靶基因的cDNA,再通過Primer Premier 5軟件設計包含潛在結合區域的引物,于擎科生物公司合成,用于后續實驗(引物列表見表1)。
1.2.2 EBP1-GST蛋白誘導 將包含EBP1-pGEX-4T-1或pGEX-4T-1的BL21大腸桿菌蛋白表達菌株,以1∶1 000的比例接種于5 mL LB液體培養基中(含100 μg/mL Amp)中,37℃,200 r/min 培養 12-16 h 后,以1∶100接種于200 mL含有100 μg/mL Amp的LB液體培養基中,37℃,200 r/min培養,至OD600=0.8,加入工作濃度為0.5 mmol/L的蛋白表達誘導劑IPTG,28℃,100 r/min誘導6 h。
1.2.3 GST蛋白純化 將誘導好的EBP1-GST菌液分裝于50 mL離心管,4℃,5 000 r/min離心10min,去除上清。加入7 mL蛋白裂解緩沖液(50 mmol/L Tris,150 mmol/L NaCl,1 mmol/L PMSF,pH 7.5)重懸菌體,冰上超聲破碎EBP1-GST菌體(功率200 W,超聲6 s,冷卻9 s,重復破碎約15 min至裂解液澄清)。超聲破碎后的懸液于4℃,6 000 r/min離心5 min,將上清轉移至10 mL Ep管中。取500 μL GST純化柱(GST agarose),用1 mL蛋白裂解緩沖液重懸GST純化柱,4℃,100 ×g離心1 min,去除上清,并重復該步驟3次洗去保護液。去除上清后,轉移到裝有細菌破碎液的10 mL Ep管,4℃旋轉孵育8 h。孵育后的液體,4℃,1 000 r/min 離心1 min,去除上清,并將GST純化柱轉移到2 mL Ep管,加入1 mL蛋白漂洗緩沖液(50 mmol/L Tris,300 mmol/L NaCl)重懸,4℃顛倒5 min,以洗去非特異性結合的蛋白,此過程重復3次。離心去上清后加入1 mL蛋白洗脫緩沖液(20 mmol/L Tris pH 7.5,20 mmol/L GSH,150 mmol/L NaCl),4℃洗脫 3 h。取10 μL純化的蛋白,進行SDS-PAGE凝膠電泳考馬斯亮藍染色檢測。
1.2.4 EBP1-GST與總RNA結合實驗 取8 μL純化的EBP1-GST蛋白(以GST蛋白作為對照)加到100 μL總蛋白綁定緩沖液(150 mmol/L NaCl,20mmol/L Tris-HCl pH 7.4,0.5 mmol/L EDTA,蛋白酶抑制劑)中,然后在總蛋白綁定緩沖液中分別加入50 μL的GST純化柱(已用總蛋白綁定緩沖液洗3次),4℃結合3 h后,用總蛋白綁定緩沖液洗3次,每次5 min,洗掉雜蛋白,備用。用TRIzol法提取擬南芥RNA,用36 μL水溶解,吸取2 μL檢測是否降解(質量合格的RNA有3條帶,從大到小分別是28S、18S、5.8S)。將結合有EBP1-GST、GST蛋白的GST純化柱以及沒有孵育蛋白的GST純化柱中加入20 μL的RNA和100 μL總蛋白綁定緩沖液(包含8 U/mL RNA酶抑制劑)室溫孵育30 min,其余RNA存放于-80℃冰箱,用1 mL總蛋白綁定緩沖液將GST純化柱洗3次,洗去未結合的RNA,利用TRIzol法提取樣品中的RNA,取2 μL -80℃儲存的RNA,與其他實驗樣品一起用瓊脂糖凝膠電泳檢測RNA含量,同時測定RNA濃度及OD260值[18]。
1.2.5 RIP實驗 稱取生長7 d的EBP1-GFP植物幼苗3 g,置于50 mL離心管中,用清水洗3次,加入35 mL 0.5%甲醛,立即真空固定5 min(壓力為9MPa),釋放真空,繼續固定8 min,然后加入1.5 mL 2 mol/L甘氨酸,抽真空1 min,釋放真空,再抽真空5 min(終止甲醛交聯反應),釋放真空,清水洗5次,用吸水紙去除水分,液氮速凍。將幼苗在液氮中充分研磨,加入500 μL總蛋白提取液(20 mmol/L Tris-HCl pH 8.0,5 mmol/L EDTA,5 mmol/L EGTA,0.05%SDS,10 mmol/L DTT,1 mmol/L PMSF,1% 蛋白酶抑制劑,8 U/mL RNA酶抑制劑),冰上靜置1 h。4℃,12 000 r/min離心10 min,收集上清到新的1.5 mL Ep管,取100 μL植物抽提液作為Input,其余樣品分成兩份,一份作為對照組,一份作為實驗組。取兩份40 μL GFP-Tarp,用RIP結合緩沖液(20 mmol/L Tris-HCl pH 8,150 mmol/L NaCl,2 mmol/L EDTA,0.1%SDS,1% TritionX-100)洗3次,去上清,加入300 μL RIP結合緩沖液和1 mL Chip稀釋緩沖液(16.7 mmol/L Tris-HCl pH 8,167 mmol/L NaCl,1.2 mmol/L EDTA,1.1% TritionX-100,8 U/mL RNA酶抑制劑,1%蛋白酶抑制劑),再分別加入實驗組和對照組的植物抽提液,4℃結合過夜。將結合有蛋白的GFP-Tarp用RIP結合緩沖液洗3次以洗去雜蛋白,去上清后加入50 μL RIP洗脫緩沖液(100 mmol/L Tris-HCl pH 8.0,100 mmol/L EDTA,0.1% SDS,1 U/mL RNA 酶抑制劑),65℃振蕩10 min,離心后將上清轉移至新的Ep管,再向GFP-Tarp中加入50 μL RIP洗脫緩沖液,65℃振蕩10 min,將兩次上清合并,在Input以及上清加入1 μL 14 mg/mL蛋白酶K,56℃放置1 h,釋放結合的RNA,之后用TRIzol法提取RNA,逆轉錄獲得cDNA,作為進一步qRT-PCR的模板,以上試劑均用DEPC水配制。
1.2.6 RNA-EMSA實驗 將100 ng純化的EBP1-GST蛋白(GST空載蛋白作為對照)和100 pg FITC熒光修飾的RNA探針(不帶FITC修飾的RNA競爭探針作為對照)加入RNA-EMSA結合緩沖液(10mmol/L Tris,5%甘油,1 mmol/L MgCl2,50 mmol/L KCl,0.2 mg/mL BSA,0.5 mmol/L DTT,0.5 mg/mL polyglutamate pH 7.5)中,室溫放置20 min。用6.5%非變性聚丙烯酰胺凝膠(6.5%凝膠儲液,10%甘油,1%過硫酸銨,TEMED,0.5×TBE)先在冰上預電泳0.5 h,沖洗膠孔,上樣,電泳1 h后,用KODAK 4000M Image Station 顯影[19]。
1.2.7 蟲草素(cordycepin)處理實驗 取1/2 MS固體培養基上生長7 d的擬南芥幼苗,浸沒于CRD處理緩沖液(1 mmol/L哌嗪-1,4-二乙磺酸,1 mmol/L檸 檬 酸 鈉 pH 6.25,1 mmol/L KCl,15 mmol/L 蔗糖,150 μg/mL蟲草素)中,抽真空3 min后,繼續放置于22℃光照處理15 min、30 min、45 min后,提取RNA并逆轉錄成cDNA,用于后續qRT-PCR檢測[20]。
1.2.8 核糖體提取實驗 取生長7 d的擬南芥幼苗1g,用紙吸干,液氮充分研磨后,每個樣加入500 μL提取液(0.2 mol/L Tris-HCl pH 7.5,50 mmol/L KCl,25 mmol/L MgCl2,50 μg /mL 放線菌酮,50 μg/mL 蟲草素,400 U/mL RNA酶抑制劑,10 μL蛋白酶抑制劑Cocktail,1 mmol/L PMSF)冰上抽提30 min,同時在預冷的50 mL離心管鋪制10%-60%梯度的蔗糖,將植物提取液4℃,12 000 r/min離心10 min。取上清輕輕滴加在已鋪好的蔗糖上層,同時將沒有植物樣品各梯度蔗糖作為對照。4℃,32 000 r/min離心4 h。離心后取不同梯度組分,測定各個組分OD260吸光值。提取45%-60%蔗糖梯度組分的RNA,逆轉錄得到的cDNA用于后續qRT-PCR檢測[21]。
1.2.9 RNA提取與qRT-PCR 用TRIzol法提取擬南芥總RNA后,通過逆轉錄試劑盒逆轉錄成cDNA,用Bio-rad定 量PCR儀(C1000 TouchTMThermal Cycler)進行qRT-PCR實驗。
2 結果
2.1 EBP1蛋白結合RNA的結構域分析
擬南芥EBP1一級結構域預測結果發現,在48-56氨基酸區域存在結合RNA的結構域(圖1-A)。同時我們在Phyre2網站預測了其晶體結構,發現人類與擬南芥EBP1于蛋白表面均含有兩個封閉的環狀結構(Loop)。擬南芥EBP1蛋白48-56氨基酸區域就位于Loop1環結構中,并且此序列與人類EBP1報道的結合RNA的σ70-like motif(46-54氨基酸)序列類似(圖1-B),這暗示EBP1在結構上具有結合RNA的潛能。

表1 引物列表
2.2 EBP1在體外直接綁定RNA
為了進一步驗證EBP1蛋白是否可以直接結合RNA,我們首先進行了總RNA結合實驗(圖2),實驗結果顯示:GST蛋白結合的泳道(第三泳道)與對照組GST純化柱結合的泳道(第二泳道)RNA條帶亮度基本一致,EBP1-GST蛋白結合的RNA條帶(第四泳道)與第二泳道相比亮度明顯增強(圖2-A)。定量分析顯示,對照組GST純化柱、GST蛋白和EBP1-GST蛋白結合的RNA濃度分別是0.041 2 μg/μL、0.044 8 μg/μL、0.132 4 μg/μL(表 2)。以上實驗數據表明EBP1-GST蛋白結合RNA的濃度明顯高于對照組(P<0.05),而GST蛋白與對照組基本一致(P>0.05),即EBP1-GST可以結合部分RNA,GST蛋白不能結合RNA。
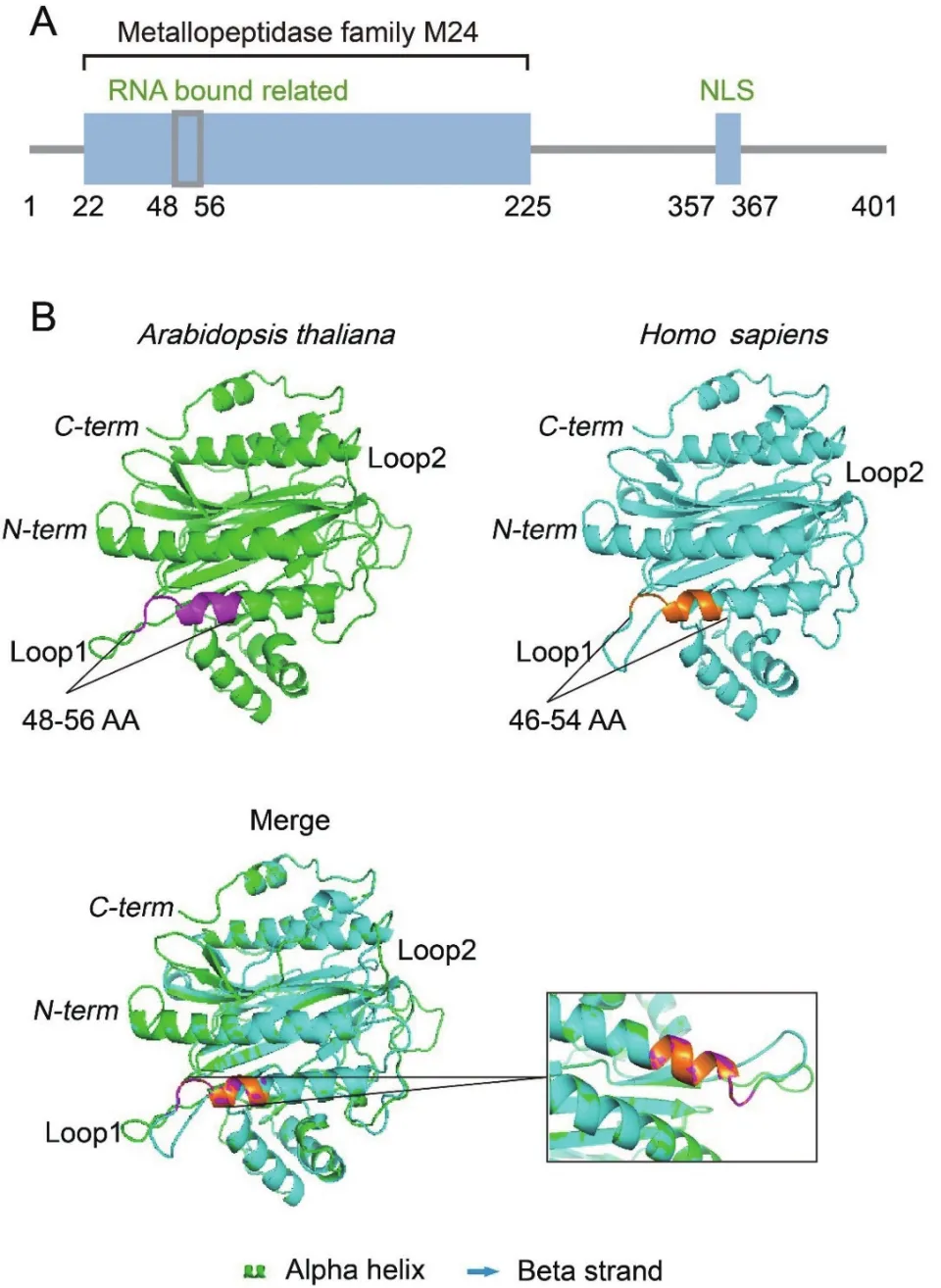
圖1 EBP1蛋白結構域分析
進一步表達并純化了EBP1-GST蛋白(圖2-B),然后合成FITC修飾的探針“GUCUCUCACUGCGACGGCUU”(Probes)以及不修飾的探針“GUCUCUCACUGCGACGGCUU”(Competitor),通 過與EBP1-GST、GST蛋白孵育,同時用50倍和100倍的不修飾的特異性探針(Competitor)進行RNAEMSA實驗。實驗結果表明:對照組GST純化柱(第一泳道)和GST(第二泳道)蛋白與探針孵育的泳道沒有出現遷移的電泳條帶,EBP1-GST與探針孵育泳道(第三泳道),顯示出明顯遷移的電泳條帶,且條帶的強度隨著競爭性探針(Competitor)濃度的升高而減弱(第四、五泳道)。表明GST蛋白不能結合RNA,而EBP1蛋白可以直接綁定“GUCUCUCACUGCGACGGCUU”這一RNA序列(圖2-C)。
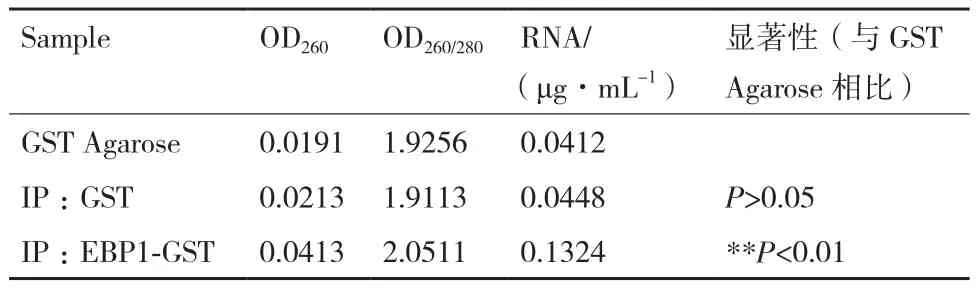
表2 樣品濃度及吸光值
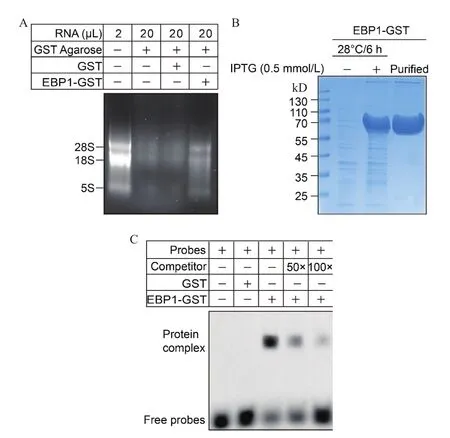
圖2 EBP1蛋白與RNA直接相互作用
2.3 在擬南芥體內EBP1綁定RNA
為了進一步驗證擬南芥EBP1在體內結合RNA,首先通過NCBI網站Blast找到12個基因含有“GUCUCUCACUGCGACGGCUU”序列(圖3-A):AT1G24792、AT3G24320、AT1G25211、AT1G07150、AT1G11810、AT5G55950、AT3G13830、AT3G14400、AT3G17265、AT3G21120、AT3G63200、AT3G24700,利用實驗室已有的EBP1-GFP轉基因過表達植株,結合RIP技術,對這12個潛在EBP1靶mRNA進行了RIP-qRT-PCR驗證。結果顯示:AT1G24792被對照組GFP-Trap免疫沉淀的RNA相對含量是2.623 40,被實驗組EBP1-GFP免疫沉淀的RNA相對含量5.094 07;AT3G24320被免疫沉淀的RNA在對照組和實驗組的相對含量分別是2.936 38、13.318 90。AT1G25211被免疫沉淀的RNA在對照組和實驗組的相對含量分別是3.462 92、9.613 54,這3個基因的mRNA被EBP1-GFP免疫沉淀后相比對照組有顯著性差異(AT1G24792,P<0.05;AT3G24320,P<0.001;AT1G25211,P<0.01),其他9個基因被EBP1-GFP免疫沉淀的RNA相比對照沒有顯著性差異(P>0.05)(圖3-B)。表明EBP1結合AT1G24792、AT3G24320、AT1G25211的 RNA, 并可能參與其轉錄后調控過程。
2.4 EBP1調控靶RNA的穩定性
為了研究EBP1對靶RNA轉錄后事件的調控,首先我們分析了EBP1對基因AT1G24792、AT3G24320、AT1G25211在RNA穩定性方面的影響。利用蟲草素這種轉錄抑制劑,結合qRT-PCR技術檢測靶RNA的降解速度,進而分析RNA的穩定性。于是對Col-0、ebp1-1、ebp1-2、EBP1-GFP植株用蟲草素處理后,進行qRT-PCR檢測。ATHSPRO2基因是一個已被報道mRNA不穩定的基因,蟲草素處理后ATHSPRO2mRNA會迅速降解,證明蟲草素處理有效(圖 4-A)。Col-0、ebp1-1、ebp1-2、EBP1-GFP植株在蟲草素處理0 min時這3個靶基因的mRNA含量均為1。相對于0 min mRNA含量,EBP1突變后AT1G24792mRNA的含量在蟲草素處理30 min、45 min分別為0.574 7、0.218,而對照組Col-0中AT1G24792mRNA分別是0.33、0.03,過表達EBP1-GFP AT1G24792mRNA含量在30 min、45 min分別為0.301 58、0.046 03(圖4-B);EBP1突變后AT3G24320mRNA在處理15 min、30 min后含量分別為0.222、0.191 1,對照組Col-0中AT3G24320mRNA在蟲草素處理15 min、30 min時的相對含量是0.642 8、0.33,過表達EBP1-GFP AT3G24320mRNA 含量在 15 min、30 min 分別為 0.202 5、0.13(圖4-C);EBP1突變后蟲草素處理15 min、45 min后AT1G25211mRNA相對含量分別是0.807 3、0.218 4,Col-0被蟲草素處理15 min、45 min后AT1G25211mRNA相對含量分別是0.802 0、0.263 9(圖4-D)。以上數據表明:EBP1促進AT1G24792、AT3G24320mRNA的降解,而對AT1G25211mRNA的穩定性沒有影響。
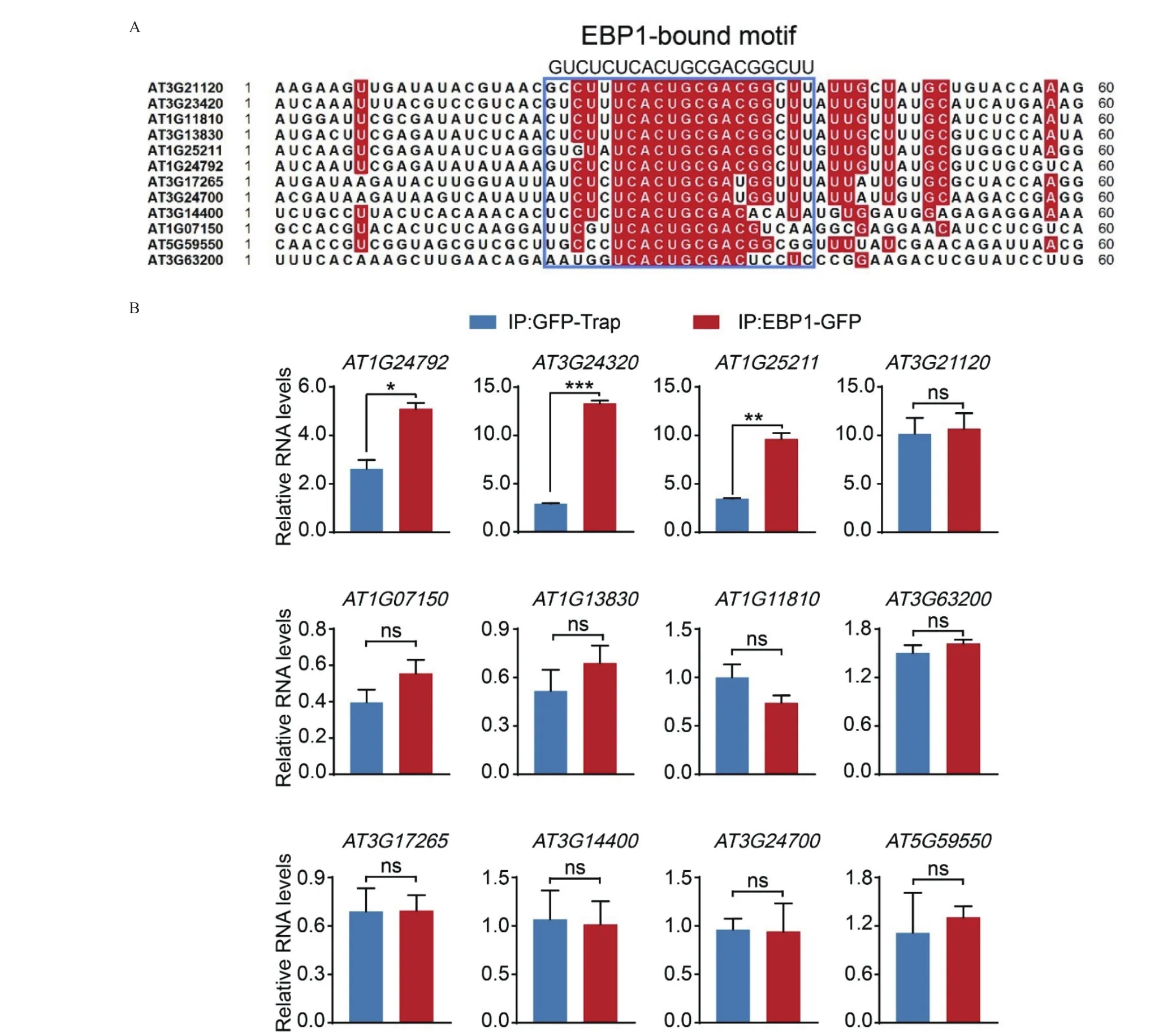
圖3 EBP1在體內與特定基因的mRNA相互作用
進一步我們通過qRT-PCR手段檢測Col-0、ebp1-1、ebp1-2、ebp1-3、EBP1-GFP植物中靶mRNA的含量(圖4-E-G)。數據顯示AT1G24792mRNA在Col-0、ebp1-1、ebp1-2、ebp1-3、EBP1-GFP的相對含量為1.660 57、4.297 34、5.955 5、1.904 86、0.873 17,即AT1G24792mRNA在ebp1-1、ebp1-2中明顯增多(P<0.05),而在過表達中mRNA沒有顯著改變(P>0.05)(圖 4-E)。AT3G24320的 mRNA相對含 量 在 Col-0、ebp1-1、ebp1-2、ebp1-3、EBP1-GFP分 別 為 1.034 72、2.661 91、2.310 78、4.561 03、0.392 15,即EBP1突變后AT3G24320mRNA的含量增加(P<0.05),EBP1過表達AT3G24320mRNA的含量減少(P<0.05)(圖4-F)。AT1G25211的mRNA相對含量在Col-0、ebp1-1、ebp1-2、ebp1-3、EBP1-GFP分別為 1、0.567 20、0.426 91、0.659 82、1.466 62,表明EBP1對AT1G25211的mRNA含量沒有顯著影響(P>0.05)(圖 4-G)。
綜合RNA穩定性和植物中靶mRNA表達量檢測的實驗結果,我們發現EBP1突變后AT1G24792、AT3G24320的mRNA穩定性增強,從而使這些基因的mRNA含量增加,即EBP1可以調控靶RNA的穩定性。
2.5 EBP1調節靶mRNA的翻譯速率
為了探究在擬南芥中EBP1是否對核糖體的成熟、mRNA的翻譯速率起調節作用,本實驗通過蔗糖密度梯度離心分離核糖體來檢測EBP1對3個靶基因mRNA翻譯速率的影響。數據顯示:AT1G24792在ebp1-1的多聚核糖體組分(8-11)中mRNA的相對含量分別是1.53、0.95、1.71、1.02,在Col-0植物的多聚核糖體組分(8-11)中相對含量是0.94、0.43、1、0.91(圖5-B);AT3G24320在ebp1-1的多聚核糖體組分(8-11)中mRNA的相對含量分別是2.31、4.69、4.39、2.62,在Col-0植物的多聚核糖體組分(8-11)中相對含量是0.95、2.34、2.65、1.38(圖5-C);AT1G25211在ebp1-1的多聚核糖體組分(8-11)中mRNA的相對含量分別是0.76、0.75、1.15、1.05,在Col-0植物的多聚核糖體組分(8-11)中mRNA的相對含量是1.28、1.91、1.51、1.39(圖5-D);以上數據表明EBP1突變與對照Col-0比可以促進多聚核糖體組分中AT1G24792、AT3G24320mRNA增多(P<0.05),而多聚核糖體結合AT1G25211的mRNA明 顯 減 少(P<0.05), 即 EBP1抑 制AT1G24792、AT3G24320的mRNA與核糖體的結合,促進AT1G25211mRNA與核糖體的結合。因此植物中EBP1也可以調控mRNA的翻譯過程。
3 討論
RBPs通過與RNA相互作用在轉錄后調控過程中發揮重要作用,從而調節細胞功能。植物擁有復雜的RBPs系統,參與調節植物生長的多個過程,包括調控開花時間[22]、激素反應[23]、生物鐘[24]、生物[25]及非生物脅迫[26]等過程。研究RBPs的生物學功能并解析其調控的分子機制將有助于挖掘新的功能基因,為農作物改良提供新的種質資源。
RNA與蛋白質的相互作用通常是通過一個特異的RNA識別基序實現的,Foley等[27]利用蛋白質測序技術對擬南芥有根毛和無根毛細胞核中的RBPs進行測序,結果發現“GUCUCUCACUGCGACGGCUU”可能是EBP1潛在的靶RNA序列。本研究發現擬南芥EBP1蛋白可以直接綁定“GUCUCUCACUGCGACGGCUU”RNA序列,并且找到了EBP1的3個靶基因RNA(AT1G24792、AT3G24320、AT1G-25211),進一步研究發現EBP1可以調控AT1G24792和AT3G24320的mRNA穩定性,對AT1G25211的mRNA穩定性沒有明顯影響。在此過程中EBP1如何實現對靶RNA的特異性識別與結合,是否還有更多的靶RNA沒有被發現,今后可綜合RIP-seq等技術,篩選更多與EBP1相互作用的RNA。另外,RNA結合蛋白通過識別位于mRNA 3'UTR富含AU的區域途徑或者識別含有提前終止密碼子的mRNA的 NMD(Nonsense-mediated mRNA decay) 等 途 徑來影響靶RNA的穩定性[28]。然而EBP1是如何調控AT1G24792和AT3G24320的mRNA穩定性的目前還不清楚,還需要進一步實驗研究。
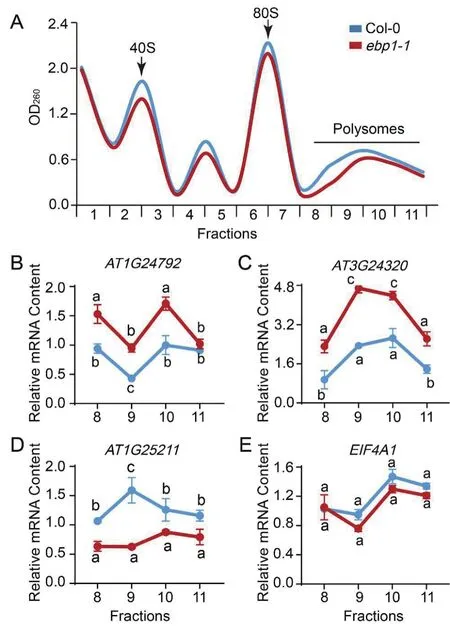
圖5 EBP1調節靶mRNA的翻譯效率
EBP1在動植物中是受體酪氨酸激酶ErbB3磷酸化調控的核質穿梭蛋白[29-30]。哺乳動物中,ErbB3是 HRG/NRG(Heregulin/neuregulin)小肽的受體[31]。在乳腺癌細胞中,當HRG 配體小肽結合ErbB3受體時,ErbB3與EBP1相互作用,使EBP1磷酸化并促使其在細胞核積累,發揮抑制細胞生長,促進細胞分化的功能[32]。植物中EBP1作為核質穿梭的轉錄因子,其功能已有研究。CrRLK1L(Catbarantbus roseusRLK1-like)成員FERONIA感知RALF1(Rapid Alkalinization Factor 1)小肽信號后,FERONIA與EBP1相互作用,使EBP1磷酸化并在細胞核積累,EBP1入核后抑制CML38的轉錄[16]。EBP1磷酸化狀態的改變是否影響其對轉錄后事件的調控仍不清楚。EBP1對RNA穩定性、mRNA翻譯的調控過程是否受到上游磷酸化蛋白調控也需要進一步研究。報道顯示擬南EBP1與核糖體的結合分布于細胞質、細胞核及核仁之間,且EBP1可以結合不同種類的RNA[17],EBP1蛋白在調控植物器官大小、逆境脅迫等多個方面發揮功能[16],那么,EBP1在不同的位置結合核糖體所行使的功能有何差異,其是否是通過改變蛋白構象或結合特定的基序來識別不同的RNA,從而實現不同的功能?所以,結合遺傳學多層次探究EBP1在RNA水平調控的生物學意義,是今后需要關注和研究的重點。
4 結論
本研究通過運用生物信息學分析結合分子生物學手段,發現擬南芥EBP1作為一個RNA結合蛋白,在RNA轉錄后水平調控過程中發揮功能。EBP1可以直接綁定“GUCUCUCACUGCGACGGCUU”RNA基序;生物信息學分析結合RIP-qRT-PCR技術,發現了EBP1的3個靶基因RNA(AT1G24792、AT3G24320、AT1G25211);進一步通過蟲草素處理發現擬南芥EBP1促進AT1G24792、AT3G24320mRNA的降解,而對AT1G25211mRNA的穩定性沒有影響。核糖體提取實驗發現,EBP1抑制AT1G24792、AT3G24320與核糖體的結合,而促進AT1G25211與核糖體結合。因此,EBP1在擬南芥中可以與RNA相互作用,并具有調控靶RNA的穩定性和翻譯速率的生物學功能。

