小麥病程相關基因TaSec14的克隆及功能研究
牛歡 馮靜云 黃建國 張超群 張露露 劉曉穎 王振英
(1. 天津師范大學生命科學學院,天津 300387;2. 天津市動植物抗性重點實驗室,天津 300387)
小麥(Triticum aestivumL.)是世界上廣泛種植的禾本科糧食作物之一,但各種病蟲害的發生嚴重影響了小麥的產量,其中由布氏白粉菌(Blumeriagraminisf. sp.tritici)引起的小麥白粉病是危害嚴重的病害之一[1-2]。
Sec14p是一種廣泛存在于真核生物中的磷脂酰肌醇轉運蛋白(Phosphatidylinositol transfer proteins,PITPs)[3],最早在釀酒酵母(Saccharomyces cerevisiae)中被發現[4],主要參與磷脂代謝和形成高爾基體分泌囊泡等過程[5-6]。最近發現,Sec14基因家族在植物響應逆境脅迫中發揮了重要的作用,Wang等[7]在擬南芥中過表達玉米Sec14p基因發現,轉基因擬南芥的根長變短、種子萌發率下降,并且脯氨酸的積累減少,抗氧化酶活性下降,這一系列變化最終提高了轉基因擬南芥對低溫脅迫的耐受性。Kie?bowicz-Matuk等[8]在抗旱大麥中發現,HvSec14p蛋白能與大多數磷脂酰肌醇結合,且在滲透脅迫下轉錄水平明顯增加。認為該蛋白可能通過參與細胞內磷脂酰肌醇的合成,增強抗旱大麥細胞膜的滲透能力。毛花英等[9]在甘蔗中克隆了Sec14基因,發現在聚乙二醇(Polyethylene glycol,PEG)、鹽、CaCl2和水楊酸(Salicylic acid,SA)脅迫下ScSec14基因表達均上調,推測ScSec14可能參與了Ca2+和SA介導的信號通路從而響應逆境脅迫。蘇世超等[10]發現TaSec14p-5基因在小麥孕穗期的不同組織中組成型表達,并受鹽、脫落酸(Abscisic acid,ABA)、干旱及低溫脅迫的誘導。有關Sec14基因參與植物與病原菌互作的研究僅在煙草(Nicotiana tabacumL.)中有過報道,Kiba等[11]發現煙草被青枯菌(Ralstonia solanacearum)侵染后,NbSec14基因的表達上調,而沉默NbSec14后煙草對青枯菌的抗性降低,推測該基因可能與植物防御反應有關。在隨后的研究中還發現,NbSEC14基因沉默植株中二酰甘油(Diacylglycerol,DAG)、磷脂酸(Phosphatidic acid,PA)的含量下降,磷脂酶C(Phospholipase C,PLC)、磷脂酶D(Phospholipase D,PLD)的活性降低;過表達NbSEC14植株的DAG、PA含量上升,PLC、PLD活性升高。認為NbSEC14蛋白可能通過參與磷脂代謝、調節磷脂酶活性,從而在煙草抗青枯菌的免疫反應中起重要作用[12]。目前,還未發現關于Sec14基因參與小麥與白粉菌互作過程的報道。
通過RNA-seq技術得到感病小麥品種京411中一段差異表達序列,根據該序列設計引物克隆了TaSec14基因。本研究利用生物信息學技術,分析TaSec14的基因結構和與其他物種Sec14的同源性。利用實時熒光定量PCR技術和VIGS技術分別分析TaSec14基因在不同抗性品種小麥接種白粉菌后的表達模式,以及降低該基因表達后感病小麥京411的抗病性變化,從而探究TaSec14基因在小麥與白粉菌互作過程中的作用,并為研究TaSec14基因功能提供理論支持。
1 材料與方法
1.1 材料
京411是半矮稈小麥品種,具有抗寒性強、分蘗力強、成穗率高等優點,是我國北部冬麥區高產廣適育種的骨干親本[13],苗期對白粉菌侵染的表型為高感[14]。Brock是對白粉病具有強抗性的小麥品種,作為抗病遺傳資源從英國引進,可能攜帶Pm2基因[15-16]。本實驗室在前期研究發現,Brock的Pm2可能已經喪失了對白粉病病原菌的抗性,在Brock小麥的3BL上可能攜帶一個新的抗白粉病基因[17]。京 411×Brock抗白粉病近等基因系 BJ-1,該材料是以感病品種小麥京411為輪回親本,以抗病品種小麥Brock為抗病基因供體,通過雜交獲得F1代。之后再與感病品種小麥京411進行連續回交6代,每一代都在白粉菌脅迫下選取抗病植株,最后再自交1代后獲得[18]。所用菌種為白粉菌生理小種E09,由中國農業科學院植物保護研究所提供。病毒材料為大麥條紋花葉病毒(Barley Stripe Mosaic Virus,BSMV)。
實驗所用引物見表1,由金唯智生物科技有限公司天津分公司合成。

表1 引物序列
1.2 方法
1.2.1 小麥葉片cDNA和DNA的制備 根據Promega 公 司 Eastep?Super Total RNA Extraction Kit中的方法提取京411品種小麥葉片總RNA,用1%瓊脂糖凝膠電泳分析RNA完整性,Nanodrop1000紫外分光光度計檢測RNA的濃度和質量。按照Promega公司M-MLV Reverse Transcriptase中體系以oligo(dT)18作為反轉錄引物,京411品種小麥總RNA為模板合成cDNA。使用天根公司Plant Genomic DNA Kit中的方法提取京411小麥基因組DNA,用1%瓊脂糖凝膠電泳分析樣品完整性。
1.2.2TaSec14基因的克隆及序列分析 根據RNASeq結果設計引物SecCDS-F/R,以京411小麥cDNA為模板,擴增差異表達序列。體系為:5×PSGXL Buffer 5 μL,dNTP 2 μL,SecCDS-F 0.5 μL,SecCDS-R 0.5 μL,cDNA 0.25 μL,Prime STAR GXL 0.5 μL,滅菌水 15.5 μL。反應程序為 :94℃ 5 min ;35 個循環 :98℃ 10 s,58℃ 15 s,68℃ 1 min 15 s;68℃ 7 min;4℃保存。回收目的基因并和pGEM-TEasy構建重組載體后送公司測序。將測序結果上傳至NCBI中的保守結構域數據庫(Conserved domain database,CDD)分析其結構域。將基因序列上傳至NCBI GeneBank進行Blastx比對,查找與其相似度高的基因。再利用DNAMAN軟件將該基因的氨基酸序列與其他物種氨基酸序列進行比對,通過MEGA軟件構建系統進化樹,分析其同源性。
根據cDNA序列設計DNA擴增引物SecFlth-F/R,以京411的DNA為模板進行擴增。體系為:5×PSGXL Buffer 5 μL,dNTP 2 μL,SecFlth-F 0.5μL,SecFlth-R 0.5 μL,DNA 1 μL,Prime STAR GXL 0.5 μL,滅菌水 15.5 μL。反應程序為:94℃ 5 min;35個循環 :98℃ 10 s,58℃ 15 s,68℃ 2 min ;68℃ 7 min;4℃保存。按照與cDNA相同的方式測得目的基因的DNA序列,并用IBS 1.0.2軟件繪制基因結構示意圖。
1.2.3TaSec14基因在白粉菌脅迫下的表達模式分析 京411、BJ-1和Brock幼苗長至一葉一心期時,采用抖佛法將新鮮的白粉菌孢子均勻接種于小麥第一葉表面。分別對接種不同時間點(0、2、4、8、12、24和48 h)的不同品種小麥第一葉進行取材,剪取葉尖1/3部位3 cm,放于滅菌且經液氮低溫處理過的2 mL EP管中,-80℃超低溫冰箱保存。按照1.2.1中的方法獲得小麥cDNA,并根據cDNA非保守區域序列設計引物SecQ-F/R,以小麥TaActin基因為內參,根據上海羅氏制藥有限公司Fast Start Universal SYBR Green Master(ROX)設計實時熒光定量PCR反應體系:SYBR Green Mix 10 μL,cDNA 1 μL,SecQ-F 1 μL,SecQ-R 1 μL,無菌水 7 μL。每個樣品設置3個生物學重復。利用7500 Fast Real-Time PCR System進行擴增,程序為:50℃ 2 min;40 個循環 :95℃ 10 min,95℃ 15 s,58℃ 30 s。反應完成后進行溶解曲線分析,以確定引物的特異性。將樣品擴增的Ct值進行匯總,采用2-ΔΔCt法計算基因的相對表達量,將3個重復得到的相對表達量數據計算平均值作為最終結果,并用Origin 9軟件繪制TaSec14基因的相對表達量圖。
1.2.4TaSec14基因的VIGS分析 根據TaSec14基因非保守區序列設計特異性沉默引物 SecV-F/R,以感病小麥京411的cDNA為模板擴增沉默片段。使用1%瓊脂糖凝膠電泳對PCR產物進行分析,回收沉默片段后與BSMVγ∶載體骨架構建重組載體BSMVγ∶TaSec14。
提取含有病毒載體的質粒BSMVα、BSMVβ、BSMVγ∶GFP、BSMVγ∶PDS以及 BSMVγ∶TaSec14,經線性化、酚仿抽提純化后,參照普洛麥格公司RiboMAX TM Large Scale RNA Production System-T7試劑盒對BSMV病毒進行體外轉錄,獲得病毒RNA。配制摩擦接種工作液:混合BSMVα、BSMVβ、BSMVγ∶GFP各組分RNA作為BSMV∶GFP陽性對 照 組;混 合 BSMVα、BSMVβ、BSMVγ∶PDS各組分RNA作為BSMV∶PDS陽性對照組;混合BSMVα、BSMVβ、BSMVγ∶TaSec14各組分 RNA 作為BSMV∶TaSec14實驗組。等體積混合滅活的DEPC水和GKP Buffer作為空白對照組。待感病小麥京411長到第二葉完全展開時,將工作液以8 μL每份的劑量摩擦接種至葉片上。
1.2.5TaSec14基因沉默效率驗證 首先對沉默體系的有效性進行檢驗,由于PDS基因是高等植物合成類胡蘿卜素的關鍵基因,該基因的缺失將導致植株葉片白化,故對摩擦接種后BSMV∶PDS對照組葉片的白化情況進行觀察,驗證沉默體系的有效性。待GKP Buffer對照組、BSMV∶GFP對照組和BSMV∶TaSec14實驗組植株第三葉完全展開時,按照1.2.3中的方法接種白粉菌,并分別對接菌0 h和4 h各組植株的第三葉進行取材。按照1.2.3方法提取各樣品總RNA后反轉錄成cDNA,每個樣品進行3個生物學重復,利用實時熒光定量PCR技術和2-ΔΔCt法得到各組植株葉片TaSec14基因的表達量,將3個重復樣品得到的相對表達量求均值后計算TaSec14基因的沉默效率,計算方法為:
TaSec14基因的沉默效率=(1-BSMV∶TaSec14實驗組中TaSec14基因的表達量/GKP Buffer對照組中TaSec14基因的表達量)×100%
之后采用t檢驗法檢測實驗組與對照組的差異情況,將TaSec14基因的相對表達量和差異情況利用Origin 9軟件繪圖。
1.2.6 敲減TaSec14基因后的白粉菌細胞形態學觀察和統計分析 按照1.2.3取材方法,對接種白粉菌2 d、3 d和7 d的GKP Buffer對照組、BSMV∶GFP對照組和BSMV∶TaSec14實驗組植株第三葉進行取材。經脫色固定、考馬斯亮藍R-250染色后,用共聚焦顯微鏡觀察葉片上白粉菌孢子的發育情況。統計接種白粉菌24 h后BSMV∶GFP對照組和BSMV∶TaSec14實驗組植株葉片上的白粉菌分生孢子、喙型附著胞和畸形附著胞(分瓣型和纖細型)數目,每個樣品的白粉菌數目統計3次求平均值作為樣本值。根據公式計算白粉菌的成功侵染率和畸形比率,分析基因沉默后小麥對白粉菌抗性的變化。
計算方法為:
白粉菌孢子成功侵染率=喙型附著胞/(喙型附著胞+畸形附著胞+分生孢子)×100%;
白粉菌畸形孢比率=畸形附著胞/(喙型附著胞+畸形孢+分生孢子)×100%。
2 結果
2.1 TaSec14基因的生物信息學分析
克隆得到該基因的cDNA全長序列(1 564 bp)和DNA全長序列(2 186 bp),利用APE軟件預測其開放閱讀框為1 212 bp,編碼403個氨基酸,如圖1所示。利用IBS 1.0.2軟件繪制基因結構示意圖,該目的基因含有兩個主要的結構域,即結合脂質的CRAL_TRIO_N結構域和具有磷脂酰肌醇轉運功能的SEC14結構域(圖2-A),該基因包括5個外顯子和4和內含子,呈間隔排布(圖2-B)。
Blastx比對結果顯示該基因與二穗短柄草(Brachypodium distachyon,Bd)、 玉米(Zea mays,Zm)、水稻(Oryza sativa,Os)、黍(Panicum hallii,Ph)、 棗(Ziziphus jujuba,Zj)、 蓖麻(Ricinus communis,Rc)和可可(Theobroma cacao,Tc)中Sec14蛋白家族的相似性較高,分別為80.45%、76.75%、72.38%、68.67%、67.31%、65.80% 和61.96%。利用DNAMAN軟件將該基因的氨基酸序列與其他7個物種氨基酸序列進行比對分析,結果如圖3所示,幾個物種Sec14結構域部分的相似性高,說明其具有較高的保守性。系統進化樹分析表明該基因編碼的蛋白與多個物種中的SEC14蛋白有親緣關系,且與二穗短柄草PITP3蛋白(XP_010236107.1)的親緣關系最為接近(圖4),說明其屬于Sec14蛋白家族,故將該基因命名為TaSec14。
2.2 白粉菌脅迫下TaSec14基因的表達模式分析
以小麥TaActin作為內參基因,分析接種白粉菌后3個小麥品種中TaSec14基因的表達模式(圖5)。發現在感病小麥京411中TaSec14基因的本底表達量最高,接種白粉菌之后表達量上升,在8 h達到一個高峰,之后開始下降,24 h再次達到高峰,之后再次下降。在抗病小麥BJ-1中,TaSec14表達量在接種白粉菌后開始上升,4 h達到高峰,之后開始下降,12 h后再次升高。在抗病小麥Brock中,TaSec14的表達量在接種白粉菌后先上升,8 h達到峰值,之后開始下降,在24 h后又有小幅上升。在感病小麥京411及其近等基因系BJ-1中,TaSec14基因的表達量一直高于抗病小麥Brock,并且在近等基因系BJ-1中的表達趨勢也和輪回親本京411相似。
2.3 TaSec14基因沉默體系構建
利用特異性沉默引物SecV-F/R擴增TaSec14基因片段,然后與BSMVγ∶載體骨架構建BSMVγ∶TaSec14重組載體。待各組植株第三葉完全展開后,對其進行摩擦接種。圖6是各組葉片的表型觀察結果,BSMV∶PDS對照組的葉片白化明顯,說明PDS基因被有效沉默,體系構建成功。
實時熒光定量PCR檢測各組TaSec14基因轉錄水平變化,結果如圖7所示,發現與對照組相比,接種病毒RNA后,實驗組TaSec14的表達水平在0 h時的沉默效率為85%,在4 h時的沉默效率為90.5%,并且t檢驗結果表明實驗組中TaSec14基因的表達量與對照組的差異均達到極顯著水平,說明小麥內源基因TaSec14的表達被有效抑制。

圖1 TaSec14基因序列信息
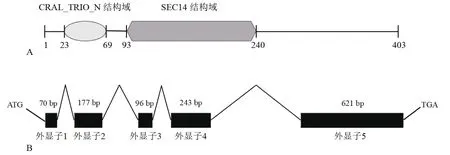
圖2 TaSec14基因結構示意圖
2.4 TaSec14基因敲減后影響白粉菌孢子發育
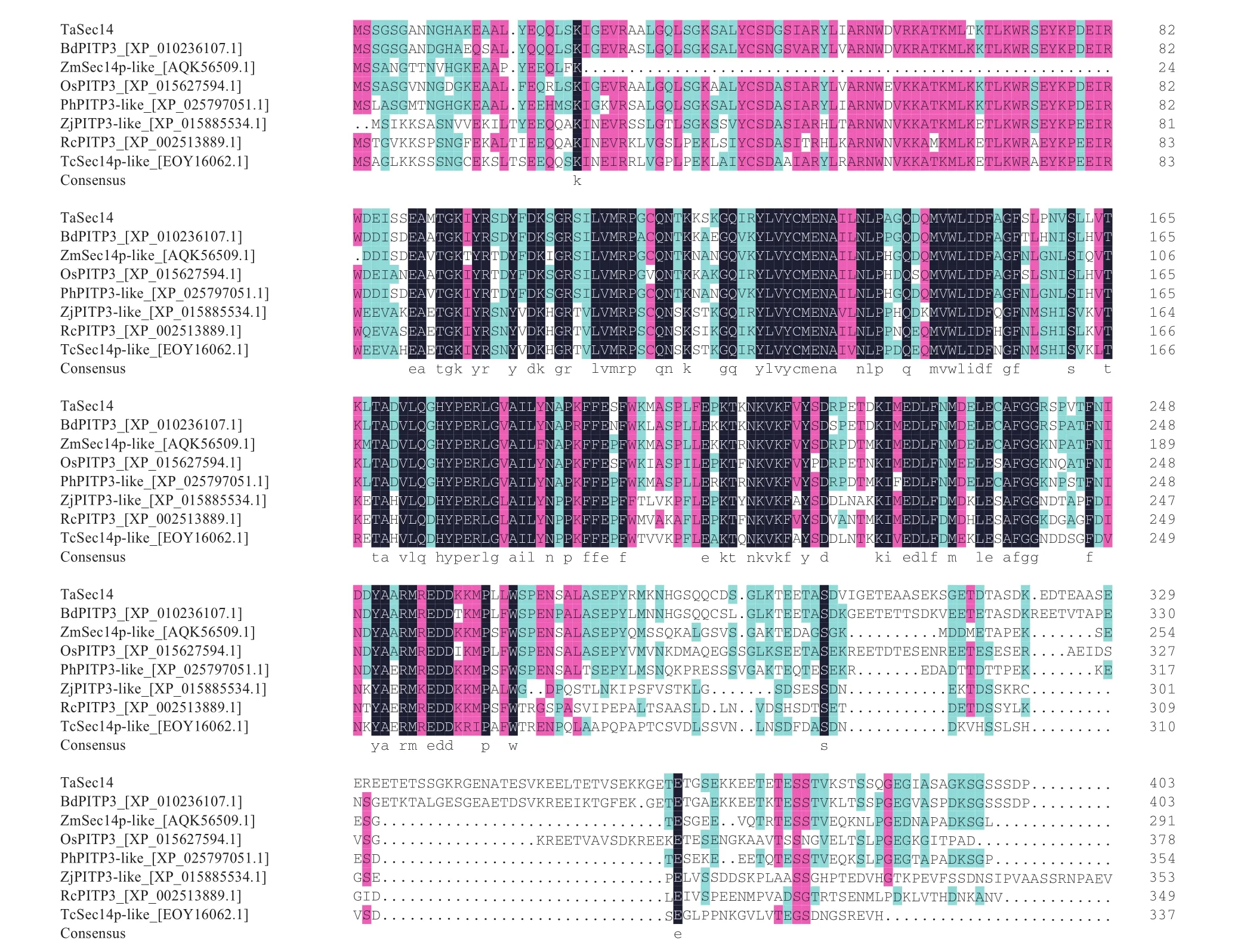
圖3 TaSec14同源序列比對結果
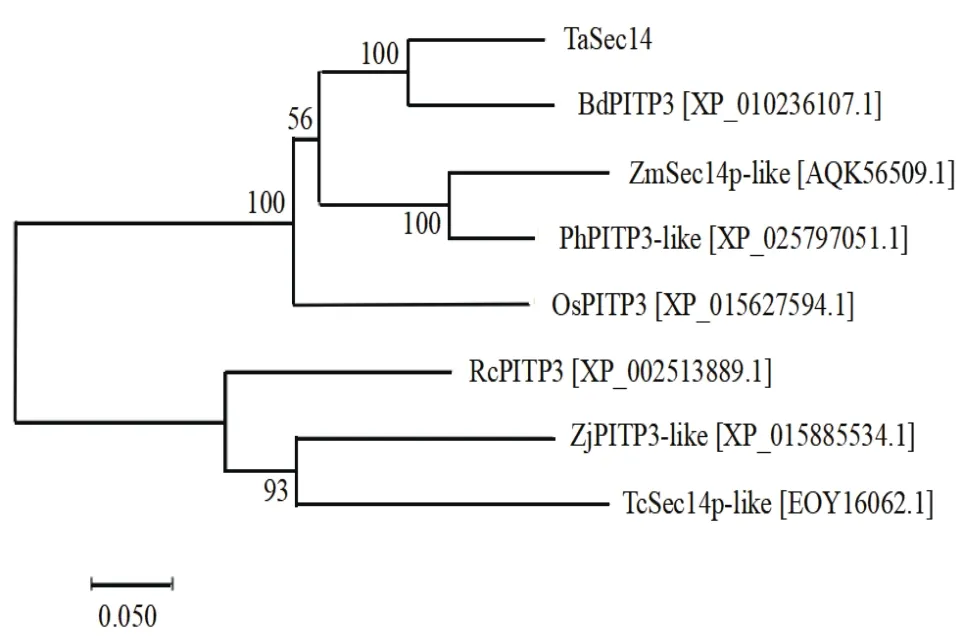
圖4 TaSec14系統進化樹分析結果
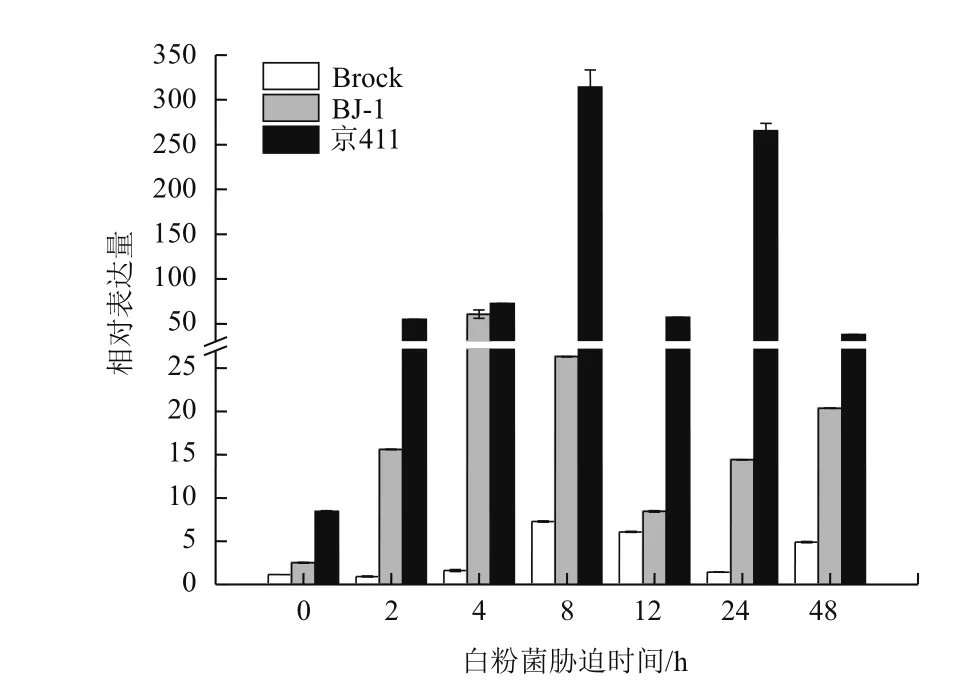
圖5 TaSec14基因在白粉菌侵染下的表達模式分析
對基因敲減后感病小麥京411接種新鮮的白粉菌孢子,觀察接種2 d、3 d和7 d后各組小麥植株的第3葉,統計葉片上白粉菌孢子的生長發育情況,圖8是接種白粉菌孢子不同時間后細胞生長發育情況。接種白粉菌2 d后,BSMV∶TaSec14實驗組葉片上多數為未侵染成功的畸形附著孢,僅可以看到少量的喙型附著胞(圖8-C),而在GKP Buffer對照組(圖8-A)和BSMV∶GFP對照組中,已經出現了初級菌絲(圖8-B);接種白粉菌3 d后,BSMV∶TaSec14實驗組中才出現初級菌絲(圖8-F),而在另兩個對照組中菌絲已經伸長,個別視野下還發現了念珠狀的孢子(圖8-D-E);接種白粉菌7 d后,兩個對照組中均出現了大量的念珠狀孢子和遍布視野的次級菌絲(圖8-G、H),而這時BSMV∶TaSec14實驗組才開始有次級菌絲形成,沒有觀察到念珠狀孢子(圖8-I)。

圖6 TaSec14基因沉默后各組植株葉片的表型觀察結果
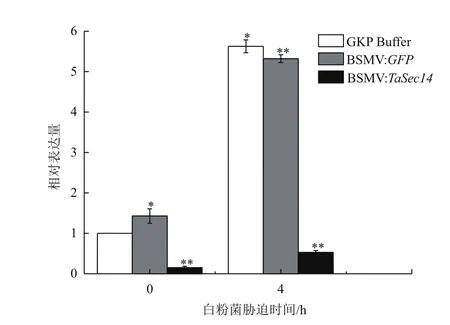
圖7 TaSec14基因沉默效率驗證
對每個樣品葉片上白粉菌孢子數目進行統計3次,求平均值作為樣本值。根據1.2.6中公式計算接種白粉菌24 h之后GKP Buffer對照組和BSMV∶TaSec14實驗組上白粉菌孢子的成功侵染率和畸形率,結果如圖9所示。BSMV∶TaSec14實驗組白粉菌的成功侵染率為35.92%,略低于GKP Buffer對照組的39.31%,白粉菌孢子的畸形率為11.27%明顯高于對照組的4.05%,并且BSMV∶TaSec14實驗組中白粉菌孢子的侵染率和畸形率與GKP Buffer對照組相比,差異均達到了顯著。以上結果表明,降低TaSec14基因的表達導致感病小麥京411對白粉菌抗性的增加。
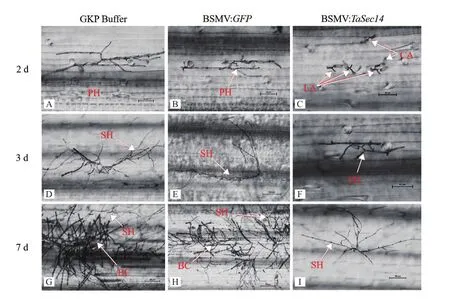
圖8 白粉菌脅迫下各實驗組的白粉菌細胞形態學觀察
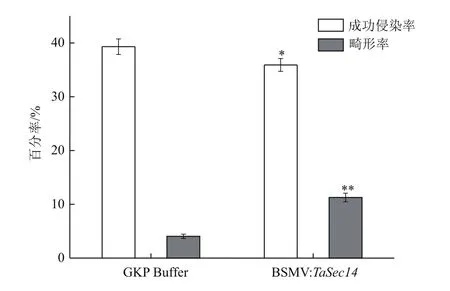
圖9 白粉菌細胞形態學統計
3 討論
3.1 TaSec14屬于磷脂酰肌醇轉運蛋白
Sec14結構域是一種高度保守且古老的脂質結合結構域,由酵母(Saccharomyces cerevisiae)Sec14p進化而來,在亞細胞器和細胞運輸中執行復雜的調節功能[19]。Sec14基因家族編碼的蛋白參與植物非生物脅迫信號轉導[20]、脂類的運輸和代謝[21]、磷脂酶C調節的信號轉導等生理過程[22]。本研究克隆了一個在感病小麥京411中特異表達的TaSec14基因,含有典型的SEC14保守結構域,屬于磷脂酰肌醇轉運蛋白家族的成員。
3.2 敲減TaSec14基因改變京411對白粉菌的敏感性
VIGS是一種基于RNAi的對植物特定內源基因進行沉默實驗的技術[23]。由于植物體內存在能識別外源RNA并將其降解的免疫機制[24-25],該技術利用該免疫機制,向植物體內轉化人工改造的病毒載體,完成對基因的沉默。利用VIGS技術敲減京411中的TaSec14基因后,發現接種白粉菌24 h后BSMV∶TaSec14實驗組的白粉菌孢子成功侵染率低于GKP Buffer對照組,畸形率高于對照組。表明抑制TaSec14基因的表達能一定程度上提高感病小麥京411對白粉菌的抗性。
3.3 TaSec14基因在小麥與白粉菌互作中起到調控作用
本研究克隆的TaSec14基因屬于Sec14基因家族,在接種白粉菌后,TaSec14在感病小麥京411及其近等基因系BJ-1中的表達量一直高于抗病小麥Brock,降低京411中的TaSec14基因表達后,BSMV∶TaSec14實驗組白粉菌的成功侵染率低于GKP Buffer對照組,并且畸形率明顯高于對照組,即降低內源TaSec14基因的表達能在一定程度上增加感病小麥京411抵御白粉菌侵染的能力。因此推測,TaSec14基因可能在小麥與白粉菌互作過程中起到一定的作用。Sec14蛋白家族可以介導磷脂酰肌醇的代謝并參與二酰甘油-蛋白激酶C(Diacylglycerol-Protein kinase C,DAG-PKC)途徑[26]。在最新的一項研究中發現[27],稻瘟病菌(Magnaporthe grisea)的附著胞內存在一個組氨酸-天冬氨酸激酶Sln1膨壓感受器,當Sln1感受到閾值范圍內的膨壓后,能通過PKC依賴性的途徑發揮作用,磷酸化NADPH氧化酶或調控蛋白激酶A(Protein kinase A,PKA)途徑,從而共同調節附著胞膨壓和入侵栓的形成,參與水稻與稻瘟病菌的互作過程。由此發現,Sec14與Sln1都介導了PKC途徑,參與了磷脂酰肌醇信號通路,且最終都影響了植物與病原菌的互作過程。我們推測,TaSec14蛋白也有可能通過PKC途徑影響其他多元醇的合成,從而參與小麥與白粉病互作過程。本實驗對TaSec14基因功能的分析可為Sec14基因家族的研究提供新的依據。
4 結論
本研究克隆得到了普通小麥中的TaSec14基因,該基因含有典型的SEC14家族保守結構域。接種白粉菌后,感病小麥京411及其近等基因系BJ-1中TaSec14基因的表達量一直高于抗病親本Brock,且在BJ-1中的表達趨勢與輪回親本京411趨同。通過VIGS技術敲減京411中的TaSec14基因發現,降低京411內源TaSec14基因的表達能在一定程度上增加其對白粉菌的抗性。推測TaSec14基因可能在小麥與白粉菌互作過程起到了調控作用。

