一株敵草隆降解菌的分離及其應用潛能探索
岳麗曉 李登云 張晶晶 仝雷
(鄭州工業應用技術學院,鄭州 451100)
除草劑的廣泛使用,在保證農業生產過程中做出了巨大的貢獻。但除草劑的過量及不恰當使用也帶來了嚴重的環境污染問題,導致各種除草劑在土壤和水體環境中被普遍檢出[1]。敵草隆(N-(3,4-dichlorophenyl)-N,N-dimethylurea)是一種高效選擇性除草劑,主要通過雜草根部被吸收,也可以被莖、葉吸收,通過抑制雜草的光合作用而使雜草死亡(通過阻斷光合系統II中質體醌的結合位點,從而阻止電子向質體醌的轉移,進而抑制光合作用),可有效防除大多數一年生和多年生雜草,在棉花、大豆、花生、玉米、黃瓜、果樹、咖啡、糖甘蔗和柑橘等的生產中均有較好的應用[2-4]。
敵草隆自1954年進入市場至今,被廣泛應用于農業生產。由于其難溶于水且穩定性較好,導致其容易在環境中長期積累,在土壤與水體中均有檢出報道[5]。在土壤中,敵草隆的殘留周期從幾個月到一年;而由于使用過程中的過量施用、雨水沖刷,導致敵草隆進入水體環境,對水生生物及飲用水造成巨大威脅[6]。因此,敵草隆對環境及人體健康的影響受到了廣泛的關注。已有研究表明,敵草隆的接觸對眼睛和皮膚具有較強的刺激作用,同時,敵草隆暴露實驗表明,敵草隆還具有致癌、致突變及影響代謝過程的毒性[7];同時,敵草隆還可影響環境生物的多樣性,從而破壞生態系統[4]。敵草隆及其代謝中間產物3,4-二氯苯胺(3,4-dichloroaniline)在已有的報道中已被列為主要的水體污染物[8]。歐盟已將敵草隆列為歐洲淡水資源中的“優先控制污染物”[2]。因此,如何高效的將敵草隆從環境中去除正逐漸成為環境安全的重要研究課題。
生物降解通常利用可以特定種類污染物作為唯一碳源、氮源或能源的微生物對污染物進行逐步的酶解、利用,從而實現污染物的分解,被認為是高效、環境友好且低成本的污染物去除方式[9-10]。隨著敵草隆使用導致的環境污染的大量報道及敵草隆毒性研究的深入,敵草隆的生物降解受到了廣泛的關注,敵草隆降解菌得到了一定量分離與報道。已報道的敵草隆降解菌來自芽孢桿菌屬(Bacillussp.)[2]、Variovarax sp.[11]、微球菌屬(Micrococcussp.)[12]等,還包括一些真菌如靈芝菌屬(Ganodermasp.)[13]、曲霉菌屬(Aspergillussp.)[14]、小克銀漢霉菌屬(Cunninghamellasp.)[15]、被孢霉菌屬(Mortierellasp.)[16]、脈孢菌屬(Neurosporasp.)[17]等。值得注意的是,目前獲得敵草隆的降解菌數量相對較少,降解機理研究還不充分,且菌株在實際敵草隆污染環境中修復應用探索較少。
本研究自長期使用敵草隆的棉花地土壤中分離獲得到一株能以敵草隆為唯一碳源生長的高效降解菌LX-C-06,通過菌落形態、生理生化特征和16S rRNA基因序列分析與確定菌株LX-C-06為木糖氧化無色桿菌(Achromobacter xylosoxidans)。通過單因素分析對菌株的環境適應性展開了系統的研究,并基于代謝中間產物分析推測了菌株對敵草隆的代謝途徑,進一步通過模擬原位土壤修復試驗探索了菌株在實際應用中的潛能,旨在豐富敵草隆降解菌資源,為敵草隆污染環境的生物修復提供理論參考。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒 本研究中所使用的敵草隆降解菌LX-C-06為本實驗室自行分離、保存,實驗中使用的感受態細胞大腸桿菌Escherichia coliDH5α購自生工生物工程(上海)股份有限公司,基因克隆用的載體(pMD18-T)購自TaKaRa公司。
1.1.2 試劑 敵草隆原藥(分析純,99%)購自上海麥克林生化科技有限公司,以色譜純甲醇配制為1×105mg/L的母液備用,使用時根據所需濃度進行添加;酵母粉、蛋白胨、瓊脂粉等試劑均購自Amresco公司;化學試劑如NaCl、KH2PO4、CaCl2等均購自國藥集團;基因組提取試劑盒、瓊脂糖凝膠回收試劑盒、質粒提取試劑盒及PCR反應所需的DNA聚合酶等均購自生工生物工程(上海)股份有限公司;甲醇為色譜純,購自上海麥克林生化科技有限公司;引物合成及測序均委托生工生物工程(上海)股份有限公司進行。
1.1.3 培養基 無機鹽離子培養基(MSM):(NH4)2SO41.5 g/L,MgCl20.05 g/L,CaCl20.02 g/L,KH2PO41.0 g/L,K2HPO41.0 g/L,K2SO41.0g/L,NaCl 5.0 g/L,調整pH至7.0±0.2,定容后滅菌備用。
富集培養基:蛋白胨 5 g/L,KH2PO41.5 g/L,K2HPO41.5 g/L,NaCl 10.0 g/L,MgCl20.05 g/L,CaCl20.02 g/L,調整pH至7.0±0.2,定容后滅菌備用。
LB 培養基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,調整pH至7.0±0.2,定容后滅菌備用。
所有培養基的滅菌均在121℃條件下滅菌30min完成,如需使用固體培養基,在配制完成后加入1.2%(W/V)的瓊脂粉后滅菌即可得。
1.2 方法
1.2.1 敵草隆降解菌的富集與分離 土壤樣品取至河南省安陽市白璧鎮長期種植棉花且有敵草隆使用記錄的棉田(北緯 36°06'85″,東經 114°50'68″),去除表層土壤后,取底下5-10 cm處的土壤裝入自封袋后置于4℃冰盒中保存并迅速送回實驗室,置于4℃冰箱保存、備用。取1.0 g土壤樣品,加入100 mL 富集培養基(液體,含敵草隆50 mg/L)中,于30℃條件下避光震蕩培養(160 r/min)。培養5 d后,取10 mL培養液加入新鮮的100 mL 富集培養基(液體)中并提高敵草隆濃度至100 mg/L,在上述相同條件下進行培養。重復上述轉接、培養方法,并每次提高敵草隆濃度50 mg/L至最終濃度達到400 mg/L。
取最終富集的培養液進行劃線至無機鹽離子固體培養基上(含50 mg/L敵草隆),于30℃條件下避光培養3 d,挑取單菌落接種至新鮮的LB液體培養基中培養24 h(30℃,160 r/min)。取獲得的菌液1 mL在7 000 r/min條件下離心3 min,棄上清,獲得的菌體沉淀用新鮮的無機鹽離子液體培養基沖洗后再次離心(7 000 r/min,3 min)。重復洗滌3次后用1 mL新鮮的無機鹽離子液體培養基將菌體重懸浮,用于降解能力測定。將重懸浮的菌液接種至10 mL無機鹽離子液體培養基(含50 mg/L敵草隆)作為處理組,以相同條件下不接入菌液的10 mL無機鹽離子液體培養基(含50 mg/L敵草隆)作為對照組,將處理組與對照組于30℃條件下避光震蕩培養(160 r/min)5 d后取樣,檢測敵草隆濃度并計算菌株對敵草隆的降解率(計算公式:降解率(%)=100×(對照組中敵草隆濃度-處理組中敵草隆濃度)/對照組中敵草隆濃度)。重復上述實驗,直至獲得穩定、高效降解敵草隆的微生物菌株。
1.2.2 敵草隆降解菌的鑒定 首先,對獲得的降解菌進行16S rRNA基因序列的克隆與測序,并對測序結果進行分析,具體如下:將獲得的敵草隆降解菌接種LB液體培養基中過夜培養,以細菌基因組提取試劑盒對菌株進行基因組提取。以獲得的基因組為模板進行16S rRNA基因的PCR擴增,擴增使用通用引物27F和1492R,PCR反應條件為:(1)95℃3 min,(2)95℃ 30 s,50℃ 30 s,72℃ 1.5 min,重復34次,(3)72℃ 10 min,4℃ 60 min。使用瓊脂糖凝膠回收試劑盒進行切膠回收,回收片段連接至pMD18-T載體后轉入感受態細胞E.coliDH5α后提取質粒送上海生工進行測序。對測序結果進行載體去除后進行BLAST比對,根據比對結果,從微生物標準命名數據庫(LPSN,http://www.bacterio.net/)下載標準菌株16S rRNA基因序列構建系統發育分析,使用MEGA 7.0軟件的NJ法進行(Bootstrap value = 1 000)[18]。
同時,基于《Bergey’s Manual of Systematic Bacteriology》和《常見細菌系統鑒定手冊》對獲得菌株的生理生化特征進分析,具體實驗方法參照《常見細菌系統鑒定手冊》[19-20]。
1.2.3 菌株的降解特性研究 菌株的降解特性研究包括菌株對環境因素溫度、pH及鹽離子濃度的耐受能力,對不同濃度敵草隆的降解能力。首先,將獲得的降解菌接種至LB液體培養基培養至OD600=0.8,取1 mL菌液進行離心洗滌(參考1.2.1中離心洗滌方法)作為種子。菌株對環境因素溫度、pH及鹽離子濃度的耐受能力測定方法如下:(1)以10%的接種量將菌種接種至pH分別為5.0、6.0、7.0、8.0和9.0的無機鹽離子液體培養基(均含50 mg/L敵草隆)中作為處理組,以相同pH條件下的無機鹽離子液體培養基不接入菌種作為對照組,處理組與對照組均在30℃條件下避光震蕩(160 r/min)培養,每24h測定一次敵草隆濃度;(2)以10%的接種量將菌種接種至pH為7.0的無機鹽離子液體培養基(含50 mg/L敵草隆)中作為處理組,以相同條件下的無機鹽離子液體培養基不接入菌種作為對照組,處理組與對照組分別在10℃、20℃、30℃、40℃和50℃條件下避光震蕩(160 r/min)培養,每24 h測定一次敵草隆濃度;(3)以10%的接種量將菌種接種至pH為7.0的NaCl濃度分別為1%、3%、5%、7%、9%和12%(W/V)無機鹽離子液體培養基(各含50 mg/L敵草隆)中作為處理組,以相同條件下的無機鹽離子液體培養基不接入菌種作為對照組,處理組與對照組均在30℃條件下避光震蕩(160 r/min)培養,每24 h測定一次敵草隆濃度。最后,以10%的接種量將菌種接種至分別含100 mg/L、200 mg/L、400 mg/L、600 mg/L、800 mg/L和1 000 mg/L敵草隆的無機鹽離子液體培養基(pH 7.0)中作為處理組,以相同敵草隆濃度條件下的無機鹽離子液體培養基不接入菌種作為對照組,處理組與對照組均在30℃條件下避光震蕩(160 r/min)培養,培養5 d后測定殘留敵草隆濃度并計算敵草隆降解率。上述所有實驗均設3次重復,并根據1.2.1中降解率計算公式計算敵草隆的降解率。
1.2.4 菌株對敵草隆的代謝途徑研究 以10%的接種量將菌種接種至分別10 mL含50 mg/L敵草隆的無機鹽離子液體培養基(pH 7.0)中,在30℃條件下避光震蕩(160 r/min)培養,每24 h取樣一次。樣品以等體積正己烷萃取2次后將有機相合并,合并后的有機相通過旋轉蒸發儀蒸發掉有機溶劑后,用5 mL色譜純的甲醇復溶,經0.22 μm濾膜過濾后用于代謝中間產物的質譜分析。采用LC-MS對代謝中間產物進行檢測,具體如下:安捷倫LC-MS(6420),流動相為甲醇(100%),直接進樣法(1 μL),檢測模式為負離子檢測模式,使用安捷倫Mass Hunter(v A.02.00)進行數據采集與分析,采集信號范圍為100-400 m/z。基于已有的報道結合質譜分析結果,獲得菌株降解敵草隆的代謝中間產物,進而推測菌株對敵草隆的代謝途徑。
1.2.5 菌株在模擬土壤修復中的應用 將獲得的降解菌在LB液體培養基中培養至OD600=1.0,離心后收集菌體,以無機鹽離子液體培養基沖洗(參考1.2.1),并以等體積的新鮮MSM重懸浮作為種子(約為5.7×106CFU/mL)。取鄭州工業應用技術學院校園內花園土壤作為供試土壤,將土壤用20目篩子過篩去除土壤中的石子等大顆粒物質后備用。根據目標濃度將敵草隆母液加入10 g土壤中,充分攪拌后在通風櫥中進行甲醇揮發12 h,從而獲得模擬的敵草隆污染土壤。分別向10 g滅菌(121℃,30 min,反復2次)和未滅菌的土壤中加入敵草隆至終濃度為50 mg/kg(參照前述進行甲醇揮發處理),加入1mL降解菌的種子溶液,與土壤進行充分混合,做為處理組,同時以10 g滅菌(121℃,30 min,反復2次)和未滅菌的土壤中加入敵草隆至終濃度為50 mg/kg但不接入降解菌作為對照組,將處理組與對照至于恒溫恒濕光照培養箱中,在30℃、相對濕度50%、光照12 h、黑暗12 h條件下培養,每5 d取樣一次,取樣至30 d,測定殘留敵草隆濃度并計算降解率,上述所有實驗組與處理均設3次重復。
1.2.6 分析與統計方法 基于氣相色譜法對樣品中敵草隆濃度進行測定。使用島津氣相色譜(GC-2010)建立敵草隆檢測方法,具體如下:色譜柱為Wonda Cap(10.25 mm×30 m×0.25 μm),進樣扣溫度為260℃,色譜柱采取程序升溫方式(200℃保持2min,20℃/min升溫至240℃保持4 min),檢測器溫度為280℃,載氣為高純氮氣(99.999%),氣體流速為2 mL/min,不分流進樣,進樣量為1 μL,使用電子捕獲檢測器(ECD)。以敵草隆標準溶液配制梯度濃度溶液,建立濃度與峰面積間的標準曲線,氣相色譜對50 mg/L敵草隆的檢測結果(保留時間為3.67 min)、2-10 mg/L和10-50 mg/L濃度區間的標準曲線如圖1所示。
對于土壤中的敵草隆,以正己烷作為萃取劑,每10 g土壤中加入10 mL正己烷,在密封條件下充分混勻后進行超聲震蕩混勻1 h,取有機相(1);將剩余的土壤樣品再次重復上述萃取步驟,并最終獲得有機相(2);將最終獲得的土壤樣品進行濾紙過濾,用正己烷對樣品進行淋洗,大約30-50 mL,收集濾液作為有機相(3)。最終,將有機相(1)、(2)和(3)合并,進行旋轉蒸發并用甲醇復溶至10 mL用于敵草隆檢測。同時,測得土壤中敵草隆(濃度范圍為5-50 mg/L)提取的回收效率均在96%以上。
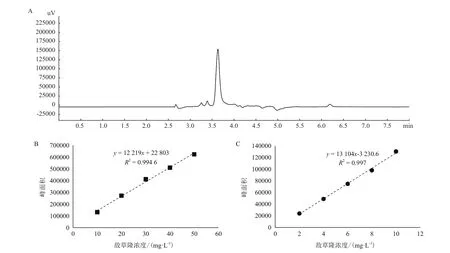
圖1 氣相色譜對敵草隆的檢測與標準曲線
2 結果
2.1 敵草隆降解菌的分離與鑒定
經過多次對采集土壤樣品的富集、馴化與分離,篩選到一株可將無機鹽離子液體培養基中的敵草隆為唯一碳源和能源進行生長,并在5 d內對無機鹽離子液體培養基中50 mg/L敵草隆的降解率為100%,將菌株命名為LX-C-06。菌株LX-C-06在LB固體培養基上呈黃色,菌落為邊緣規則的圓形且表面光滑(圖2),對菌株的生理生化特征分析結果如表1所示。
圖2 菌株LX-C-06在LB固體培養基上的菌落形態
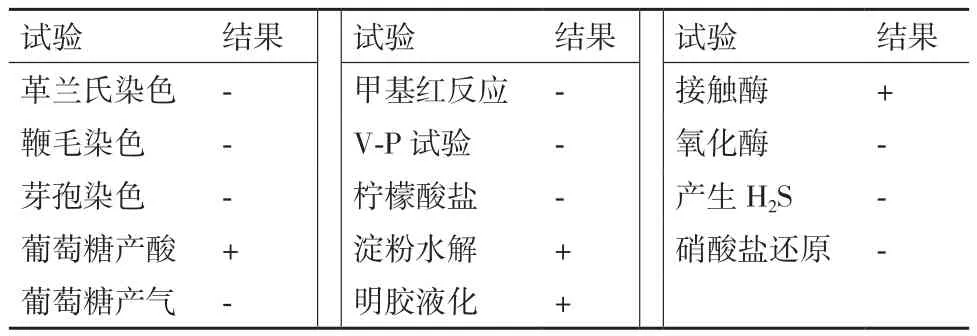
表1 菌株LX-C-06的生理生化特征
對菌株LX-C-06進行16S rRNA基因擴增后獲得的片段進行連接、轉化后測序,測序結果顯示PCR獲得的片段長度為1 455 bp,將獲得的序列與NCBI中已有的序列進行BLAST比對并將序列提交至NCBI的GenBank(登錄號為:MN262087),結果顯示菌株LX-C-06的16S rRNA基因序列與無色桿菌屬(Achromobactersp.)細菌的16S rRNA基因序列具有較高的相似性,進一步從標準菌株命名數據庫(LPSN)中下載無色桿菌屬細菌所有模式菌株的16S rRNA基因序列,并以Raoultella ornithinolyticaZK4的16S rRNA基因序列為外群,構建系統發育樹(圖3),結果顯示,菌株LX-C-06與木糖氧化無色桿菌(Achromobacter xylosoxidans)的親緣關系最近,進一步結合菌株的生理生化特征,確定菌株LX-C-06為木糖氧化無色桿菌。
2.2 菌株LX-C-06對敵草隆的降解特性
環境pH值對LX-C-06降解敵草隆的影響如圖4-A所示,可以看出,當pH為7.0時,菌株120 h對敵草隆的降解率最高為100%;同時,當pH為6.0和8.0時,菌株120 h對敵草隆的降解率均大于80%(分別為80.1%和90.7%);當pH過酸或者過堿時,菌株的降解能力受到顯著抑制,pH5.0和9.0條件下菌株120 h對敵草隆的降解率分別為12.8%和36.2%;同時,基于上述結果可以看出相對酸性條件,菌株對堿性條件有更好的適應能力。
培養溫度對菌株LX-C-06降解敵草隆的影響如圖4-B所示,由圖可知,菌株LX-C-06的最佳降解溫度為30℃,且菌株對溫度有較寬的耐受范圍。當溫度為30℃時,120 h對50 mg/L敵草隆的降解率為100%,而當溫度為20℃和40℃時,120 h對50 mg/L敵草隆的降解率分別為47.5%和63.0%。當溫度過高(50℃)或過低(10℃)時,菌株對敵草隆的降解受到顯著抑制,120 h對50 mg/L敵草隆的降解率分別為降解率僅為10.8%和5.6%。
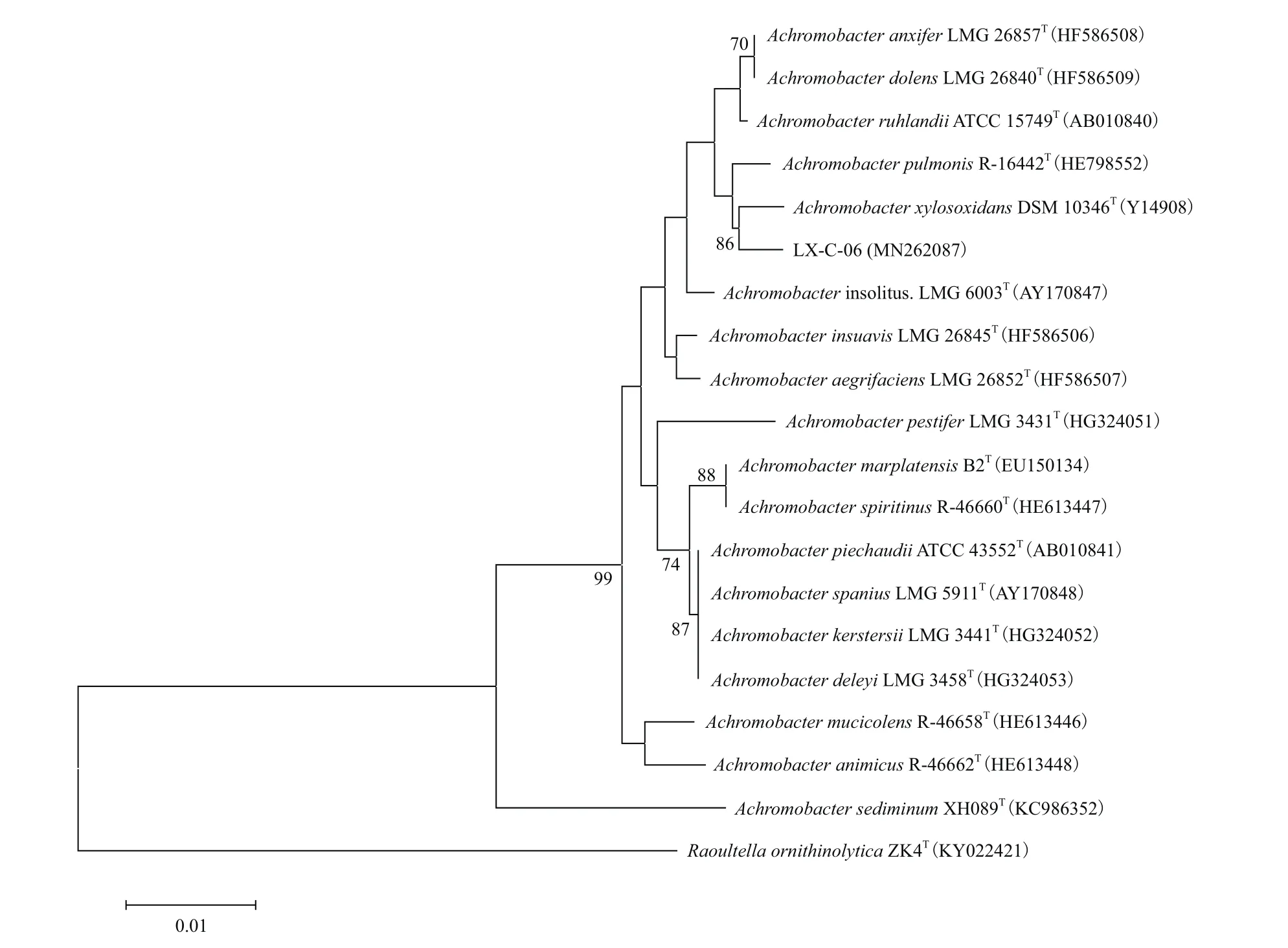
圖3 菌株LX-C-06的16S rRNA基因系統發育分析
菌株LX-C-06在不同鹽離子濃度條件下對敵草隆的降解情況如圖4-C所示,當NaCl濃度為1-3%時,菌株120 h內對50 mg/L敵草隆的降解未受到影響(降解率均為100%);當NaCl濃度為5%時,菌株120 h內對50 mg/L敵草隆的降解未受到顯著影響(降解率為87.8%);隨著NaCl濃度的逐漸提高,菌株對敵草隆的降解能力受到顯著抑制,當NaCl濃度達到12%時,菌株的降解能力被完全抑制(降解率為 0)。
菌株LX-C-06在120 h對不同濃度敵草隆的降解率如圖4-D所示,可以看出,當敵草隆濃度≤400 mg/L時,菌株LX-C-06在120 h對敵草隆的降解率均為100%;當敵草隆濃度升高至600 mg/L時,菌株LX-C-06對敵草隆的降解能力并未受到顯著影響,在120 h對敵草隆的降解率為92.1%;當敵草隆濃度大于600 mg/L后,菌株對敵草隆的降解能力受到顯著影響,當敵草隆濃度為800 mg/L和1 000 mg/L時,菌株120 h對敵草隆的降解率僅為51.2%和13.9%。
2.3 菌株LX-C-06降解敵草隆的代謝中間產物及代謝途徑分析
對不同時間點采集的樣品進行質譜分析,根據獲得的質荷比(m/z)、可能代謝中間產物的分子量(M.W.)并結合已有敵草隆降解相關報道,推測質譜檢測獲得的敵草隆降解中間產物包括3,4-二氯苯 胺(3,4-dichloroaniline,3,4-DCA,m/z=161.1,M.W.=162)、1,2-二氯苯(1,2-dichlorobenzene,1,2-DCB,m/z=146.2,M.W.=147)、4,5-二氯兒茶酚(dichlorocatechol,4,5-DCC,m/z=178.0,M.W.=179)、3,4-二氯-3-烯-1,6-己二醇(3,4-dichlorohex-3-ene-1,6-diol,3,4-DCHED,m/z=184.1,M.W.=185)和3-氯-4-酮基-己二酸(3-chloro-4-oxohexanedioic acid,3C4OHDA,m/z=193.3,M.W.=194)(圖 5-A)。
根據質譜分析的敵草隆降解中間產物,推測菌株LX-C-06降解敵草隆的代謝途徑為:敵草隆經水解酯鍵生成3,4-二氯苯胺,3,4-二氯苯胺則經脫氨基作用生成1,2-二氯苯,而1,2-二氯苯則在羥基化后生成4,5-二氯兒茶酚,4,5-二氯兒茶酚在兩個羥基之間開環生成3-氯-4-酮基-己二酸(圖5-B)。結合已有的報道,可以推測3-氯-4-酮基-己二酸進一步通過2-氯琥珀酸脫氯轉化為琥珀酸而被生物體所利用。
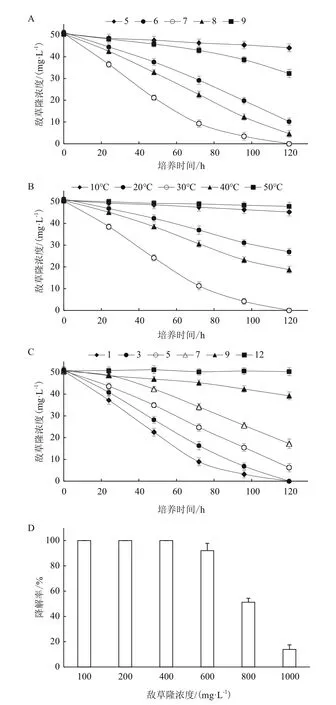
圖4 菌株LX-C-06對敵草隆的降解特性
2.4 菌株LX-C-06在模擬土壤修復中的應用
經過30 d內連續7次的采樣與檢測(圖6),可以看到隨著時間的發展,在未添加菌株LX-C-06情況下,滅菌土壤和未滅菌土壤中敵草隆濃度均無顯著變化,這表明在自然條件下敵草隆降解緩慢;在添加了菌株LX-C-06情況下,滅菌土壤和未滅菌土壤中的敵草隆濃度均逐漸降低,且未滅菌土壤中敵草隆濃度降低的速度快于滅菌土壤中敵草隆濃度的降低速度,培養的30 d后未滅菌土壤和滅菌土壤中敵草隆的降解率分別為78.1%和90.7%,結果表明添加菌株LX-C-06可顯著的促進敵草隆在環境中的降解。
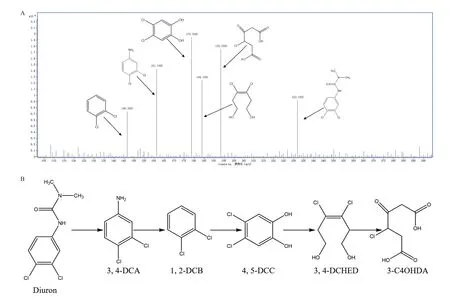
圖5 菌株LX-C-06降解敵草隆(48 h)代謝中間產物質譜分析(A)及推測的代謝途徑(B)
3 討論
隨著敵草隆在農業生產中的大量使用,其在環境中的農藥殘留問題日益嚴重,對人體健康及生態環境安全的威脅也日益突出。在特定環境中長期使用某種農藥會對該環境中微生物的種群結構及數量帶來巨大影響,同時,也會對環境微生物進行馴化,導致可降解、利用這些異源物質的微生物成為優勢物種,或可導致微生物發生進化而能降解周邊的農藥[21]。因此,從長期使用敵草隆的環境中分離降解菌成為敵草隆降解菌資源獲得的重要方法。
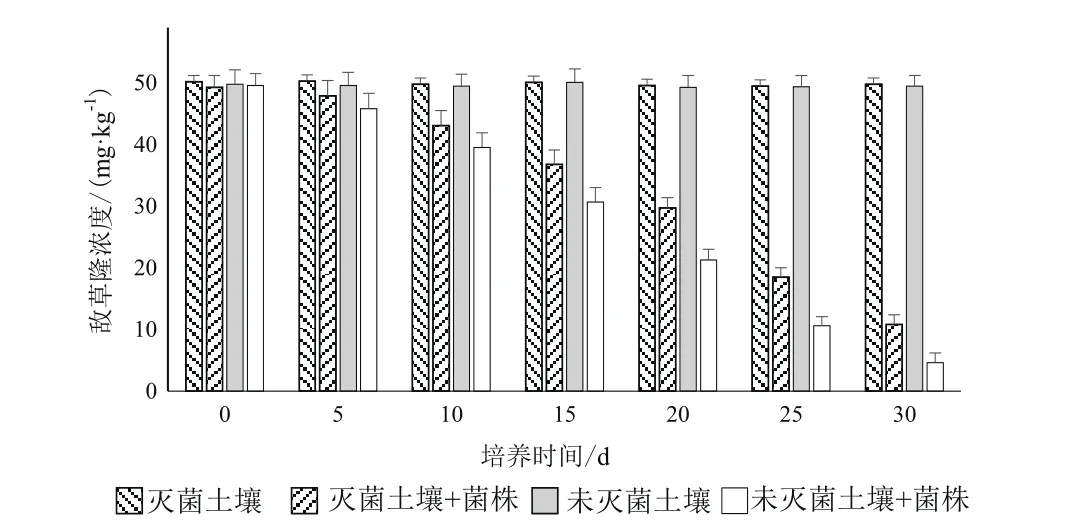
圖6 土壤中敵草隆濃度
本研究從長期使用敵草隆除草劑的棉花田中采集土壤樣品,經過多次富集、馴化,最終分離獲得了一株可高效降解敵草隆的微生物菌株LX-C-06,通過形態學特征、生理生化特征和16S rRNA基因序列分析確定菌株為木糖氧化無色桿菌,這也是首次分離、獲得可降解敵草隆的無色桿菌。通過單因素試驗法分析了不同環境因素對菌株LX-C-06降解敵草隆能力的影響,確定了最適降解溫度和pH值分別為30℃和7.0;同時,發現菌株可耐受較高濃度的NaCl,在NaCl濃度≤7%時,均可高效降解敵草隆;且菌株對較高濃度的敵草隆同樣表現出良好的降解能力,當敵草隆濃度≤600 mg/L時,降解率均在90%以上。
菌株LX-C-06對敵草隆的代謝途徑與已有報道的微生物降解敵草隆代謝途徑相似,均是通過酯鍵的水解將敵草隆轉化為3,4-二氯苯胺,進一步通過逐步的脫氨、羥基化、開環等過程,最終生成琥珀酸被生物體所利用。已有報道的菌株Bacillus licheniformisSDS12是一株可高效降解敵草隆的植物內生菌,基于LC-MS的分析發現該菌通過相同途徑將敵草隆進行逐步轉化利用[2]。分離自甘蔗地的Neurospora intermediaDP8-1同樣通過3,4-二氯苯胺代謝途徑對敵草隆進行降解,同時作者開展了菌株DP8-1在敵草隆生物修復中的應用探索[17]。這些研究結果表明基于代謝中間產物3,4-二氯苯胺的代謝途徑可能是普遍存在于敵草隆降解菌中的代謝途徑,這也為進一步闡明敵草隆在環境中的轉化過程及克隆獲得參與敵草隆降解的相關基因提供了重要的理論參考。
在模擬土壤原位修復的探索中,菌株LX-C-06同樣表現出良好的降解性能,30 d內對土壤中50 mg/kg敵草隆的最高降解率為90.7%。同時,值得注意的是,未滅菌的土壤中敵草隆的降解率高于滅菌土壤中的敵草隆的降解率,這可能的原因是土壤中的原有微生物對敵草隆的降解具有協同、促進作用,這在已有報道的其他污染物生物降解過程中有類似情況[21-23],這表明菌株LX-C-06具有良好的應用潛能。
4 結論
從長期使用敵草隆的棉花田土壤中分離獲得了一株可高效降解敵草隆的降解菌LX-C-06,通過形態學、生理生化特征及16S rRNA基因序列分析,確定了該菌為木糖氧化無色桿菌。菌株LX-C-06對環境溫度、pH值及NaCl濃度均表現出良好的適應性。通過代謝中間產物的質譜分析確定了菌株LX-C-06對敵草隆的代謝途徑,并通過模擬原位土壤修復探索了菌株的實際應用潛能。本研究從菌株降解特性、污染物代謝途徑及菌株應用潛能3個方面對菌株LX-C-06對敵草隆的降解及應用進行了系統研究,結果表明菌株LX-C-06對敵草隆具有高效降解能力、良好的環境適應性及較好的應用潛能。

