小果衛矛愈傷組織誘導及植株再生體系的建立
袁云香
(1.西北工業大學生命學院,西北工業大學特殊環境生物物理學研究所,空間生物實驗模擬技術國防重點學科實驗室,西安 710072; 2.渭南師范學院環境與生命科學學院,渭南 714099)
小果衛矛(Euonymusmicrocarpus(Oliv.) Spraggue)為衛矛科(Celastraceae)衛矛屬(Euonymus)常綠灌木,為我國獨有樹種,僅分布于少數幾個地方如陜西、山西、湖北、四川等地,近年在北京地區引種成功。小果衛矛其葉片革質,橢圓形、闊倒卵形或卵形,對生;其花黃綠色,花期為5~6月,聚傘花序、花瓣近圓形、花盤方圓;蒴果近長圓狀,4淺裂,裂片向外平展,果期10~11月;種子棕紅色,長圓狀,長約5毫米,外被橘黃色假種皮,極具觀賞價值。此外,小果衛矛還具有藥用價值,其根、莖具有祛風濕,強筋骨之功效,可用于風濕痹痛,筋骨痿軟[1~3]。
由于自然地理位置及氣候條件的原因,我國北方地區常綠樹種主要是針葉類的松柏科植物、女貞及大葉黃楊等少數的闊葉植物,缺少常綠、耐寒闊葉喬木和灌木樹種。王永格等研究發現小果衛矛抗寒性高于大葉黃楊、膠東衛矛和女貞[4],因此小果衛矛是極具開發潛力的、適宜北方地區引種栽培的常綠觀賞植物。關于小果衛矛的研究大部分集中在分布、生態習性、生物活性等方面,何云研究了小果衛矛的內生真菌[5];張雙進等對小果衛矛扦插生根進行了研究,發現其扦插生根較難[6];王永格等研究了小果衛矛的抗寒性,發現小果衛矛抗寒力大于女貞和大葉黃楊[4];秦浩等調查發現小果衛矛目前為山西天然分布衛矛屬植物中的唯一常綠植物[7]。而對小果衛矛的繁殖技術的研究主要以種子繁殖和常規扦插、嫁接為主,但由于小果衛矛種子繁殖效率低,常規的扦插繁殖較難生根,致使其規模繁殖受限,因此限制了小果衛矛的開發與利用。組織培養具有不受生長季節限制、繁殖快等優點,可在短時間內獲得大量無性系。目前,關于衛矛屬其他植物的組織培養已有報道,袁云香等[8]建立了陜西衛矛高效再生體系;樊祥義等[9]對金葉桃葉衛矛進行了初步組織培養;趙麗蒙等[10]對衛矛進行了不定芽誘導。而關于小果衛矛組織培養尚未見報道。本試驗以小果衛矛嫩莖為外植體,研究不同濃度植物生長調節劑對小果衛矛愈傷組織誘導、增殖、再分化及生根的影響,建立小果衛矛再生體系,以期為小果衛矛的快速繁殖提供技術支持。
1 材料與方法
1.1 試驗材料
試驗材料小果衛矛(E.microcarpus(Oliv.) Spraggue)采自陜西楊凌西北農林科技大學校內,剪取當年生顏色淡綠、無病蟲害嫩莖為外植體,帶回實驗室備用。
1.2 方法
1.2.1 外植體滅菌
將小果衛矛嫩莖放置于燒杯內,用軟毛刷蘸洗潔精輕輕將莖表面臟物洗凈,于流水下沖洗1~2 h后,轉自超凈工作臺內進行外植體消毒處理。采用75%酒精和0.1%升汞溶液配比,75%酒精處理時間分別設為10、20和30 s,0.1%升汞溶液設置為10、15和20 min。設置9種消毒組合進行浸泡處理。消毒完后用無菌水沖洗5~7次,將莖段表面的水分用無菌濾紙吸干,在培養皿中將嫩莖剪成2.0~3.0 cm長的小段作為外植體,接種于誘導培養基上。接種2周后統計污染率,每個三角瓶接種外植體4塊,15瓶共60個外植體,每組處理重復3次。
1.2.2 小果衛矛愈傷組織的誘導
小果衛矛愈傷組織誘導試驗按照正交設計L9(34),采用3個因素分別是3種基本培養基(MS、WPM和B5)、6-BA(1、2、3 mg·L-1)和2,4-D(1、2、3 mg·L-1),每個因素3水平,共9個處理組合。于接種40 d后統計誘導率,并記錄愈傷組織的生長狀態。
1.2.3 小果衛矛愈傷組織的再分化
切取質地較致密、顏色淡黃的胚性愈傷組織,接種到含有不同濃度6-BA和NAA的MS分化培養基上,每個分化處理接種15瓶,每瓶接種4塊愈傷組織。每個試驗處理重復3次。密切觀察并記錄愈傷組織的再分化狀態,于35 d后統計再分化率。
1.2.4 小果衛矛生根培養
當小苗生長至2~4 cm時,分離單株轉至生根培養基上進行生根培養。1/2MS培養基中含有不同濃度(0、0.2、0.4、0.6、0.8、1.0、1.2、1.5、2.0和2.5 mg·L-1)的NAA。于35 d后統計生根數及生根率,密切觀察生根情況并做好記錄。每個處理接種10瓶,每組試驗重復3次。
上述培養基中均添加蔗糖30 g·L-1、瓊脂8 g·L-1、pH為5.8~6.0。組培材料置于光照強度25~35 μmol·m-2·s-1,光照時間14 h·d-1,培養溫度(25±2)℃的光照培養箱中培養。
1.2.5 數據處理及分析
污染率(%)=污染的外植體數/接種的外植體總數×100%
(1)
存活率(%)=存活的外植體數/接種的外植總體數×100%
(2)
愈傷組織誘導率(%)=出愈傷組織的外植體數/接種的外植體數×100%
(3)
再分化率(%)=再生出苗的愈傷組織數/接種的愈傷組織總數×100%
(4)
生根率(%)=生根苗數/接種苗數×100%
(5)
運用SPSS 22.0統計分析軟件進行顯著性分析和Duncan多重對比。
2 試驗結果
2.1 不同滅菌處理對小果衛矛外植體染菌率的影響
外植體滅菌效果是直接影響組織培養成敗的重要因素,不同的消毒方法、消毒劑和消毒時間對外植體的污染率和存活率的影響差異較大。單獨使用一種消毒劑,污染率較高。因此,試驗采用75%酒精和0.1% HgCl2聯合處理小果衛矛莖段,不同滅菌時間組合對外植體的影響不同(見表1)。污染率隨著滅菌處理時間的延長而降低,但存活率卻呈現出先上升后下降的趨勢。75%酒精處理30 s和0.1% HgCl2處理20 min(編號10號),污染率最低,為0.933%,存活率僅為81.33%,但莖段表面有一定程度的褐化,尤其是切口端脫水明顯。75%酒精處理30 s和0.1% HgCl2處理15 min,存活率最高,為92.33%,莖段受損程度較輕。HgCl2處理時間越長,對外植體的損失越大。綜合分析試驗結果,75%酒精處理30 s和0.1% HgCl2處理15 min,存活率最高,污染率相對較低,因此,對于小果衛矛莖段來說,最佳的滅菌處理組合為75%酒精30 s,0.1% HgCl215 min(編號9號)。
表1 不同滅菌組合對外植體污染率的影響
Table 1 Effect of different sterilization combinations on contamination rates of explants

編號No.75%酒精75% of alcohol(s)0.1% HgCl2(min)污染率Pollution rate(%)存活率Survival rate(%)1101094.33±2.33g0.33±0.33a2101574.67±1.76f20.00±0.58b3102071.33±0.88f21.67±1.20b4201063.00±2.08e32.33±1.45c5201552.33±0.88d46.33±1.20d6202035.00±1.73c59.33±2.33e7301014.00±2.31b83.67±0.88f830152.00±0.58a92.33±1.20g930200.933±0.18a81.33±1.45f
注:不同小寫字母表示差異顯著(P<0.05) 下同
Note:The different lowercase letters in the same column indicated the significant difference at 0.05 The same as below
2.2 不同因素對小果衛矛愈傷組織誘導的影響
小果衛矛莖段接種到誘導培養基上,培養7 d左右,莖段基部接近培養基的切口處表現為肥大,顏色變淡,21 d左右切口處有膨大的愈傷組織現象,顏色淡白色,40 d后愈傷組織體積增大,顏色變為淡黃色、小顆粒狀(見圖1:A~B)。不同植物生長調節物質組合對小果衛矛愈傷組織的發生和生長狀態影響不同。正交實驗設計的培養基中小果衛矛愈傷組織誘導率統計結果見表2。
表2 不同因素對小果衛矛愈傷組織誘導的影響
Table 2 Effects of different actors on callus induction ofE.microcarpus(Oliv.) Spraggue

編號No.A培養基MediumB6-BA(mg·L-1)C2,4-D(mg·L-1)誘導率Induction rate(%)1MS11.041.90±0.68a2MS22.055.30±2.06b3MS33.079.00±0.58d4WPM12.039.00±1.73a5WPM23.051.50±1.04be6WPM31.075.50±2.12cd7B513.037.60±1.37a8B521.052.30±0.95bd9B532.073.20±1.74c
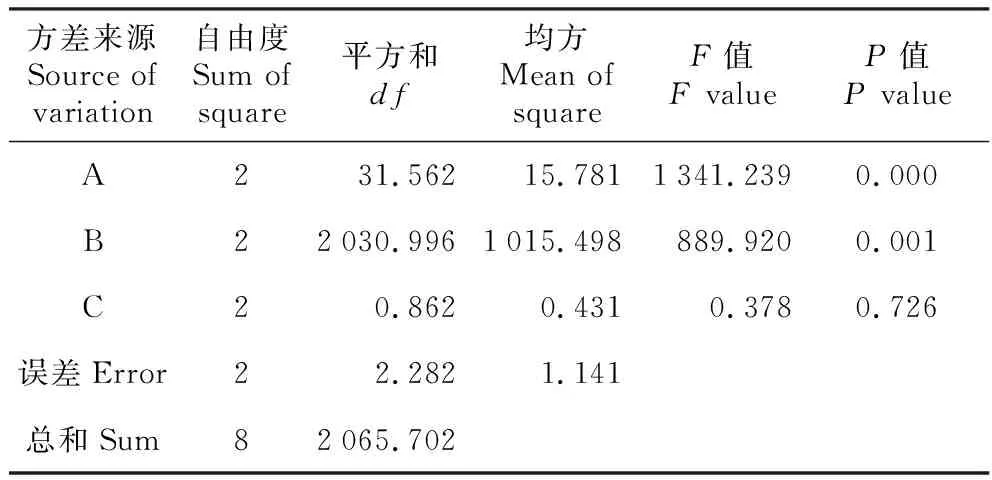
表3 愈傷組織誘導培養的方差分析
方差分析發現(見表3),小果衛矛愈傷組織誘導率在3個因素間差異明顯,6-BA和不同培養基對小果衛矛愈傷組織誘導率的影響達到極顯著水平(P<0.01);2,4-D對小果衛矛愈傷組織誘導率的影響差異不顯著(P>0.05)。
多重比較發現(見表4),基本培養基不同類型對小果衛矛愈傷組織誘導影響最大的是水平1(MS培養基),與水平2(WPM培養基)和3(B5培養基)呈極顯著差異(P<0.01),其均值高于其他兩個水平;6-BA的3個水平間在小果衛矛愈傷組織誘導率上的影響均具有顯著差異(P<0.05),6-BA水平3(3.0 mg·L-1)、水平2(2.0 mg·L-1)與水平1(1.0 mg·L-1)差異極顯著(P<0.01),說明6-BA不同濃度對小果衛矛愈傷組織誘導影響很大。2,4-D各水平間影響差異不顯著,但具有協同作用,因此其濃度選擇最低的水平為適宜。綜上,通過分析平均值可得出,小果衛矛愈傷組織誘導最佳培養基組合為A1B3C1,即MS+3.0 mg·L-16-BA+1.0 mg·L-12,4-D。
表4 不同因素對小果衛矛愈傷組織誘導影響的多重比較
Table 4 Multiple comparisons of effects of different actors on callus induction ofE.microcarpus(Oliv.) Spraggue
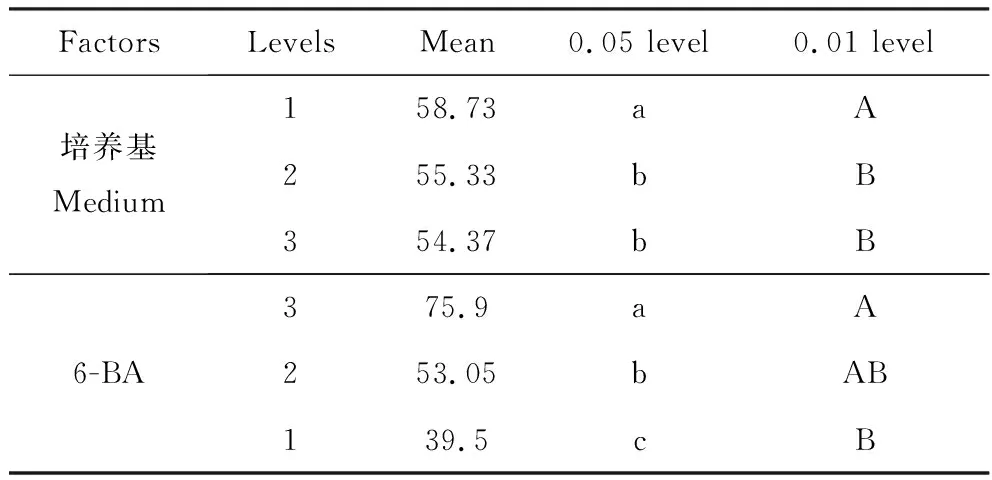
FactorsLevelsMean0.05 level0.01 level培養基Medium158.73aA255.33bB354.37bB6-BA375.9aA253.05bAB139.5cB
注:同列不同小寫字母表示差異顯著(0.05水平);不同大寫字母表示差異極顯著(0.01水平)
Note: The different lowercase letters in the same column indicated the significant difference at 0.05;The different uppercase letters in the same column indicated the significant difference at 0.01
表5 不同植物生長調節物質對小果衛矛愈傷組織再分化率的影響
Table 5 Effects of different plant growth regulators on the regeneration rate ofE.microcarpus(Oliv.) Spraggue

編號No.6-BA(mg·L-1)NAA(mg·L-1)再分化率Regeneration rate(%)10.00.0021.00.012.50±0.29c31.50.041.10±0.59d42.00.041.67±0.26d52.50.045.27±1.78e60.00.23.80±1.53b71.00.212.73±0.43c81.50.241.83±0.09d92.00.278.83±0.43i102.50.252.57±0.30g110.00.54.13±0.88b121.00.512.93±0.18c131.50.541.37±0.20d142.00.564.93±0.52h152.50.549.73±0.37f
2.3 不同6-BA和NAA配比對小果衛矛愈傷組織再分化的影響
將生長良好、顆粒狀愈傷組織切成小塊,接種到不同的分化培養基上。小果衛矛愈傷組織轉入分化培養基7 d左右,愈傷組織顏色由淡黃色逐漸轉為淡黃綠,體積也增大(見圖1:C~D);在培養14 d左右時,愈傷組織顆粒狀突起更明顯,顏色變為深綠色,體積增大明顯;部分愈傷組織出現肉眼可見的小綠芽點(見圖1:E)。隨著培養時間的延長,綠芽點數量也逐漸增多,芽點進一步分化為芽叢,35 d左右愈傷組織分化出再生植株(見圖1:F~G)。
不同種類及不同濃度組合的植物生長調節物質是影響植物再分化的重要因素。試驗設計不同濃度6-BA和NAA組合對小果衛矛愈傷組織的再分化影響不同。由表5可知,當分化培養基中未添加任何植物生長調節物質時,未見有愈傷組織分化。在只附加NAA濃度為0.2 mg·L-1時,愈傷組織出現分化,但分化率較低,僅為3.80%,只添加1.0 mg·L-16-BA時,愈傷組織分化率為12.50%;隨著NAA和6-BA濃度的升高,愈傷組織分化率也分別隨之升高。
在同時添加6-BA與NAA的組合中,在相同濃度NAA水平下,再分化率隨6-BA濃度的遞增而呈拋物線狀變化,6-BA濃度在1.0~2.0 mg·L-1范圍內,分化率逐漸升高;以濃度2.0 mg·L-16-BA時分化率最高,為78.83%,當6-BA濃度提高到2.5 mg·L-1時,分化率則略有下降,由此可見細胞分裂素與生長素配比使用更有利于再分化。綜合試驗結果可知,適宜小果衛矛莖段愈傷組織再分化的培養基為MS+6-BA 2.0 mg·L-1+NAA 0.2 mg·L-1,分化率最高,達到78.83%,不定芽生長態勢較好。
2.4 不同濃度NAA對小果衛矛生根的影響
將小果衛矛分化出的小苗與愈傷組織分離出來,接種到含有不同濃度NAA的生根培養基中,在第15天時部分小苗基部開始膨大,20 d左右開始出現白色不定根,培養35 d時小苗根長至3 cm左右,根系較粗,小苗生勢良好(見圖1:H)。
表6 不同濃度NAA對小果衛矛生根的影響
Table 5 Effects of different NAA on differentiation of rooting stems ofE.microcarpus(Oliv.) Spraggue

編號No.NAA(mg·L-1)生根率Rooting rate(%)10020.236.33±0.20b30.438.00±0.57b40.647.00±1.15d50.866.00±1.00e6183.23±0.62g71.275.27±0.37f81.575.63±0.32f9264.17±0.44e102.542.00±1.15c

圖1 小果衛矛莖段愈傷組織的誘導及植株再生 A.外植體接種;B.培養40 d后的形成愈傷組織;C.分化培養7 d的淡黃綠愈傷組織;D.分化培養14 d的綠色愈傷組織;E.分化培養21 d的小綠芽;F~G.分化培養35 d的再生植株;H.生根培養35 d的不定根Fig.1 Callus induction and shoot regeneration from stems of E.microcarpus(Oliv.) Spraggue A.Explants inoculated; B.Callus inducted culture for 40 d; C.Light yellowish green callus differentiation culture after 7 d; D.Green callus of differentiation culture after 14 d; E.Green sprouts after 21 d differentiation culture; F-G.Regenerated plantlets after 35 d differentiation culture; H.Rooting of plantlets for 35 d
由表6可知,在未添加NAA的培養基中,未見小苗生根現象,僅表現為小苗莖段延長及葉片增大。當NAA的濃度范圍為0.2~1.0 mg·L-1時,生根率呈上升趨勢,NAA 1.0 mg·L-1時,生根率最高,為83.23%;而NAA濃度在1.2~2.5 mg·L-1范圍內時,生根率有逐漸下降趨勢,且根系較細弱,主側根不明,植株矮小,長勢差。因此,最佳小果衛矛愈傷組織再生植株生根培養基為1/2 MS+NAA 1.2 mg·L-1,生根率為83.23%,生長狀態好,主根明顯,植株生長快且健壯,移栽成活率高。
3 討論
外植體消毒是小果衛矛再生體系建立的重要環節,選擇不同消毒劑的種類、采取不同的消毒時間顯得尤為重要。張麗杰等[11]在研究桃葉衛矛的組織培養時發現,7%酒精浸泡30 s后再用0.1%升汞浸泡10 min消毒效果好。周魏等[12]在雙歧衛矛的組織培養中發現莖段最佳消毒方法為70%酒精15 s,0.1%升汞8 min。本試驗采用75%酒精消毒30 s后再用0.1%升汞消毒12 min,二者聯合使用效果最好,污染率為2%。
在愈傷組織誘導過程中,不同基本培養基、植物生長調節物質的不同濃度與不同種類的配比,愈傷組織誘導率也不同。基本培養基是植物組織培養的重要基質,植物的遺傳背景不同及生物學特性各異,對各類營養成分的需求也有差異。本試驗選用了3種(MS、WPM和B5)基本培養基,附加不同濃度的6-BA和2,4-D,采用正交設計試驗,發現小果衛矛適宜愈傷組織誘導的基本培養基為MS,可能是由于MS培養基中鉀鹽、銨鹽、硝酸鹽等無機鹽濃度較WPM和B5高,更適宜小果衛矛莖段誘導愈傷組織,這與趙麗蒙等研究衛矛組織培養的結果較一致[10]。小果衛矛愈傷組織誘導率主要受到6-BA濃度的影響,在一定范圍內,誘導率隨6-BA濃度的升高而升高,且誘導出的愈傷組織在之后的再分化過程中更容易再分化出芽點,這與余慧等[13]研究歐洲衛矛組織培養的研究結果相似。
植物所需植物生長調節物質的種類和濃度,在不同培養階段是不同的,二者以適宜濃度配比使用有利于再生植株的生長發育,濃度過高或過低,都會影響再生植株發生及長勢。在本研究中發現,小果衛矛愈傷組織再分化過程中聯合使用細胞分裂素和生長素比單獨用一種更有利于愈傷組織分化。較高濃度的6-BA與適宜濃度NAA有助于小果衛矛愈傷組織再分化,而NAA濃度過高對再分化不利。本試驗建立了小果衛矛愈傷組織植株再生體系,這為解決小果衛矛野生資源匱乏打下基礎,對種質資源的開發與利用等后續的研究具有重要意義。

