小黑楊PsnHB22基因在煙草中的遺傳轉化研究
李 潺 張 翔 鄭 蘭 常成龍 劉彩霞 鄭 密 由香玲*
(1.東北林業大學生命科學學院,哈爾濱 150040; 2.四平市國有林總場石嶺子落葉松國家良種基地,四平 136000; 3.東北林業大學林木遺傳育種國家重點實驗室,哈爾濱 150040)
同源異型盒(Homeobox)基因編碼是一個由60個(或61個)保守氨基酸構成的蛋白質域,即同源結構域(HD)[1]。Homeobox基因在植物中可以分為14個類群,分別是HD-ZipⅠ、HD-ZipⅡ、HD-ZipⅢ、HD-ZipⅣ、WOX、PLINC、BEL、KNOX、DDT、PINTOX、PHD、LD、NDX及SAWADEE[2]。Homeobox基因幾乎參與了植物生命周期中的全部發育過程,特別是與激素反應有關的重要途徑。它們決定了植物的形態結構并參與莖尖和根尖分生組織的發育過程,同時還調控花發育的啟動并控制胚珠和果實的形成[3~5],如:KNOX基因的成員通常在莖尖分生組織(SAM)中表達,并在植物發育過程中調節細胞分裂和分化間的平衡[6];WOX類基因是胚胎形成的關鍵[7]。
HD-Zip轉錄因子是包含同源域(HD)和亮氨酸拉鏈(LZ)基序的一個植物特異性蛋白質的大家族[8~10]。根據編碼基因的結構和DNA的結合特異性,HD-Zip轉錄因子分為4個亞家族[11],不同的亞家族成員具有不同的生物學功能。其中HD-ZipⅠ亞家族在光信號轉導、非生物脅迫、葉片發育等方面發揮重要作用[12];HD-ZipⅡ亞家族響應光照條件及生長素的變化[13~14];HD-ZipⅢ亞家族成員調節頂端分生組織和維管束的發育,并影響生長素運輸[15];HD-ZipⅣ亞家族基因于植物器官的外細胞層中特異性表達,在表皮細胞分化、根系發育和花青素積累等方面發揮作用[8]。
HB22蛋白是HD-ZipⅠ亞家族的成員之一,目前關于楊樹HB22基因在煙草中異源表達的研究報道較少。本試驗從小黑楊中克隆PsnHB22基因,構建植物表達載體,進行煙草遺傳轉化并分析獲得的轉基因植株相關生物學特性,為后續深入研究PsnHB22基因功能奠定基礎。
1 材料與方法
1.1 實驗材料
野生型煙草(Nicotianatabacum)種子,野生型小黑楊(Populussimonii×P.nigra)組培苗均為本實驗室保存。
1.2 菌株及主要試劑
大腸桿菌Trans1-T1感受態、pEASY-T1 Cloning Vector購自北京全式金生物技術(TransGen Biotech)有限公司;根瘤農桿菌GV3101感受態購自上海唯地生物技術有限公司;植物表達載體pROKⅡ質粒,由山東師范大學張慧教授惠贈;RNA提取試劑盒購自北京百泰克生物技術(BioTeke)有限公司;質粒提取試劑盒、膠回收試劑盒購自杭州博日科技(Bioer)有限公司;PCR試劑、DNA Marker、限制性內切酶、DNA Ligation Kit、PrimeScriptTMRT reagent Kit、TB Green? Premix Ex TaqTMⅡ熒光定量試劑盒等購自TaKaRa公司;其他試劑均為進口或國產分析純。
1.3 實驗方法
1.3.1 小黑楊總RNA提取及PsnHB22基因的克隆
利用BioTeke通用植物總RNA提取試劑盒提取野生型小黑楊組培苗葉片總RNA,并使用PrimeScriptTMRT reagent Kit試劑盒進行反轉錄獲得cDNA。以小黑楊cDNA為模板,利用特異性引物PsnHB22-F(5′-ATCTCTAGAATGGAAAGTGATAGCACAAATGATC-3′)/PsnHB22-R(5′-ATCGGTACCCTTACTGGGTGGTAAGAGAAGATG-3′)進行PCR擴增,PCR反應程序為:95℃預變性2 min;95℃變性20 s,56℃退火20 s,72℃延伸7 s,40個循環;72℃再延伸5 min,PCR反應結束后將所有PCR產物進行1%瓊脂糖凝膠電泳檢測,并使用膠回收試劑盒對目的條帶進行切膠回收,將膠回收產物連接pEASY-T1載體后轉化Trans1-T1大腸桿菌感受態細胞,涂布于(50 mg·L-1Kan)LB平板上,37℃培養12~16 h。挑取單克隆菌落進行菌液PCR檢測,將陽性單克隆菌液送哈爾濱擎科生物公司測序,保存測序結果正確的菌液,并命名為pEASY-T1-PsnHB22。
1.3.2 植物表達載體構建
利用Bioer公司的質粒提取試劑盒提取pEASY-T1-PsnHB22大腸桿菌質粒和pROKⅡ質粒,利用限制性內切酶XbaⅠ、KpnⅠ雙酶切pEASY-T1-PsnHB22質粒及pROKⅡ載體質粒,利用DNA Ligation Kit試劑盒連接PsnHB22和pROKⅡ片段并轉化Trans1-T1大腸桿菌感受態細胞,涂布于(50 mg·L-1Kan)LB平板上,37℃過夜培養。挑取單克隆菌落進行菌液PCR檢測,將PCR條帶大小正確的菌液送哈爾濱擎科生物公司測序,保存測序結果正確的菌液,并命名為pROKⅡ-PsnHB22。提取pROKⅡ-PsnHB22菌液的質粒,進行GV3101農桿菌感受態細胞轉化,并利用通用引物pROKⅡ-F(5′-AAGACCGGCAACAGGATTC-3′)/pROKⅡ-R(5′-CGCACAATCCCACTATCCTT-3′)進行PCR檢測。
1.3.3 轉基因株系的獲得及分子檢測
政府引導基金的發展模式方面,李洪江和鮑曉燕(2012)通過比較國外政府引導基金的經濟績效和投資結果,對我國政府引導基金的發展模式進行了評估并指出了國外經驗的借鑒意義。蕭端和熊婧(2014)以YOZMA基金為案例,從運行機制和運作效率等角度對以色列政府引導基金的制度設計進行了觀測,在此基礎上為國內政府引導基金的平穩發展提供了政策性建議。燕志雄等(2016)則從代理成本視角入手,指出政府引導基金可能會遭受合謀問題,良好的監管和治理機制成為政府引導基金健康發展的重要外部條件。
選取組培瓶內煙草已展開的綠色大葉片,用無菌手術刀切除葉片主葉脈,將葉片切成大小約1 cm×1 cm的形狀,將切好的葉片浸入OD600值為0.2~0.4的農桿菌侵染液中10 min,侵染結束后取出葉片,均勻擺放到誘導培養基上共培養2 d。將共培養的煙草葉片脫菌后放入選擇培養基(10 mg·L-1Kan、200 mg·L-1特美汀)培養,1個月后獲得煙草抗性植株。用CTAB法提取煙草抗性植株DNA,利用pROKⅡ載體通用引物進行PCR,并通過1%瓊脂糖凝膠檢測。
1.3.4 實時熒光定量PCR檢測
利用TB Green? Premix Ex TaqTMⅡ熒光定量試劑盒提取煙草轉基因株系總RNA,并反轉錄為cDNA。取20 ng cDNA進行定量檢測,定量PCR引物序列為:PsnHB22-RT-F(5′-TCACTTTCCACCCTCCAATG-3′)/PsnHB22-RT-R(5′-TCTTTCCACTCCTTTCACCTG-3′),以NtActin為內參基因,引物序列為:NtActin-RT-F(5′-TGTGTTGGACTCTGGTGATG-3′)/NtActin-RT-R(5′-CGCTCGGTAAGGATCTTCATC-3′)。實時定量反應程序如下:95℃ 30 s;95℃ 5 s,60℃ 35 s,40個循環;95℃ 15 s,60℃ 1 min,95℃ 15 s。每個樣品重復3次,并通過2-ΔΔCt法進行計算。
1.3.5 轉基因植株的株高和葉片觀察
選取煙草表達量較高的4個轉基因株系及野生型各6株移至溫室,對營養生長旺盛的3月齡煙草測定其株高、葉長、葉寬等物理性狀,并進行差異顯著性分析。
1.3.6 轉基因植株葉片細胞形態分析
為了比較轉基因煙草和野生型煙草葉片表皮細胞的差異,分別取轉基因及野生型煙草自下而上第七片葉進行顯微觀察,取葉片同部位不含葉脈的下表皮,制片并在光學顯微鏡下觀察、拍照。
1.3.7 轉基因植株的葉綠素含量的測定
分別取煙草轉基因株系和野生型相同部位的葉片進行葉綠素含量的測定,采用購自柯尼卡美能達(中國)投資有限公司的SPAD-502 Plus葉綠素測定儀測定葉綠素SPAD值,每組進行3次生物學重復。
2 實驗結果
2.1 小黑楊PsnHB22基因的克隆
利用RNA提取試劑盒提取小黑楊總RNA,濃度測定后反轉錄為cDNA,并進行PsnHB22基因擴增,PCR反應程序結束后將PCR產物進行1%瓊脂糖凝膠電泳檢測,結果顯示:擴增條帶大小和預期目標一致(見圖1A)。膠回收目的條帶后與pEASY-T1載體連接,轉化大腸桿菌,進行菌液PCR驗證(見圖1B),比對測序結果,將基因序列正確的菌液命名為pEASY-T1-PsnHB22。
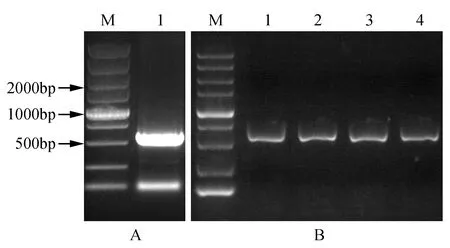
圖1 PsnHB22基因的克隆及鑒定 A.PsnHB22基因的克隆(M. DNA marker DL5000;1. PsnHB22基因的PCR擴增產物); B.pEASY-T1-PsnHB22的菌液PCR檢測(M. DNA marker DL5000;1~4. pEASY-T1-PsnHB22單菌落)Fig.1 The cloning and identification of PsnHB22 gene A.The cloning of PsnHB22 gene(M. DNA marker DL5000; PCR amplification product of PsnHB22 gene); B. PCR detection of pEASY-T1-PsnHB22(M. DNA marker DL5000; 1-4. The single colonies of pEASY-T1-PsnHB22)
2.2 植物表達載體的構建
利用限制性內切酶XbaⅠ、KpnⅠ雙酶切pEASY-T1-PsnHB22質粒及pROKⅡ載體質粒,1%瓊脂糖凝膠電泳檢測(見圖2A),并膠回收目的片段,使用DNA Ligation Kit連接目的片段后轉化Trans1-T1感受態細胞并進行菌液PCR檢測(見圖2B),PCR擴增的特異性條帶與目的條帶大小一致。測序結果表明連接正確,基因未發生突變,pROKⅡ-PsnHB22植物表達載體構建成功。提取pROKⅡ-PsnHB22大腸桿菌的質粒轉化GV3101農桿菌感受態細胞,并進行PCR檢測(見圖2C),結果表明pROKⅡ-PsnHB22植物表達載體成功導入GV3101農桿菌中。
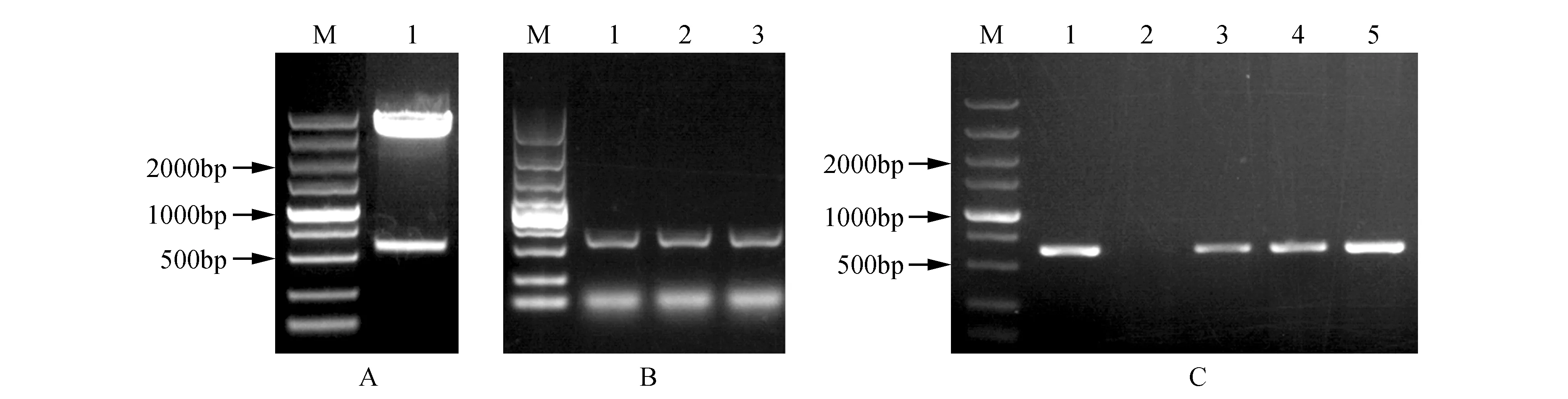
圖2 植物表達載體pROKⅡ-PsnHB22的構建 A.限制性內切酶對pEASY-T1-PsnHB22質粒的雙酶切電泳圖(M. DNA marker DL5000;1. pEASY-T1-PsnHB22);B. pROKⅡ-PsnHB22菌液PCR檢測(M. DNA marker DL5000;1~3. pROKⅡ-PsnHB22單菌落);C.農桿菌GV3101轉化子的菌液PCR檢測(M. DNA marker DL5000;1~5.GV3101農桿菌菌液PCR檢測)Fig.2 Construction of plant expression vector pROKII-PsnHB22 A. Restriction enzyme digestion of pEASY-T1-PsnHB22 plasmid(M. DNA marker DL5000; 1. pEASY-T1-PsnHB22); B. pROKII-PsnHB22 bacterial solution PCR detection(M. DNA marker DL5000; 1-3. pROKII-PsnHB22 single colony); C. Bacterial PCR detection of Agrobacterium GV3101 transformant(M. DNA marker DL5000; 1-5. PCR detection of GV3101 Agrobacterium)
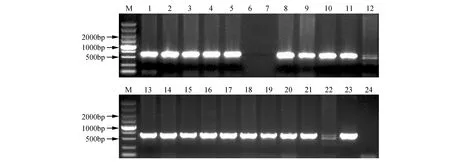
圖3 轉基因株系的DNA分子檢測 M. DNA marker DL5000;1,13.陽性對照;2~12、14-23.PsnHB22轉基因煙草驗證;24.野生型對照Fig.3 DNA molecular detection of transgenic lines M. DNA marker DL5000; 1,13. Positive control; 2-12,14-23. Validation of PsnHB22 transgenic tobacco; 24. Wild type control

圖5 轉基因煙草表型觀察 A.轉基因煙草株高觀察;B.轉基因煙草葉片觀察;C.轉基因煙草第6片葉的表型觀察Fig.5 Phenotypic observation of transgenic tobacco A.Plant height observation of transgenic tobacco; B.Leaf observation of transgenic tobacco; C.Phenotypic observation on the 6th leaf of transgenic tobacco

圖4 轉基因株系的qRT-PCR檢測Fig.4 qRT-PCR detection of transgenic lines

圖6 轉基因煙草葉長、葉寬的統計分析 *顯著相關水平(P<0.05);***極顯著相關水平(P<0.001)Fig.6 Statistical analysis of leaf length and leaf width of transgenic tobacco * means correlation is significant at the 0.05 level; *** means correlation is significant at the 0.001 level
2.3 轉基因株系的獲得及分子檢測
利用已轉化pROKⅡ-PsnHB22質粒的農桿菌GV3101菌液侵染煙草葉片,經4~6周的選擇培養后獲得抗性芽,并進行生根培養,共獲得17個煙草轉基因株系。提取轉基因煙草及野生型基因組DNA,利用pROKⅡ通用引物進行PCR擴增(見圖3),結果顯示PsnHB22基因已經整合入煙草基因組中。
2.4 轉基因植株的實時熒光定量PCR檢測
提取轉基因煙草總RNA反轉錄為cDNA后進行實時熒光定量PCR檢測(見圖4),以表達量最低的轉基因株系L1為參照,各轉基因株系相對表達量如圖所示。其中L4、L6、L7、L10、L11、L17轉基因株系表達量最高;L3、L5、L8、L13、L14、L15、L16表達量低于以上株系;L2、L9、L12轉基因株系表達量最低。
2.5 轉基因植株的株高和葉片觀察
選取目的基因表達量高的4個轉基因株系(L4、L6、L10、L17)及野生型煙草移至溫室后觀察3月齡煙草土培苗表型,結果顯示,在營養生長旺盛的時期,轉基因煙草株高明顯低于野生型(見圖5A),并且相較于野生型煙草,轉基因煙草相同部位的葉片出現性狀差異(見圖5B,C),分別測量煙草不同株系第6、9、10、11、12片葉的葉長和葉寬,進行數據分析,結果如圖6所示,轉基因煙草株系葉長與野生型煙草相比無明顯差異,L6、L10葉寬在第6片葉具有顯著差異,L17葉寬在第9片葉具有顯著差異。
2.6 轉基因煙草葉片細胞形態分析
光學顯微鏡觀察轉基因煙草及野生型相同部位的葉片表皮細胞,結果如圖7,相較野生型煙草葉片表皮細胞,轉基因煙草L6、L10葉片表皮細胞變小,L4、L17表皮細胞與野生型植株差異不大。
2.7 轉基因植株的葉綠素含量的測定
測定轉基因煙草和野生型煙草相同部位葉片的葉綠素含量,結果顯示:L4、L6、L10、L17等4個轉基因煙草株系中葉綠素含量均高于野生型,如圖8所示。
3 討論
HD-Zip轉錄因子基于蛋白質結構和功能可分為4個亞家族,HD-ZipⅠ亞家族在光信號轉導、 非

圖7 轉基因煙草葉片表皮細胞的觀察 A.野生型煙草葉片表皮細胞;B~E.分別為轉基因煙草L4、L6、L10、L17葉片表皮細胞Fig.7 Observation of epidermal cells in transgenic tobacco leaves A.Leaf epidermal cells of wild type tobacco; B-E.Leaf epidermal cells of transgenic tobacco L4,L6,L10 and L17

圖8 轉基因煙草葉綠素含量的測定Fig.8 Determination of chlorophyll content in transgenic tobacco
生物脅迫、葉片發育等方面具有重要作用。HB22轉錄因子作為HD-ZipⅠ家族的成員之一,具有重要作用。有研究表明,在擬南芥中,HB22基因可能通過赤霉素信號轉導來延長種子壽命[22],也可能與CRY1基因互作介導藍光響應[23]。
葉片是植物中的主要光合器官,具有很高的發育可塑性[24]。盡管葉片大小和形狀的改變對于植物存活極其重要,但是植物調控葉片發育的分子機制尚未完全清楚。有報道指出,如I類KNOX家族蛋白、ASYMMETRIC LEAVES1(AS1)、AS2、III類同源域—亮氨酸拉鏈蛋白、AUXIN RESPONSE FACTOR3(ARF3)、ARF4,KANADI、YABBY家族蛋白及ANGUSTIFOLIA3蛋白等均參與調節了葉片發育的不同階段[25]。
HD-ZipⅠ亞家族中,ATHB13在轉基因植物中的組成型高水平表達導致子葉和葉片發育發生改變,與野生型相比,特別是在含有可代謝糖的培養基上,轉基因植物的子葉和葉片更狹窄,提示ATHB13是蔗糖信號通路的組成部分[26];煙草中ATHB1異位表達的影響已被解釋為ATHB1可能參與了葉片發育的控制過程[27];ATHB7在轉基因擬南芥中組成型高水平表達時,會成為缺水條件下充當花序和葉細胞伸長的負調節劑,導致植物表型的改變[28]。關于HD-ZipⅠ類3個基因的已知功能注釋表明,這些基因在生長過程中控制了特定細胞類型的發育。結合本試驗數據顯示,PsnHB22基因可能在植物發育中充當了伸長葉片的調節劑。
本試驗為探究PsnHB22基因的功能,從小黑楊中克隆得到PsnHB22基因,遺傳轉化煙草并進行轉基因植株的生物學特性研究。研究表明,在營養生長旺盛時期,轉基因煙草長勢較弱,株高明顯低于野生型;部分轉基因株系葉片狹窄,與野生型相比具有顯著差異,且這些轉基因株系葉片表皮細胞相較野生型表皮細胞變小;轉基因煙草葉綠素含量顯著高于野生型,這與前人研究結果相一致[29]。由此推測PsnHB22基因在植株株高生長、光合作用及葉片的形態建成等過程中起著重要的作用,我們將在后續實驗中對PsnHB22基因行使功能的具體機制進行更加深入的研究。

