低分子肝素聯合連續性血液凈化治療嚴重膿毒癥療效觀察
杜盆盆 李樊華
(河南科技大學第一附屬醫院開元院區 洛陽471023)
膿毒癥是由感染引起的全身性炎癥反應綜合征, 多伴有組織灌溉不足、器官功能障礙及低血壓等,病死率一直居高不下[1~2]。 膿毒癥發病機制目前尚不明確,但發展迅速,當發展成重癥膿毒癥時,病情兇險,病死率高,嚴重威脅患者的生命安全[3]。 臨床研究發現,通過抑制患者凝血功能活化,可減輕炎癥反應,進而改善臨床癥狀[4]。 本研究探討了低分子肝素聯合連續性血液凈化(CBP)治療嚴重膿毒癥的效果。 現報道如下:
1 資料與方法
1.1 一般資料 選取2018年4月~2019年6月收治的82例嚴重膿毒癥患者作為研究對象,以隨機數字表法分為對照組和觀察組各41例。 對照組男25例, 女16例; 年齡55~78歲, 平均年齡(68.53±4.48)歲;泌尿系統感染12例,呼吸系統感染9例,多發性創傷7例,胰腺炎6例,膽管炎7例。 觀察組男24例, 女17例; 年齡54~79歲, 平均年齡(67.96±4.74)歲;泌尿系統感染8例,呼吸系統感染11例,多發性創傷9例,胰腺炎5例,膽管炎8例。兩組一般資料比較,差異無統計學意義(P>0.05),具有可比性。 本研究經我院醫學倫理委員會批準。
1.2 入組標準 (1)納入標準:符合《中國嚴重膿毒癥/膿毒性休克治療指南(2014)》[5]相關標準;患者或家屬自愿簽署知情同意書。(2)排除標準:伴有免疫系統疾病;近3個月內曾接受激素治療;伴有腦出血、消化道出血及其它活動性出血;伴有惡性腫瘤及血液系統疾病。
1.3 治療方法 對照組采用常規治療: 去除病因,控制感染,糾正酸中毒,維持水電解質平衡,強化胰島素應用, 并進行呼吸及循環支持治療。 觀察組采用低分子肝素聯合CBP 治療, 采用美國百特Aqurius 型血濾機與HF1200血濾器,設置連續靜脈-靜脈血液濾過模式,血液流速200~250ml/min,采用瑞典金寶AK-200血透機Online 生成置換液,用前稀釋方式輸入置換液,3~4L/h, 同時給予低分子肝素鈉(國藥準字H20030428)皮下注射,2500IU/次,2次/d。 兩組患者均連續治療7d。
1.4 觀察指標 (1)比較兩組治療前后血清炎癥介質指標。 采用酶聯免疫吸附試驗法檢測白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α),配套試劑盒購于武漢博士德生物工程有限公司。(2)比較兩組治療前后凝血功能。采用酶聯免疫吸附試驗法檢測P-選擇素(CD62P), 采用免疫比濁法檢測D-二聚體含量,采用日本Sysmex XE-2100血常規分析儀檢測血小板(PLT)計數,配套試劑盒均購于武漢博士德生物工程有限公司。(3)比較兩組不良反應發生情況。
1.5 統計學方法 采用SPSS18.0軟件進行數據處理,計量資料以(±s)表示,行t檢驗,計數資料用率表示,行χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組血清炎癥介質指標比較 治療前, 兩組IL-6、TNF-α 水平比較,差異無統計學意義(P>0.05);治療后,兩組IL-6、TNF-α 水平均降低,且觀察組低于對照組,差異有統計學意義(P<0.05)。 見表1。
表1 兩組血清指標比較(pg/ml,±s)
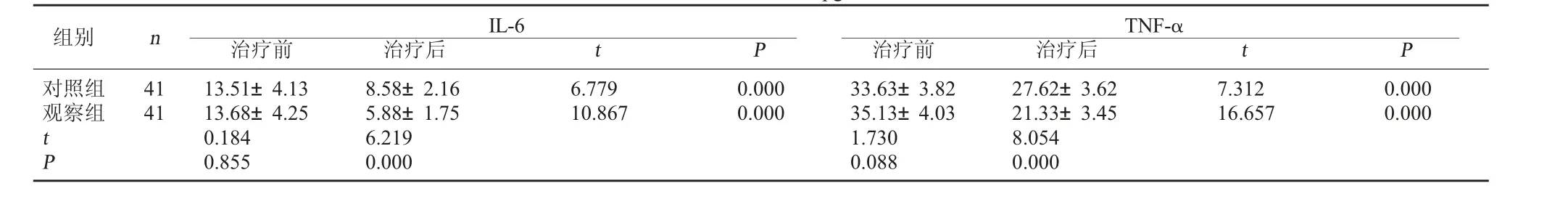
表1 兩組血清指標比較(pg/ml,±s)
組別 n對照組觀察組IL-6治療前 治療后 t P TNF-α治療前 治療后 t P 41416.77910.8670.0000.0007.31216.6570.0000.000 tP 13.51±4.1313.68±4.250.1840.8558.58±2.165.88±1.756.2190.00033.63±3.8235.13±4.031.7300.08827.62±3.6221.33±3.458.0540.000
2.2 兩組凝血功能比較 治療前, 兩組CD62P、D-二聚體、PLT 水平比較, 差異無統計學意義(P>0.05); 治療后, 兩組CD62P、D-二聚體水平降低,PLT 水平升高, 且觀察組CD62P、D-二聚體水平低于對照組,PLT 水平高于對照組,差異有統計學意義(P<0.05)。 見表2。
表2 兩組凝血功能比較(±s)
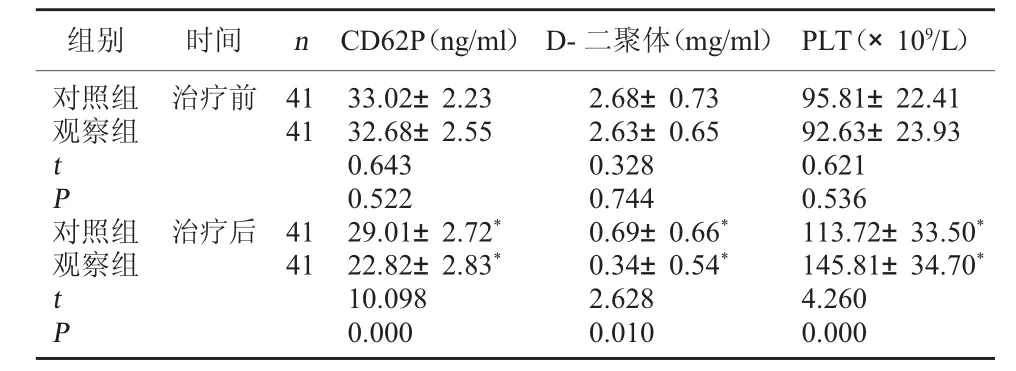
表2 兩組凝血功能比較(±s)
注:與同組治療前比較,*P<0.05。
組別 時間 n CD62P(ng/ml) D-二聚體(mg/ml) PLT(×109/L)對照組觀察組治療前41412.68±0.732.63±0.65 tP 0.3280.744對照組觀察組治療后41410.69±0.66*0.34±0.54*tP 33.02±2.2332.68±2.550.6430.52229.01±2.72*22.82±2.83*10.0980.0002.6280.01095.81±22.4192.63±23.930.6210.536113.72±33.50*145.81±34.70*4.2600.000
2.3 兩組不良反應發生情況比較 兩組治療期間未出現明顯不良反應。
3 討論
目前,膿毒癥是由感染引起的全身炎癥反應綜合征,發病機制較為復雜,已成為臨床危癥研究的熱點。 膿毒癥病理生理特征為炎癥反應使血管內皮細胞受損,進而影響血管內皮細胞的抗凝功能,并且在內毒素及炎癥介質的作用下使凝血系統異常活躍,引發血管微血栓形成,進而導致嚴重膿毒癥的發生[6~7]。
IL-6可通過激活T 淋巴細胞,誘導B 淋巴細胞分化, 并作用于組織細胞, 從而引發炎癥反應;TNF-α 可參與到膿毒癥的炎癥反應中;CD62P 是血小板活化的特異性標志物;D-二聚體、PLT 降低是由于凝血系統活化引起的[8]。 本研究結果顯示,治療后, 兩組CD62P、D-二聚體水平降低,PLT 水平升高, 且觀察組CD62P、D-二聚體水平低于對照組,PLT 水平高于對照組, 差異有統計學意義(P<0.05)。 表明嚴重膿毒癥患者使用低分子肝素聯合CBP 治療,可有效降低血清IL-6、TNF-α 水平,改善患者凝血功能。 低分子肝素是由凝膠過濾層析分離或亞硝酸分解純化的生物制劑,能夠抗Xa 因子,且見效快、持續時間長,具有出血風險低、利用率高及半衰期較普通肝素長等優點, 可有效抑制患者體內炎癥介質的釋放,減輕炎癥反應,阻斷脂多糖與高分子激肽原的結合,改善凝血功能,以控制病情發展,臨床應用安全[9]。 有關報道顯示,低分子肝素可有效抑制內毒素傳導, 進而抑制TNF-α 的過度表達,以減輕炎癥反應[10]。CBP 治療可將水分、毒素及代謝廢物排出體外,為患者的腎臟減輕負擔,為后續營養支持及抗感染治療提供條件; 還可將循環中的IL-6、TNF-α 等炎癥介質清除,改善炎癥反應,并對單核細胞功能進行改善,重建免疫功能,有效控制患者的病情。綜上所述,嚴重膿毒癥患者使用低分子肝素聯合CBP 治療,可有效降低血清IL-6、TNF-α 水平,改善患者凝血功能。

