低氧脅迫對(duì)軍曹魚(yú)幼魚(yú)抗氧化、免疫能力及能量代謝的影響
王維政,曾澤乾,黃建盛,2,郭志雄,李洪娟,陳 剛,2
低氧脅迫對(duì)軍曹魚(yú)幼魚(yú)抗氧化、免疫能力及能量代謝的影響
王維政1,曾澤乾1,黃建盛1,2,郭志雄1,李洪娟1,陳 剛1,2
(1. 廣東海洋大學(xué)水產(chǎn)學(xué)院,廣東 湛江 524088;2. 南方海洋科學(xué)與工程廣東省實(shí)驗(yàn)室(湛江),廣東 湛江 524025)
【】研究低氧脅迫對(duì)軍曹魚(yú) () 幼魚(yú)抗氧化、免疫能力和能量代謝的影響。幼魚(yú)于 (2.98±0.40) mg/L的低溶氧條件下養(yǎng)殖1周,分別測(cè)定其肝臟和肌肉組織的抗氧化、免疫相關(guān)酶活力以及能量供應(yīng)物質(zhì)。低氧脅迫過(guò)程中,幼魚(yú)肝臟組織超氧化物歧化酶 (SOD) 活力顯著升高 (< 0.05) 后逐漸下降 (< 0.05),肌肉組織SOD活力呈波動(dòng)上升趨勢(shì) (< 0.05),肝臟和肌肉組織谷胱甘肽過(guò)氧化物酶 (GPX) 活力和丙二醛 (MDA) 含量均顯著升高 (< 0.05)后,呈逐漸下降趨勢(shì),肝臟組織過(guò)氧化氫酶(CAT) 先降(< 0.05) 后升至正常水平,肌肉組織CAT活力先升(< 0.05) 后呈下降趨勢(shì);肝臟組織堿性磷酸酶(AKP) 活力先降后升高(< 0.05),隨后恢復(fù)至與對(duì)照組水平(> 0.05),肝臟酸性磷酸酶(ACP) 活力先顯著上升(< 0.05),隨后恢復(fù)至正常水平(> 0.05);肌肉組織和肝臟組織乳酸脫氫酶(LDH) 活力變化趨勢(shì)一致,均為先顯著升高(< 0.05),之后呈降低趨勢(shì);肝糖原在低氧脅迫后呈先下降(< 0.05),后恢復(fù)至對(duì)照組水平(> 0.05),肌糖原各時(shí)間點(diǎn)含量無(wú)顯著性差異(> 0.05)。軍曹魚(yú)幼魚(yú)在低氧脅迫后發(fā)生氧化損傷,刺激自身免疫系統(tǒng),通過(guò)調(diào)整相關(guān)酶活力及能量代謝的方式提高其適應(yīng)低氧的能力。
軍曹魚(yú);低氧脅迫;抗氧化;免疫;能量代謝
近年來(lái),隨著氣候變化和污染加劇,水體富營(yíng)養(yǎng)化頻頻發(fā)生,水體缺氧問(wèn)題日益嚴(yán)重,我國(guó)多個(gè)近岸海域均發(fā)現(xiàn)有缺氧或低氧現(xiàn)象[1]。水體溶氧對(duì)魚(yú)類生長(zhǎng)、發(fā)育、代謝、行為等有關(guān)鍵性作用[2-3]。魚(yú)類暴露在低氧環(huán)境時(shí),機(jī)體會(huì)產(chǎn)生大量的活性氧(ROS),如不及時(shí)消除,則誘導(dǎo)機(jī)體發(fā)生細(xì)胞凋亡、脂質(zhì)氧化、組織損傷、DNA和蛋白質(zhì)降解[4-5],造成氧化損傷。為此,多數(shù)魚(yú)類長(zhǎng)期以來(lái)已發(fā)展出各種策略以適應(yīng)低氧環(huán)境,包括調(diào)節(jié)紅細(xì)胞增殖、抑制紅細(xì)胞凋亡、刺激血管生成等增加氧氣輸送和改變代謝效率、減少消耗能量的生物合成途徑等減少機(jī)體耗氧量策略[6]。
軍曹魚(yú)() 又稱海鱺、海龍魚(yú)等,隸屬鱸形目鱸亞目軍曹魚(yú)科軍曹魚(yú)屬,主要分布于太平洋(東太平洋除外)、大西洋和印度洋等熱帶水域,我國(guó)沿海也有分布,為暖水性海洋魚(yú)類[7]。其生長(zhǎng)速度極快,營(yíng)養(yǎng)豐富,抗病力強(qiáng),有較高的經(jīng)濟(jì)價(jià)值,是海水網(wǎng)箱養(yǎng)殖中最具養(yǎng)殖前景的魚(yú)類之一,且隨著大規(guī)模種苗生產(chǎn)技術(shù)的成熟,逐漸成為我國(guó)南方海水養(yǎng)殖中最重要經(jīng)濟(jì)魚(yú)類之一[8]。目前,關(guān)于軍曹魚(yú)的研究主要集中在生長(zhǎng)、營(yíng)養(yǎng)和代謝等方面,而低氧脅迫方面的研究報(bào)道較少,郭志雄等[9]和黃建盛等[10]分別研究了急性低氧脅迫對(duì)大規(guī)格軍曹魚(yú)幼魚(yú)氧化應(yīng)激、能量代謝、糖代謝和血液生化指標(biāo)的影響,以及李洪娟等[11]研究了軍曹魚(yú)幼魚(yú)對(duì)低氧-復(fù)氧后氧化應(yīng)激和能量利用的響應(yīng),但這些研究均為急性低氧脅迫方面,而關(guān)于慢性低氧脅迫方面的研究還未見(jiàn)報(bào)道。筆者以低氧脅迫一周為條件,研究軍曹魚(yú)幼魚(yú)在低氧脅迫下抗氧化、免疫能力及能量代謝的變化情況,為軍曹魚(yú)的低氧適應(yīng)機(jī)制以及耐低氧新品種選育提供科學(xué)依據(jù)。
1 材料與方法
1.1 材料
軍曹魚(yú)為廣東海洋大學(xué)東海島海洋生物研究基地繁育的幼魚(yú)。幼魚(yú)運(yùn)回實(shí)驗(yàn)室后,于循環(huán)水養(yǎng)殖系統(tǒng)(自行設(shè)計(jì))暫養(yǎng)1周。養(yǎng)殖系統(tǒng)主要包括養(yǎng)殖水槽模塊、顆粒物去除模塊、氨氮去除模塊、供氣設(shè)備、回水管道等。其中,水槽規(guī)格為70 cm × 50 cm × 60 cm,單個(gè)水槽運(yùn)行水體175 L,頂部一側(cè)以PVC管進(jìn)水,另一側(cè)設(shè)溢水出水孔,24 h內(nèi)水體經(jīng)系統(tǒng)可交換12次(約90 L/h)。暫養(yǎng)期間水溫(26±1)℃,鹽度28 ~ 30,pH 7.8±0.2,持續(xù)充氣,自然光周期,每天8:00、16:00各投喂1次,投喂1 h后及時(shí)清除殘餌和糞便,實(shí)驗(yàn)前停飼1 d。
1.2 方法
1.2.1 實(shí)驗(yàn)設(shè)計(jì) 挑選體質(zhì)健康、活力良好、體質(zhì)量(12.52±1.32) g的軍曹魚(yú)幼魚(yú)90尾,隨機(jī)放入3個(gè)水槽,每個(gè)水槽30尾,進(jìn)行低氧脅迫實(shí)驗(yàn)。關(guān)閉流水以及氣石,用薄膜封蓋水槽,在1 h內(nèi)將水體溶氧自然降至接近3 mg/L,隨后通過(guò)控制水流量及充氣量維持該溶氧水平,調(diào)整3 h后開(kāi)始計(jì)時(shí),進(jìn)行為期1周的低氧脅迫實(shí)驗(yàn)。實(shí)驗(yàn)期間用溶氧儀(臺(tái)灣衡欣,AZ8403型) 實(shí)時(shí)監(jiān)控溶氧水平,通過(guò)化學(xué)碘量法(GB7489-87) 校正溶氧儀讀數(shù),水體溶氧為(2.98±0.40) mg/L。其他環(huán)境條件及投喂方式與暫養(yǎng)一致。
1.2.2 樣品采集 在低氧脅迫前(0 d)及脅迫1、4、7 d時(shí)取樣,以脅迫前樣品為對(duì)照組,每水槽每個(gè)時(shí)間點(diǎn)取魚(yú)3尾,用100 mg/L MS-222海水溶液麻醉,逐尾剖取肝臟和肌肉組織,分別放入2 mL凍存管,迅速置于液氮中,置-80℃冰箱保存,待測(cè)。
1.2.3 酶活力與含量的測(cè)定 取軍曹魚(yú)肝臟、肌肉組織,分別按每克待測(cè)組織加入9 mL生理鹽水的比例在冰水浴條件下用勻漿機(jī)制備成勻漿液,將勻漿液在4℃、2 000 r/min條件下離心10 min,取上清液分裝于2 mL離心管,放入4 ℃冰箱保存,用于酶活力,蛋白質(zhì)、肝糖原及肌糖原含量的測(cè)定。
超氧化物歧化酶(SOD)、過(guò)氧化氫酶(CAT)、谷胱甘肽過(guò)氧化物酶(GPX)、酸性磷酸酶(ACP)、堿性磷酸酶(AKP)、乳酸脫氫酶(LDH) 活力,丙二醛(MDA)、肝糖原、肌糖原、蛋白質(zhì)含量均采用VICTOR NivoTM酶標(biāo)儀(鉑金埃爾默,美國(guó),型號(hào):HH359400031)測(cè)定,所用試劑盒購(gòu)于南京建成生物科技有限公司。按照試劑盒說(shuō)明書(shū),SOD活力(U/mg) 采用羥胺法測(cè)定;CAT活力(U/mg) 采用鉬酸銨法測(cè)定;GPX的活力(U/mg) 采用比色法測(cè)定;ACP或AKP的活力(金氏單位/g) 采用微板法測(cè)定;LDH活力(nmol/g) 采用微板法測(cè)定;MDA含量(nmol/mg) 的測(cè)定采用TBA法;糖原含量(mg/g) 采用比色法測(cè)定;蛋白質(zhì)含量(g/L) 采用考馬斯亮藍(lán)法測(cè)定。所測(cè)指標(biāo)分別重復(fù)3次。
1.3 數(shù)據(jù)分析
數(shù)據(jù)采用平均值±標(biāo)準(zhǔn)差表示,用SPSS 19.0對(duì)所得的實(shí)驗(yàn)數(shù)據(jù)進(jìn)行單因素方差分析,不同時(shí)間點(diǎn)的數(shù)據(jù)進(jìn)行Duncan氏多重比較,< 0.05時(shí)差異顯著,< 0.01時(shí)差異極顯著。
2 結(jié)果
2.1 低氧脅迫對(duì)軍曹魚(yú)幼魚(yú)氧化應(yīng)激指標(biāo)的影響
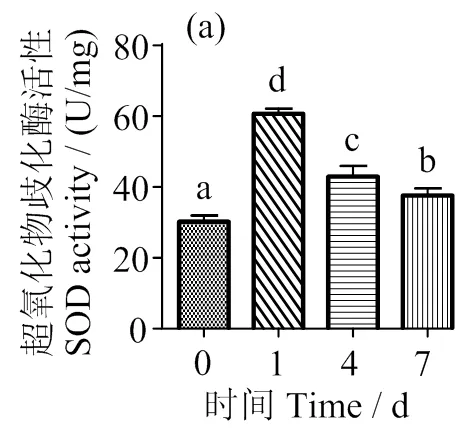
由圖1a和c可知,隨著脅迫時(shí)間的延長(zhǎng),肝臟SOD和GPX活力變化趨勢(shì)一致,先升高后下降,且1 d時(shí)顯著高于對(duì)照組(<0.05),CAT活力在1 d時(shí)顯著下降(<0.05) (圖1b),之后恢復(fù)至正常水平,MDA含量在1 d時(shí)極顯著升高(<0.01),隨后顯著下降(< 0.05)(圖1d)。
凡含一個(gè)相同字母表示組間差異不顯著(> 0.05)
The data with a same letter indicate no significant difference between groups(> 0.05)
圖1 低氧脅迫對(duì)軍曹魚(yú)幼魚(yú)肝臟SOD、CAT、GPX及MAD活性的影響
Fig. 1 Effects of hypoxic on the activity of SOD, CAT and GPX and the content of malondialdehyde in liver of juvenile cobia
由圖2a可知,隨著脅迫時(shí)間的增加,肌肉SOD活力呈上升趨勢(shì),在1、4、7 d時(shí)活力均顯著高于對(duì)照組(<0.05),CAT、GPX活力,MDA含量均呈先升后降的趨勢(shì),CAT在1、4 d時(shí)顯著高于對(duì)照組(< 0.05) (圖2b),GPX在1、4、7 d時(shí)均顯著高于對(duì)照組(< 0.05)(圖2c),MDA在1、4 d時(shí)顯著升高(< 0.05),7 d時(shí)降至正常水平(圖2d)。
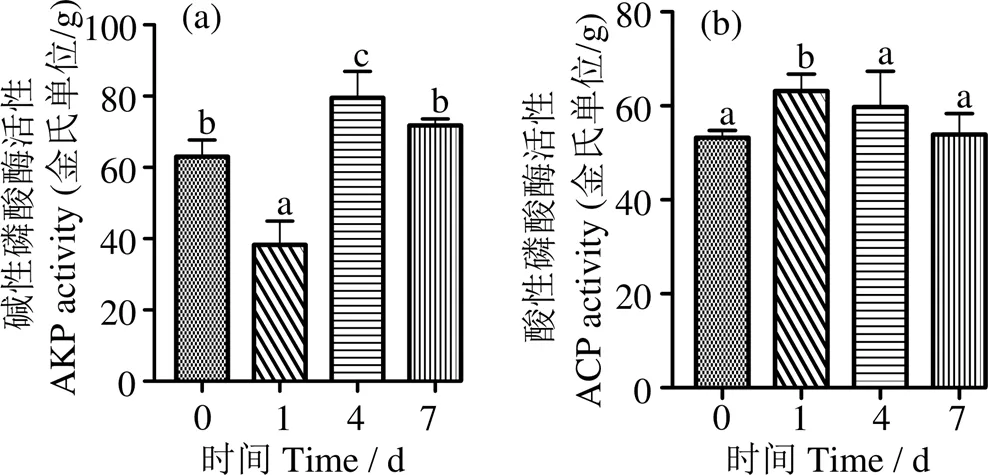
2.2 低氧脅迫對(duì)肝臟組織堿性磷酸酶和酸性磷酸酶活性的影響
由圖3a可知,低氧脅迫1 d時(shí),肝臟AKP活性顯著下降,4 d時(shí)顯著上升并高于對(duì)照組,隨后在7 d時(shí)下降到對(duì)照組水平;肝臟ACP活性表現(xiàn)為先升高后下降,1 d時(shí)顯著高于對(duì)照組(< 0.05),之后降至對(duì)照組水平(> 0.05) (圖3b)。
2.3 低氧脅迫對(duì)軍曹魚(yú)幼魚(yú)能量代謝指標(biāo)的影響
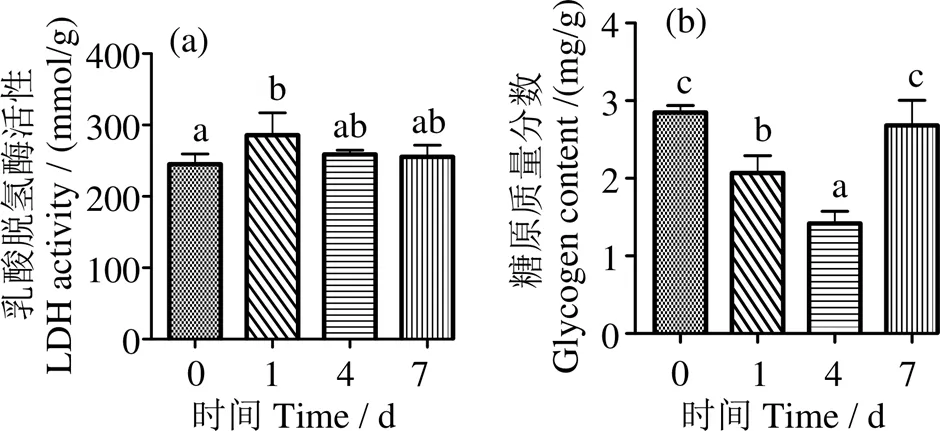
圖4a顯示,低氧脅迫后肝臟LDH活力在1 d時(shí)顯著上升(< 0.05),隨后下降,與對(duì)照組差異無(wú)統(tǒng)計(jì)學(xué)意義(> 0.05);肝糖原含量在1、4 d時(shí)顯著下降并在4 d時(shí)最低(< 0.05),7 d時(shí)與對(duì)照組無(wú)顯著差異(> 0.05) (圖4b)。

凡含一個(gè)相同字母表示組間差異不顯著(P > 0.05)
凡含一個(gè)相同字母表示組間差異不顯著(P > 0.05)
凡含一個(gè)相同字母表示組間差異不顯著(P > 0.05)
圖5a顯示,低氧脅迫4 d時(shí)肌肉LDH活力顯著增大(< 0.05),其他時(shí)間點(diǎn)與對(duì)照組無(wú)顯著性差異(> 0.05);低氧脅迫后,肌糖原含量平均值先降后升,但各時(shí)間點(diǎn)與對(duì)照組無(wú)顯著性差異(> 0.05)(圖5b)。
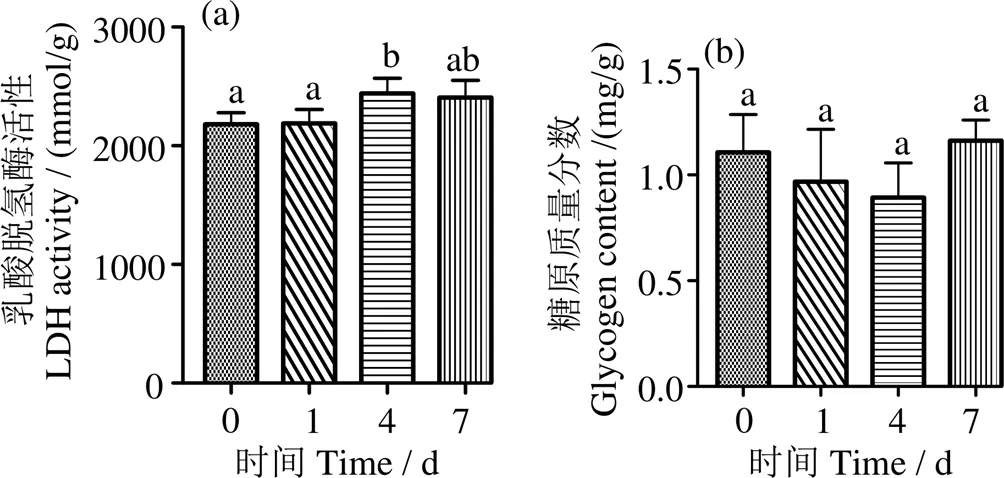
凡含一個(gè)相同字母表示組間差異不顯著(P > 0.05)
3 討論
3.1 低氧脅迫對(duì)軍曹魚(yú)幼魚(yú)氧化應(yīng)激的影響
在常氧狀態(tài)下,ROS的產(chǎn)生和消除處于一種動(dòng)態(tài)平衡,當(dāng)魚(yú)類受低氧脅迫時(shí),體內(nèi)的黃嘌呤脫氫酶可轉(zhuǎn)化為黃嘌呤氧化酶,線粒體電子傳遞鏈載體失活,魚(yú)體則產(chǎn)生大量的ROS[12-13],造成ROS的生成速率超過(guò)消除速率,發(fā)生氧化應(yīng)激。為盡量減少ROS對(duì)機(jī)體的損傷,魚(yú)類等需氧生物已進(jìn)化出、一套抗氧化防御系統(tǒng),如SOD、CAT和GPX等抗氧化酶[14]。SOD將O2-轉(zhuǎn)化為H2O2,H2O2隨后被CAT分解為H2O和O2,于是SOD-CAT就形成了魚(yú)類對(duì)抗氧化損傷的第一道防線,而GPX則將H2O2和有機(jī)過(guò)氧化物轉(zhuǎn)化為H2O,它們?cè)诰S持自由基平衡和減少氧化損傷方面發(fā)揮著重要作用[15]。
在本研究中,低氧脅迫1 d時(shí)肝臟SOD和GPX活力顯著增加,CAT活力顯著下降,肌肉三種抗氧化酶活力均顯著上升,表明軍曹魚(yú)在低氧脅迫1 d后機(jī)體處于氧化應(yīng)激的狀態(tài),組織受到損傷,啟動(dòng)抗氧化防御體系來(lái)清除過(guò)量產(chǎn)生的ROS,這在斑馬魚(yú)()[16]的研究得以印證,其在3 mg/L的低氧脅迫后也引起內(nèi)臟團(tuán)的SOD和GPX活力升高,而在本實(shí)驗(yàn)室前期實(shí)驗(yàn)中,大規(guī)格軍曹魚(yú)幼魚(yú)在急性低氧脅迫后肝臟SOD和GPX活力卻顯著降低[9],原因可能是脅迫的時(shí)間和低氧條件的不同,導(dǎo)致了結(jié)果的差異。對(duì)于低氧脅迫后肝臟CAT活力下降的情況,在河川沙塘鱧() 的研究中亦有肝臟CAT活力降低的現(xiàn)象,可能的原因是該時(shí)段肝臟產(chǎn)生過(guò)多的ROS,反過(guò)來(lái)抑制了CAT活性[17],此外,SOD產(chǎn)生的H2O2主要由CAT清除,SOD活力顯著增高,產(chǎn)生了大量的H2O2,也可能會(huì)抑制CAT的活性,導(dǎo)致該時(shí)段CAT活力顯著低于對(duì)照水平。
在低氧脅迫4 d時(shí),肝臟SOD活力仍顯著高于對(duì)照組,肌肉三種抗氧化酶也顯著高于對(duì)照水平,說(shuō)明軍曹魚(yú)在脅迫4 d時(shí)仍處于氧化應(yīng)激狀態(tài),但肝臟和肌肉抗氧化酶均有恢復(fù)至對(duì)照水平的變化趨勢(shì),當(dāng)?shù)脱趺{迫持續(xù)7 d時(shí),肝臟CAT和GPX活性以及肌肉CAT活性已恢復(fù)至對(duì)照水平,說(shuō)明軍曹魚(yú)可通過(guò)自身的調(diào)節(jié)逐漸適應(yīng)低氧脅迫,該結(jié)果與瓦氏黃顙魚(yú)()[13]在急性低氧脅迫后肝臟抗氧化酶活性先升高后下降的結(jié)果類似,但與大口黑鱸()[18]的結(jié)果有所不同,大口黑鱸在低氧脅迫后其肝臟SOD活性持續(xù)顯著低于對(duì)照組,而CAT和GPX活性則表現(xiàn)為先顯著高于對(duì)照組,后顯著低于對(duì)照水平,對(duì)此,有研究發(fā)現(xiàn),低氧誘導(dǎo)的氧化應(yīng)激是一種物種和組織特異性的現(xiàn)象[19],不同魚(yú)類對(duì)低氧脅迫的應(yīng)激反應(yīng)會(huì)有所不同。
MDA是自由基和多不飽和脂肪酸反應(yīng)產(chǎn)生的環(huán)氧化合物,對(duì)魚(yú)類的物質(zhì)和能量代謝以及信息的傳遞產(chǎn)生影響,可作為氧化應(yīng)激的一個(gè)指標(biāo)[20]。本研究中,肝臟和肌肉MDA含量的變化趨勢(shì)一致,均在1 d時(shí)顯著上升,表明軍曹魚(yú)因低氧脅迫而受到脂質(zhì)過(guò)氧化的損傷,與褐牙鲆()[21]研究結(jié)果相似,在溶氧不斷下降的過(guò)程中,褐牙鲆幼魚(yú)肌肉的MDA含量增加。從抗氧化指標(biāo)可見(jiàn),1 d時(shí)的肝臟和肌肉抗氧化酶活性顯著增大,表明此時(shí)產(chǎn)生的自由基過(guò)多,抗氧化酶不能及時(shí)清除,導(dǎo)致脂質(zhì)過(guò)氧化的發(fā)生,對(duì)肝臟和肌肉產(chǎn)生負(fù)面的影響,但隨著時(shí)間的延長(zhǎng),MDA含量逐漸下降,說(shuō)明軍曹魚(yú)可在長(zhǎng)期低氧脅迫下進(jìn)行自我調(diào)節(jié),緩解應(yīng)激狀態(tài)。
此外,PILLET等[22]研究表明,肝臟對(duì)活性氧誘導(dǎo)的氧化應(yīng)激最為敏感,本研究中,低氧脅迫后肝臟酶活力及MDA含量均明顯高于肌肉,與文獻(xiàn)[22]結(jié)果一致,說(shuō)明肝臟最易受到氧化應(yīng)激的損傷。
3.2 低氧脅迫對(duì)軍曹魚(yú)幼魚(yú)肝臟堿性磷酸酶和酸性磷酸酶的影響
溶酶體可通過(guò)水解細(xì)菌細(xì)胞壁組分來(lái)清除細(xì)菌,因此常用作水生生物功能防御和健康狀況的標(biāo)志物,其對(duì)應(yīng)激所產(chǎn)生的ROS極為敏感,一旦ROS過(guò)量產(chǎn)生,則溶酶體膜通透性降低,釋放堿性磷酸酶(AKP) 和酸性磷酸酶(ACP) 等酶類[23]。后二者在魚(yú)類免疫應(yīng)答和多種代謝中起重要作用[24-25],當(dāng)面臨外界環(huán)境壓力時(shí),會(huì)產(chǎn)生ACP和AKP以降解外來(lái)物質(zhì)。舌鰨()[26]、大黃魚(yú)()[27]的研究中,與對(duì)照組相比,鹽度的波動(dòng)或降低鹽度可顯著提高舌鰨肝臟、大黃魚(yú)腎臟ACP和AKP活性。這意味著機(jī)體抵御外界物質(zhì)能力以及代謝能力增強(qiáng),提供更多的能量來(lái)維持自身的穩(wěn)態(tài)。本研究中,軍曹魚(yú)幼魚(yú)在低氧脅迫期間,肝臟AKP和ACP活性分別在脅迫4 d和1 d顯著升高,表明低氧作為一種環(huán)境應(yīng)激因子,刺激軍曹魚(yú)的免疫應(yīng)答,增強(qiáng)了免疫防御能力,同時(shí)也增強(qiáng)了代謝強(qiáng)度。此外,雖然AKP活性在7 d的低氧脅迫過(guò)程中整體上升,但是在脅迫1 d時(shí)的活性卻顯著下降,參考鯉()[25]在百草枯脅迫1 d時(shí)也出現(xiàn)AKP活性下降的情況,并結(jié)合本實(shí)驗(yàn)抗氧化酶活性結(jié)果,推測(cè)原因可能是,脅迫1 d 時(shí)ROS大量產(chǎn)生,造成軍曹魚(yú)的先天性免疫功能紊亂以及ROS抑制了AKP的活性。
3.3 低氧脅迫對(duì)軍曹魚(yú)幼魚(yú)能量代謝的影響
脊椎動(dòng)物糖原代謝是其獲取能量的重要途徑,對(duì)維持機(jī)體的能量代謝和重要功能物質(zhì)的合成有重要作用[28]。研究表明,缺氧與厭氧代謝的激活有關(guān)[29],魚(yú)類在低氧脅迫后肝糖原和肌糖原的含量會(huì)發(fā)生顯著下降,說(shuō)明在魚(yú)類低氧應(yīng)激過(guò)程中通過(guò)改變自身代謝途徑的方式為機(jī)體提供能量[30]。本研究中,肝糖原在脅迫1、4 d時(shí)顯著下降,說(shuō)明在這期間,軍曹魚(yú)幼魚(yú)為應(yīng)對(duì)低氧環(huán)境啟動(dòng)厭氧糖酵解,大量分解糖原,以維持血糖的濃度。當(dāng)脅迫持續(xù)到7 d時(shí),肝糖原含量恢復(fù)到正常水平,說(shuō)明隨時(shí)間的延長(zhǎng),軍曹魚(yú)幼魚(yú)通過(guò)各種生理生化調(diào)節(jié),逐漸適應(yīng)低氧環(huán)境,代謝趨于正常。另外,本研究可見(jiàn),肌糖原含量?jī)H平均值下降,與對(duì)照組無(wú)顯著性差異,與大口黑鱸[31]和花鱸()[28]的研究結(jié)果類似,大口黑鱸和花鱸在低氧脅迫后肌糖原均未表現(xiàn)出顯著的變化,原因可能是肝臟作為低氧脅迫主要的代謝器官,肝糖原的分解提供了大部分的能量,肌糖原僅參與小部分機(jī)體能量供應(yīng)。
乳酸脫氫酶(LDH) 可催化丙酮酸與乳酸間的相互轉(zhuǎn)化,其活性與組織內(nèi)的氧分壓密切相關(guān),在低氧條件下活性增高,促進(jìn)厭氧糖酵解,產(chǎn)生的乳酸反過(guò)來(lái)又會(huì)提高LDH的活性,因此,LDH活性一定程度上可反映厭氧呼吸水平[32]。本研究中,脅迫1 d時(shí)肝臟LDH活性顯著升高,說(shuō)明機(jī)體正在進(jìn)行厭氧呼吸,且隨著糖原含量的減少,肝臟糖異生作用被激活,以供應(yīng)厭氧代謝所需的能量,因此,在缺氧過(guò)程中產(chǎn)生乳酸作為糖異生底物,刺激LDH活性,將乳酸轉(zhuǎn)化為丙酮酸,生成葡萄糖,在郭志雄等[9]和黃建盛等[10]的研究中也出現(xiàn)了類似的結(jié)果,軍曹魚(yú)幼魚(yú)在急性低氧脅迫后肝臟和血清LDH活性均顯著升高。而肌肉LDH在脅迫1 d時(shí)無(wú)顯著變化,在4 d時(shí)顯著上升,也說(shuō)明肌肉并非低氧過(guò)程中供應(yīng)能量的主要組織,但隨著脅迫時(shí)間的增加,積累的乳酸也導(dǎo)致其LDH活性上升。
4 結(jié)論
軍曹魚(yú)幼魚(yú)在低氧脅迫后發(fā)生氧化損傷,刺激自身免疫系統(tǒng),通過(guò)調(diào)整相關(guān)酶活力及能量代謝的方式提高其適應(yīng)低氧的能力。
[1] 穆景利, 靳非, 趙化德, 等. 水體低氧的早期暴露對(duì)青鳉()后期的生長(zhǎng)、性別比和繁殖能力的影響 [J]. 生態(tài)毒理學(xué)報(bào), 2017, 12(2): 137-146.
[2] 徐賀, 陳秀梅, 王桂芹, 等. 低氧脅迫在水產(chǎn)養(yǎng)殖中的研究進(jìn)展 [J]. 飼料工業(yè), 2016, 37(2): 33-37.
[3] 狄治朝, 周濤, 許強(qiáng)華. 低氧脅迫與常氧條件下斑馬魚(yú)鰓中熱休克蛋白基因家族的表達(dá)差異比較[J]. 大連海洋大學(xué)學(xué)報(bào), 2018, 33(6): 690-695.
[4] DU S N, MAHALINGAM S, BOROWIEC B G, et al. Mitochondrial physiology and reactive oxygen species production are altered by hypoxia acclimation in killifish () [J]. Journal of Experimental Biology, 2016, 219(8): 1130-1138.
[5] WANG Q F, SHEN W L, HOU C C, et al. Physiological responses and changes in gene expression in the large yellow croakerfollowing exposure to hypoxia [J]. Chemosphere, 2017, 169: 418-427.
[6] ZHANG G S, ZHAO C, WANG Q T, et al. Identification of HIF-1 signaling pathway inusing RNA-Seq: effects of acute hypoxia and reoxygenation on oxygen sensors, respiratory metabolism, and hematology indices [J]. Journal of Comparative Physiology B, 2017, 187(7): 1-13.
[7] 王中鐸, 史沛鑫, 蘇惠娜, 等.軍曹魚(yú)群體遺傳結(jié)構(gòu)的AFLP分析[J]. 廣東海洋大學(xué)學(xué)報(bào), 2011, 31(1): 12-17.
[8] 陳強(qiáng), 劉泓宇, 譚北平, 等. 飼料膽固醇對(duì)軍曹魚(yú)幼魚(yú)生長(zhǎng)、血液生化指標(biāo)及脂代謝的影響[J]. 廣東海洋大學(xué)學(xué)報(bào), 2016, 36(1): 35-43.
[9] 郭志雄, 曾澤乾, 黃建盛, 等.急性低氧脅迫對(duì)大規(guī)格軍曹魚(yú)幼魚(yú)肝臟氧化應(yīng)激、能量利用及糖代謝的影響[J]. 廣東海洋大學(xué)學(xué)報(bào), 2020, 40(3): 134-140.
[10] 黃建盛, 陸枝, 陳剛, 等. 急性低氧脅迫對(duì)軍曹魚(yú)大規(guī)格幼魚(yú)血液生化指標(biāo)的影響[J]. 海洋學(xué)報(bào), 2019, 41(6): 76-84.
[11] 李洪娟, 陳剛, 郭志雄, 等.軍曹魚(yú)() 幼魚(yú)對(duì)環(huán)境低氧脅迫氧化應(yīng)激與能量利用指標(biāo)的響應(yīng)[J]. 海洋學(xué)報(bào), 2020, 42(4): 12-19.
[12] LUSHCHAK V I, BAGNYUKOVA T V. Hypoxia induces oxidative stress in tissues of a goby, the rotan[J]. Comparative Biochemistry & Physiology Part B, 2007, 148(4): 390-397.
[13] ZHANG G S, MAO J Q, LIANG F F, et al. Modulated expression and enzymatic activities of Darkbarbel catfish,for oxidative stress induced by acute hypoxia and reoxygenation[J]. Chemosphere, 2016, 151: 271-279.
[14] DASGUPTA S, GIULIO R T D, DROLLETTE B D, et al. Hypoxia depresses CYP1A induction and enhances DNA damage, but has minimal effects on antioxidant responses in sheepshead minnow () larvae exposed to dispersed crude oil[J]. Aquatic Toxicology, 2016, 177: 250-260.
[15] CAO L, HUANG W, SHAN X J, et al. Tissue-specific accumulation of cadmium and its effects on antioxidative responses in Japanese flounder juveniles[J]. Environmental Toxicology & Pharmacology, 2012, 33(1): 16-25.
[16] FENG J F, GUO Y, GAO Y F, et al. Effects of hypoxia on the physiology of zebrafish (): Initial responses, acclimation and recovery[J]. Bulletin of Environmental Contamination & Toxicology, 2016, 96(1): 43-48.
[17] 賈秀琪, 張宏葉, 王麗等. 低氧脅迫對(duì)河川沙塘鱧抗氧化酶及ATP酶活性的影響 [J]. 海洋漁業(yè), 2017, 39(3): 306-313.
[18] YANG S, YAN T, WU H, et al. Acute hypoxic stress: effect on blood parameters, antioxidant enzymes, and expression of HIF-1alpha and GLUT-1 genes in largemouth bass ()[J]. Fish & Shellfish Immunology, 2017, 67: 449-458.
[19] LEVEELAHTI L, RYTK?NEN K T, RENSHAW G M C, et al. Revisiting redox-active antioxidant defenses in response to hypoxic challenge in both hypoxia-tolerant and hypoxia-sensitive fish species[J]. Fish Physiology & Biochemistry, 2014, 40(1): 183-191.
[20] 區(qū)又君, 陳世喜, 王鵬飛, 等. 低氧環(huán)境下卵形鯧鲹的氧化應(yīng)激響應(yīng)與生理代謝相關(guān)指標(biāo)的研究 [J]. 南方水產(chǎn)科學(xué), 2017, 13(3): 120-124.
[21] 李潔, 唐夏, 張靈燕等. 溶解氧水平對(duì)褐牙鲆幼魚(yú)能量代謝和氧化應(yīng)激的影響研究[J]. 廣西科學(xué)院學(xué)報(bào), 2015, 31(1): 22-27.
[22] PILLET M, DUPONTPRINET A, CHABOT D, et al. Effects of exposure to hypoxia on metabolic pathways in northern shrimp () and Greenland halibut ()[J]. Journal of Experimental Marine Biology & Ecology, 2016, 483: 88-96.
[23] GUO J S, WU P H, CAO J L, et al. The PFOS disturbed immunomodulatory functions via nuclear factor-κB signaling in liver of zebrafish ()[J]. Fish & shellfish immunology, 2019, 91: 87-98.
[24] CHEN S J, XIE S W, CHEN M, et al. Hypoxia-induced changes in survival, immune response and antioxidant status of the Pacific white shrimp () fed with graded levels of dietary myo-inositol[J]. Aquaculture nutrition, 2019, 25(2): 518-528.
[25] MA J G, LI Y Y, WU M L, et al. Serum immune responses in common carp (L.) to paraquat exposure: The traditional parameters and circulating microRNAs [J]. Fish & Shellfish Immunology, 2018, 76: 133-142.
[26] KHAIRNAR S O, TIAN X, DONG S, et al. Effects of the amplitude and frequency of salinity fluctuations on antioxidant responses in juvenile tongue sole, Cynoglossus semilaevis[J]. Spanish Journal of Agricultural Research, 2016, 14(2): e0503.
[27] WANG Y J, LI W M, LI L S, et al. Effects of salinity on the physiological responses of the large yellow croaker Pseudosciaena crocea under indoor culture conditions [J]. Aquaculture Research, 2016, 47(11): 3410-3420.
[28] 常志成, 溫海深, 張美昭, 等. 溶解氧水平對(duì)花鱸幼魚(yú)氧化應(yīng)激與能量利用的影響及生理機(jī)制 [J]. 中國(guó)海洋大學(xué)學(xué)報(bào)(自然科學(xué)版), 2018, 48(7): 20-28.
[29]SPEERS R B, SANDBLOM E G. Effects of environmental hypoxia on cardiac energy metabolism and performance in tilapia [J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298(2): 104-119.
[30] LI M X, WANG X D, QI C L, et al. Metabolic response of Nile tilapia () to acute and chronic hypoxia stress [J]. Aquaculture, 2018, 495: 187-195.
[31]YANG S, WU H, HE K, et al. Response of AMP-activated protein kinase and lactate metabolism of largemouth bass () under acute hypoxic stress[J]. Science of the Total Environment, 2019, 666: 1071-1079.
[32] WANG Q F, SHEN W L, LIU C, et al. Effects of multi-environmental factors on physiological and biochemical responses of large yellow croaker,[J]. Chemosphere, 2017, 184: 907-915.
Effects of Hypoxia Stress on Antioxidation, Immunity and Energy Metabolism of Juvenile Cobia,
WANG Wei-zheng1, ZENG Ze-qian1, HUANG Jian-sheng1,2, GUO Zhi-xiong1, LI Hong-juan1, CHEN Gang1,2
(1.,524025,; 2.(),524025,)
【】To investigate the effect of hypoxia on antioxidant , immunity and energy metabolism of juvenile cobia. 【】,a 7-day hypoxia (2.98±0.40 mg/L) experiment was conducted, and the enzymes of antioxidant, immunity and the energy metabolism in liver and muscle were monitored. 【】The activity of superoxide dismutase (SOD) increased significantly (<0.05) and then decreased in liver while significantly increased (<0.05) in muscle after hypoxia stress. The activities of glutathione peroxidase (GPX) and the content of malondialdehyde (MDA) in both liver and muscle increased significantly (<0.05) and then decreased. However, the activities of catalase (CAT) increased significantly (<0.05) and then decreased in muscle, whereas it is decreased significantly (<0.05) and then increased in liver. Alkaline phosphatase (AKP) activity in liver decreased significantly (<0.05) at first and then increased significantly (<0.05), and eventually recovered to the level of control, but the activities of acid phosphatase (ACP) presented the opposite trend. The activities of lactate dehydrogenase (LDH) was the same in liver and muscle, both increased significantly (<0.05) and then decreased. In addition, the content of glycogen in liver declined (<0.05) after hypoxia stress, then recovered to the level of the control (>0.05). but the content of muscle glycogen had no significant difference (>0.05) in different time. 【】The juvenile cobia encountered oxidative damage after hypoxia stress, which stimulated the immune system and improved its ability to adapt to hypoxia byregulating the activity of relevant enzymes and energy metabolism.
; hypoxia; antioxidant; immune; energy metabolism
S965.399
A
1673-9159(2020)05-0012-07
10.3969/j.issn.1673-9159.2020.05.002
2019-11-29
現(xiàn)代農(nóng)業(yè)產(chǎn)業(yè)技術(shù)體系專項(xiàng)資金資助(CARS-47);廣東海洋大學(xué)大學(xué)生創(chuàng)新創(chuàng)業(yè)訓(xùn)練計(jì)劃項(xiàng)目(CXXL2018131);南方海洋科學(xué)與工程廣東省實(shí)驗(yàn)室(湛江)(ZJW-2019-06);2018年廣東海洋大學(xué)起航計(jì)劃項(xiàng)目(QHJHZR201818)
王維政(1995―),男,碩士研究生,主要研究方向海水魚(yú)類養(yǎng)殖生理生態(tài)學(xué)。E-mail: 1029588896 @qq.com
黃建盛,副教授,主要研究方向海水魚(yú)養(yǎng)殖生理生態(tài)學(xué)。E-mail:huangjs@gdou.edu.cn
陳剛,教授,主要研究方向海水魚(yú)養(yǎng)殖生理生態(tài)學(xué)。E-mail:cheng@gdou.edu.cn
王維政,曾澤乾,黃建盛,等. 低氧脅迫對(duì)軍曹魚(yú)幼魚(yú)抗氧化、免疫能力及能量代謝的影響[J]. 廣東海洋大學(xué)學(xué)報(bào),2020,40(5):12-18.
(責(zé)任編輯:劉慶穎)

