福辛普利對UUO大鼠腎組織TGF-β1及Smad3的影響①
聶 晶,王 鶴,楊 松,張志光,康曉明
(1.佳木斯大學附屬第一醫院,黑龍江 佳木斯 154003;2.佳木斯大學宏大醫院,黑龍江 佳木斯 154002)
腎臟纖維化(Renal interstitial fibrosis,RIF)是各種致病因素導致的正常腎臟細胞壞死、凋亡,因腎臟再生能力較差,大量間質細胞增殖,細胞外基質堆積,引起的病理過程,是慢性腎病的最終病理類型[1,2]。炎性細胞浸潤、成纖維細胞的活化增殖、細胞外基質沉積及正常腎臟組織被纖維化組織所代替是纖維化主要的病理學改變,多種細胞因子參與RIF的進展,其中TGF-β1 /Smad3為RIF的共同通路。福辛普利作為血管緊張素轉換酶抑制劑,用于高血壓及心衰的治療,有研究表明,該藥物可以通過升高TGF-β1 /Smad3通路上游蛋白的表達,從而發揮延緩腎臟纖維化的作用,但具體的作用機制尚不清楚。因此,通過福辛普利對UUO大鼠腎組織TGF-β1 /Smad3表達的影響,為臨床延緩腎間質纖維化提供理論依據。
1 材料與方法
1.1 材料
兔抗大鼠TGF-β1抗體、兔抗大鼠Smad3抗體、山羊抗兔生物素標記IgG( 購買于武漢博士德生物工程有限公司) 、DAB顯色試劑盒、抗原修復液Ⅰ、SABC免疫組化試劑盒、MASSON染色試劑盒(購買于武漢博士德生物工程有限公司)。
1.2 動物分組及模型制作
將72只健康清潔的 Wistar 雄性大鼠隨機均分為3組:Sham組、UUO組、福辛普利組,每組24只。其中UUO組及福辛普利組行左側輸尿管結扎。Sham組大鼠僅鈍性剝離輸尿管,不結扎及剪斷輸尿管,其余處理同前。藥物治療組(福辛普利組)每日給予福辛普利(30mg/kg·d溶于2mL生理鹽水制成懸液灌胃),Sham組及UUO模型組對應給予2mL生理鹽水灌胃。
1.3 標本收集、處理及測定
各組大鼠在分別于術后第3d、7d、14d隨機抽取8只大鼠處死。處死前采5mL靜脈血,離心后行血尿素氮和肌酐檢測。摘取左側腎臟多聚甲醛固定,將各組腎臟組織行梯度脫水,透明處理及石蠟包埋,蠟塊切片3μm,制成病理切片,行HE染色、Masson染色和免疫組化檢測。
1.4 Masson染色及免疫組化結果判定
1.4.1 Masson染色
將Masson染色后的切片置于光鏡下觀察,400倍鏡下觀察Masson的結果,腎小管上皮細胞漿及細胞核呈紫紅色的為陽性,選取10個不同視野,參考文獻[4]方法評估腎小管間質損傷程度,用RIF指數評分表示。
1.4.2 免疫組化
將免疫組化染色的切片在在400倍光鏡下觀察免疫組化的結果,視野內表現為棕黃色的顆粒為染色陽性指標。隨機觀察10個不同視野,利用圖像分析系統分析兩組腎組織陽性染色( 棕黃色顆粒) 的平均光密度,用AOD表示。
1.3 統計學方法
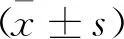
2 結果
2.1 生化分析
對比Sham組3d、7d、14d大鼠血BUN、Scr未見明顯異常(P>0.05)。對比UUO組及Sham組對應時間點發現,UUO組大鼠血BUN、Scr明顯升高,且隨著梗阻時間逐漸加重,呈現正相關,福辛普利組大鼠血 BUN、Scr較UUO組對應時間點內各指標均降低,差異具有統計學意義(P<0.05)。見表 1。

表1 不同時間點各組生化指標
2.2 Masson染色
Masson染色顯示sham組大鼠3d、7d、14d腎組織結構無明顯改變,間質基本無綠染。與sham組對應時間點相比,UUO組大鼠腎組織隨梗阻時間延長,間質膠原纖維逐漸綠染,腎小管上皮細胞漿及細胞核逐漸呈現紫紅色,腎小管變形逐漸加重,腎小管上皮細胞逐漸萎縮、變性、壞死。見圖1~4。
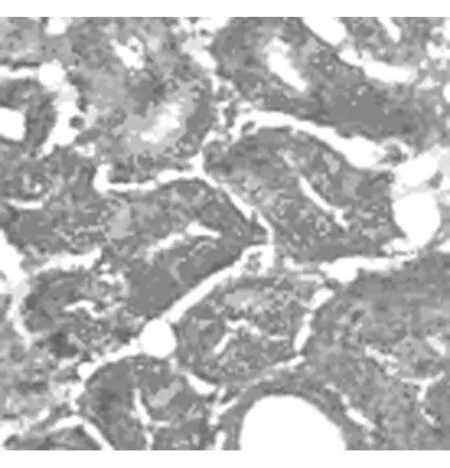
圖1 正常腎組織(10×40)
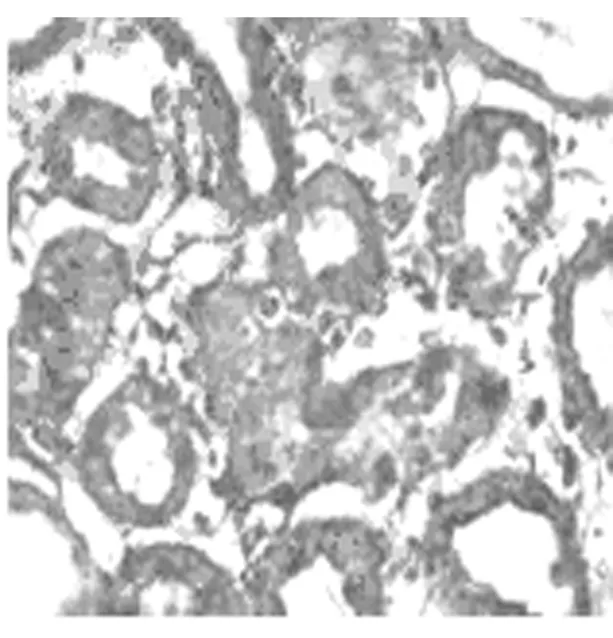
圖2 UUO組3d(10×40)
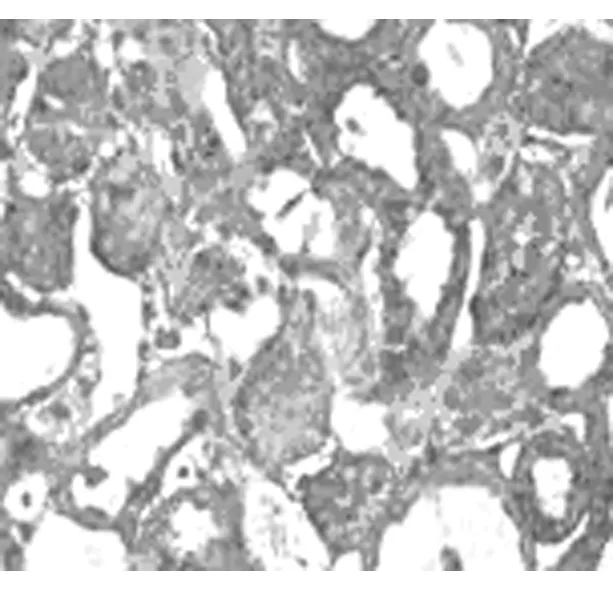
圖3 UUO組7d(10×40)
圖4 UUO組14d(10×40)
2.3 免疫組化
2.3.1 三組實驗大鼠TGF-β1在腎組織的表達
鏡下觀察,Sham組各時間點TGF-β1幾乎不表達,腎小管上皮細胞中無棕黃色顆粒,與Sham組相比,UUO組TGF-β1高表達,腎小管上皮細胞中可見較多棕黃色顆粒,且梗阻時間越長,棕黃色顆粒越多,差異有統計學意義(P<0.05);與UUO組大鼠對應時間點相比,福辛普利治療組TGF-β1表達減少,腎小管上皮細胞棕黃色顆粒減少,差異有統計學意義(P<0.05)。
2.3.2 三組實驗大鼠腎組織Smad3的表達
鏡下觀察,Sham組大鼠腎組織內各時間點Smad3僅呈現微量表達,腎小管上皮細胞中未見明顯棕色顆粒;UUO組大鼠各時間點腎組織Smad3表達較Sham組增加明顯,且隨著梗阻時間的增加棕色顆粒逐漸增多,差異具有統計學意義(P<0.05);與UUO組相較,福辛普利組對應時間點內Smad3表達量降低,差異有統計學意義(P<0.05)。見表2。

表2 各組大鼠腎組織TGF-β1、Smad3表達情況
3 討論
福辛普利作為第一個含磷的血管緊張素(AngⅡ)轉換酶抑制劑,臨床上主要用于治療慢性高血壓及心力衰竭,有研究表明,血管緊張素轉換酶參與高血壓腎臟損害及腎臟纖維化的全過程,在腎臟疾病的進展中起重要作用,通過阻斷血管緊張素轉換酶,降低血漿和組織中AngⅡ的生成,下調TGF-β1,調節基質金屬蛋白酶(MMPs)/基質金屬蛋白酶特異性抑制物(TIMPs)系統,減輕腎間質纖維化程度。TGF-β是一種具有多種功能及生物學活性的細胞因子,在炎癥反應調控中發揮著重要作用[5]。其中TGF-β1在腎臟中高表達,TGF-β1/Smad3信號通路是腎纖維化中最主要的激活及調控通路,TGF-β1與細胞受體結合后活化Smad3,通過核膜進入核內直接與DNA結合實現促纖維化的作用[6]。在體外培養小鼠腎細胞的試驗中發現,Klotho蛋白能夠減弱TGF-β1誘導的上皮-間質表型轉化,抑制TGF-β1誘導的靶基因活化及Smad3磷酸化,減輕腎纖維化;本實驗研究結果顯示,在UUO組,TGF-β1/Smad表達上調,福辛普利組TGF-β1/Smad表達下調,考慮福辛普利可能通過抑制TGF-β1∕Smad3通路的表達,發揮抗腎間質纖維化的作用,既往有研究表明,Klotho蛋白可以抑制腎血管鈣化、抗氧化應急和抑制腎臟纖維化,但是具體機制尚不詳盡,國內外研究較少,結合本實驗研究結果,可以再今后的實驗中加入對Klotho的研究,可能為腎纖維化的臨床治療及研究提供新的作用靶點及理論依據。

