扶正通絡解毒湯對急性心肌梗死大鼠心肌組織內游離鈣離子濃度、MMP-9、MDA及SOD的影響?
范才清 陳 姚 張 帆 蒲建璐
(四川大學華西醫院,四川 成都 610000)
急性心肌梗死(AMI)是患者冠狀動脈出現供血不足或中斷供血情況,導致心肌組織持續性處于缺血缺氧狀態進而引發心肌壞死性病變[1]。國內外研究表明,除心功能降低外,AMI患者在病理上還表現為心肌組織鈣穩態失調、心室重構和氧自由基生成。上述病理表現涉及多項觀察指標,如心肌游離鈣、基質金屬蛋白酶-9(MMP-9)、丙二醛(MDA)、超氧化物歧化酶(SOD)[2-3]。研究上述指標的變化趨勢,對于揭示AMI發病機制、評估療效、為AMI治療提供新的方向具有積極意義。在中醫理論中,AMI屬于“卒心痛”范疇,心脈瘀阻、心氣內虛是本病的病因病機[4]。中藥方劑扶正通絡解毒湯由黃芪、丹參、水蛭、黃連、當歸等中藥材組成,具有通絡解毒、益氣活血的功效[5],可針對AMI病因病機對癥治療,取得顯著療效,但目前尚缺少中藥治療AMI與西醫理論中心肌組織鈣穩態失調、心室重構和氧自由基生成調節關系的動物實驗和臨床研究[6]。本研究通過動物實驗的方式探討了扶正通絡解毒湯對AMI大鼠模型血清MMP-9、MDA、SOD活性及心肌組織內游離鈣離子濃度的影響及相關作用機制,現報告如下。
1 材料與方法
1.1 實驗動物 選取60只健康的無特定病原體(SPF)級SD大鼠,均為雄性,體質量200~300 g,周齡10~12周,實驗前體檢身體健康、活動正常、心臟功能和心電圖譜正常,預計生存期大于6個月,由上海劍鈍生物科技有限公司提供,合格證號為SCXK(滬):2019-0013。AMI大鼠模型構建、飼養和后續動物實驗均與上海劍鈍生物科技有限公司合作完成。造模前籠養大鼠7 d適應環境,飼養溫度(22±2)℃,濕度(60±10)%,飲用水為純凈水,飼料符合GB14924.3-2010標準,實驗周期4~6周,嚴格按國家實驗動物管理法規進行實驗。
1.2 實驗藥物 扶正通絡解毒湯(組成:黃芪、銀耳各30 g,丹參、生地黃、梔子、白芍各15 g,麥冬12 g,柴胡、紅花、川芎、當歸、連翹、檀香、金銀花各10 g,水蛭、黃連各6 g,甘草7 g。藥材由成都中醫藥大學醫技所大藥房提供,將上述藥材浸泡后用400 mL水煎煮沸,去渣取藥汁,繼續煎煮濃縮至原液質量濃度為2 g/mL)。鹽酸地爾硫片(合心爽,天津田邊制藥有限公司,國藥準字H12020126),0.9%氯化鈉溶液(青島日水生物,10801-1),克賽依諾肝素鈉注射液(NOFI WIN?THROP INDUSTRIE,規格0.6 mL∶6 000 A×aIU,2支)。
1.3 試劑與儀器 PBS緩沖液(上海鼓臣生物技術有限公司)、戊巴比妥鈉(上海信裕生物科技有限公司)、大鼠血清MMP-9酶聯免疫吸附(ELISA)檢測試劑盒(上海美軒生物科技有限公司,MEXN-R0581)、SOD ELISA試劑盒(上海創祥生物)、MDA ELISA試劑盒(上海篤瑪生物科技有限公司)、組織鈣離子濃度比色法定量檢測試劑盒(杰美基因,GMS50097.2);大鼠血清CK-MB ELISA檢測試劑盒(濰坊祺翔生物科技有限公司,MB-6930)、大鼠cTnI ELISA檢測試劑盒(江西江藍純生物試劑有限公司,JLC14924)。BLS-X2獸用彩超機(徐州貝爾斯電子科技有限公司),ST-960多功能酶標儀(科華),6/0可吸收縫線(博達),D-16C臺式小型冷凍離心機(賽多利斯),BS124S電子分析天平(賽多利斯),LS-20ECG動物心電圖記錄分析儀(北京拜安吉科技有限公司),HX-101E小型動物呼吸機(成都秦盟科技有限公司),UV754N紫外分光光度儀(青島路博)。
1.4 分組與造模 見表1。采用隨機數字表法將60只SD大鼠分為造模組與假手術組,每組30只。造模組采用改良冠脈結扎手術法制作AMI大鼠模型,術前以2.5 mL/kg腹腔注射3%的戊巴比妥鈉溶液麻醉,大鼠肌腱反射消失后實施手術,取仰臥位,注射肝素鈉,鼠頸前區除毛、備皮,分離右頸部外靜脈和氣管,連接呼吸機,潮氣量6 mL/kg,吸氣∶呼氣比為1∶2,呼吸頻率80次/min,胸前取備皮,連接心電監護裝置(心電圖),沿著鎖骨中線做縱切口,剝離皮膚,L4~L5肋間鈍性分離肌層,開胸,剪開心包,輕壓胸廓,暴露心臟,在肺動脈圓錐、左心耳間,距冠狀動脈起始2~3 mm處用6/0縫線結扎左冠狀動脈前降支,此時大鼠左室前壁變白、心跳減弱,將心臟還納胸腔,關胸、縫合切口,術后1~5 min內大鼠心電圖Ⅱ導聯ST段弓背向上抬高≥0.1 mV或病理性Q波作為手術成功的標志。假手術組僅開胸,不給予冠脈結扎,術后2 h抽取鼠尾靜脈血測定CK-MB活性、cTnI濃度,造模組大鼠血清CK-MB活性比值及cTnI水平較假手術組升高,差異有統計學意義(P<0.05),證明造模成功。
表1 兩組大鼠術后2 h血清CK-MB比值及cTnI水平比較(±s)
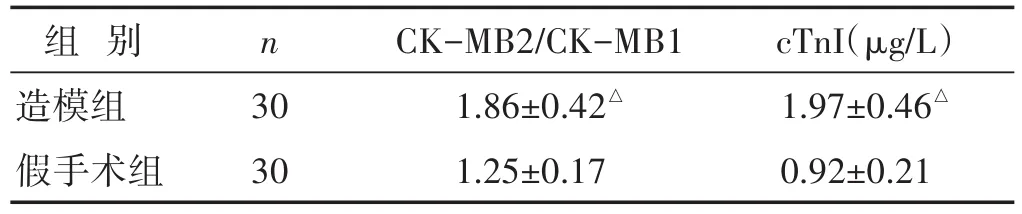
表1 兩組大鼠術后2 h血清CK-MB比值及cTnI水平比較(±s)
與假手術組比較,△P<0.05
組別造模組假手術組cTnI(μg/L)1.97±0.46△0.92±0.21 n 30 30 CK-MB2/CK-MB1 1.86±0.42△1.25±0.17
1.5 干預方法 采用隨機數表法將造模成功的30只AMI大鼠分為3組,各組10只,參照60 kg標準成人臨床用藥劑量,利用體表面積-劑量對應關系換算灌胃藥液劑量1 mL/100 g。中藥組予扶正通絡解毒湯:用0.9%氯化鈉溶液將扶正通絡解毒湯2 g/mL稀釋為1.4 g/mL,灌胃劑量為8 g/kg。西藥組予鹽酸地爾硫片溶液:將30 mg鹽酸地爾硫卓片研成粉末后,加0.9%氯化鈉溶液稀釋為0.75 g/L,灌胃劑量2.6 mg/kg。模型組給予等量的0.9%氯化鈉溶液灌胃。各組均在成模24 h后通過灌胃給藥,每天給藥1次,連續給藥7 d,期間檢測和比較3組大鼠相關指標水平。
1.6 標本采集與檢測 1)血清MDA、MMP-9濃度和SOD活性:在給藥前后抽取鼠尾靜脈血約1 mL置于不含熱原和內毒素的試管中,3 000 r/min離心10 min取上清液在2 h內完成檢測,不能在2 h內完成檢測的血清樣本及試劑盒均應保存在4℃環境中。檢測時利用96孔板上樣,每組待測血清樣本做3個復孔,按照ELI?SA檢測試劑盒說明書要求操作,主要步驟為:預處理→上樣(標準品、待測品稀釋液,平行樣本)→加帶有辣根過氧化物酶(HRP)標記的一抗→封孔,37℃孵育60 min→洗板(PBS緩沖液洗滌5次)→加二抗,封板,37℃避光孵育15 min→加顯色液、終止液→利用酶標儀測定各孔OD值。檢測方法為雙抗夾心法,利用酶標儀測定血清MDA、MMP-9和SOD吸光度,檢測波長450 nm,并利用標準曲線換算成濃度值和單位酶活值。2)比色法測定梗死區心肌游離鈣離子濃度:給藥第7日,在抽血完成后處死各組大鼠,通過手術取出大鼠心臟組織,在顯微鏡引導下將梗死區心肌剪成小塊,稱質量后用PBS溶液清洗,利用液氮冷凍并碾成粉末,加入裂解液后孵育30 min制成心肌細胞液,16 000 r/min離心5 min,取上清,按照檢測試劑盒說明書要求,利用比色法測定心肌游離鈣離子濃度,分光光度儀的檢測波長為570 nm。
1.7 統計學處理 應用SPSS23.0統計軟件。對研究資料之間進行對比分析,計量資料表示為()形式,組間兩兩配對比較采用t檢驗;計數資料(%)組間兩兩比較采取χ2檢驗;組內資料兩兩比較采取單因素方差分析,3組及以上資料比較則采取Z檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠血清MMP-9、MDA和SOD水平比較見表2。給藥7 d后,與給藥前相比,3組AMI大鼠的血清MMP-9、MDA濃度和SOD活性改善水平差異有統計學意義(P<0.05)。MMP-9、MDA濃度:中藥組<西藥組<模型組;SOD活性:中藥組>西藥組>模型組。
表2 各組大鼠干預前后血清MMP-9、MDA濃度及SOD活性比較(±s)
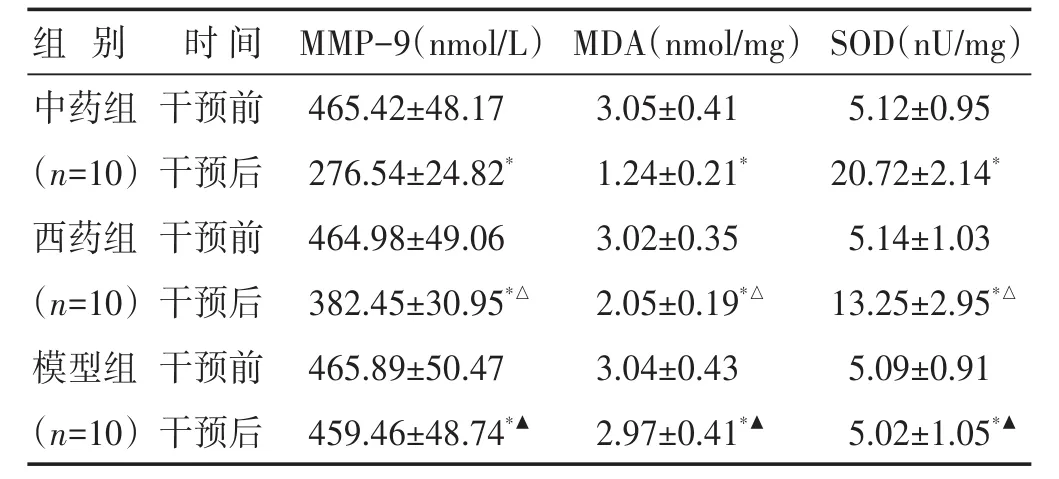
表2 各組大鼠干預前后血清MMP-9、MDA濃度及SOD活性比較(±s)
與本組干預前比較,?P<0.05;與中藥組同時期比較,△P<0.05;與西藥組同時期比較,▲P<0.05
組別中藥組(n=10)西藥組(n=10)模型組(n=10)時間干預前干預后干預前干預后干預前干預后MMP-9(nmol/L)465.42±48.17 276.54±24.82*464.98±49.06 382.45±30.95*△465.89±50.47 459.46±48.74*▲MDA(nmol/mg)3.05±0.41 1.24±0.21*3.02±0.35 2.05±0.19*△3.04±0.43 2.97±0.41*▲SOD(nU/mg)5.12±0.95 20.72±2.14*5.14±1.03 13.25±2.95*△5.09±0.91 5.02±1.05*▲
2.2 各組大鼠梗死區心肌組織內游離鈣離子濃度比較 見表3。給藥第7日,3組大鼠梗死區心肌組織內游離鈣離子濃度比較,差異有統計學意義(P<0.05):中藥組<西藥組<模型組。
表3 各組大鼠梗死區心肌組織內游離鈣離子濃度比較(nmol/L,±s)

表3 各組大鼠梗死區心肌組織內游離鈣離子濃度比較(nmol/L,±s)
與中藥組比較,?P<0.05;與西藥組比較,#P<0.05;與模型組比較,△P<0.05
組別中藥組西藥組模型組n 10 10 10梗死區心肌組織內游離鈣離子濃度159.62±9.74#△208.18±8.43*△321.82±15.19*#
3 討論
AMI是一種發病率、致死率和致殘率較高的心腦血管疾病。AMI病因的十分復雜,一般認為,冠動脈供血供氧不足是誘發AMI的主因[7],而國內外近年來的研究則指出,AMI的發生和進展還很有可能與下述原因有關。1)心肌細胞游離Ca2+負責調節心肌舒縮功能,其濃度水平也與心肌細胞興奮程度呈正相關,而AMI發生后患者心肌游離Ca2+出現超載,患者心臟收縮和舒張出現障礙,引發心力衰竭[8-9]。2)心肌組織持續性缺血缺氧會引發心室重構,心肌組織通過分泌MMPs來降解心肌膠原蛋白和基底膜,重塑心臟適應性。而研究也提示,此時患者血清中MMP-9的濃度較正常水平顯著升高[10-11]。(3)AMI發生后,患者大腦中氧自由基的產生明顯加快,此時SOD會因清除過多氧自由基而消耗,并產生大量生物毒性脂質過氧化物MDA,從而損傷患者腦細胞和神經細胞,引發腦梗死等不良反應[12]。西醫針對AMI成因和進展趨勢,采用鈣離子阻滯劑如硫氮酮等藥物治療,以抑制心肌鈣離子內流、擴張冠狀動脈血管、松弛心血管平滑肌[13],臨床研究結果顯示,應用硫氮酮治療AMI的有效率為60%~70%,對于室上性心動過速的療效優秀,高達88%~94%,對于心血管血氧供應改善十分顯著[14]。不過硫氮酮對于抗氧化指標和心室重構的影響少有文獻提及,也具有較多的不良反應和禁忌證,因此應探尋一種更為安全有效的AMI治療方案,以便獲得更理想的療效和預后[15]。
近年來,臨床越來越重視將中醫辨證論治或中西醫結合治療心血管疾病。中醫理論將AMI歸為“胸痹”“卒心痛”范疇,認為AMI的病機分為稟賦不足、瘀血阻心、痰瘀閉心、情志致郁、寒邪凝滯等。AMI患者的共同病證為心絡不通,雖原因各異,但均應活血散結、解毒通絡。中醫認為濁毒是炎癥因子、氧自由基,而鈣調紊亂、心室結構改變則是“阻絡”表現[16]。扶正解毒通絡湯方中含有丹參、黃芪、黃連、梔子、麥冬、水蛭等中藥材,從組方配伍上分析,丹參歸心、肝經,可活血祛瘀,通經止痛;黃芪可補益正氣;丹參、黃芪二者為君藥,主治胸痹心痛。水蛭可破血通經、黃連可清熱解毒,水蛭、黃連為臣藥,主治心經實熱。麥冬可潤肺清心、瀉熱生津;柴胡可和解表里,疏肝解郁,升陽舉陷;白芍可養血調經止痛,麥冬、白芍和柴胡均為佐藥,主治熱病心煩、胸脅脹痛。連翹、甘草為使,可清熱、解毒、散結、消腫、調和諸藥,主治心氣虛,心悸怔忡。基于動物實驗的現代藥理學也表明,扶正通絡解毒湯中的丹參酮ⅡA可顯著縮小心肌梗死范圍,復方丹參注射液則具有抗心肌缺血、減少心肌細胞膜的脂質過氧化反應、抑制Ca2+內流的功效;黃芪則富含多糖、皂苷類、黃酮類和氨基酸化學物質,黃芪總皂苷具有抗氧化、清除氧自由基等藥理作用,黃芪甲苷則具有舒張血管平滑肌、緩解肌漿網、保護腦細胞等藥理作用,可有效預防心室重構、保護心肌組織;其余中藥材則具有免疫調節、降血糖、降血壓、抗疲勞、抗炎等藥理作用[17],這些都是扶正解毒通絡湯治療AMI的理論基礎。
至今為止,雖有文獻對心肌細胞游離Ca2+、MMP-2、MMP-9和心肌抗氧化指標水平與AMI療效和預后的關系進行了研究,證實上述實驗室指標檢測結果與AMI患者的療效評估、轉歸預后具有關聯性,但仍缺少將中藥療效與心肌細胞游離Ca2+、MMP-2、MMP-9和心肌抗氧化指標聯系起來的研究[18]。本研究結果顯示,給藥后3組AMI模型大鼠的血清MMP-9、MDA濃度、SOD活性及梗死區心肌組織內游離鈣離子濃度比較差異有統計學意義(P<0.05)。結果表明扶正通絡解毒湯可促進AMI模型大鼠的MMP-9、MDA濃度和SOD單位活性水平的改善,也能降低缺血心肌組織內游離鈣離子濃度水平。這一結果值得進一步研究。

