迷走神經刺激對腦缺血再灌注大鼠磷酸腺苷活化蛋白激酶-沉默信息調節因子2相關酶1自噬通路的影響
魏海萍,郭佳,王歡,葛朝明
蘭州大學第二醫院神經內科,甘肅蘭州市 730030
腦卒中嚴重危害中老年人健康,但缺乏有效干預措施[1]。缺血半影區神經元自噬是缺血性腦卒中發生、發展的重要病理生理機制[2]。腦缺血發生時存在自噬[3],自噬可減輕缺血性腦卒中神經損傷[4],在腦缺血中發揮腦保護作用[5],也可加重腦缺血損傷[6]。迷走神經刺激(vagus nerve stimulation,VNS)已被廣泛應用于治療各種疾病[7],如改善抑郁小鼠癥狀[8]、癲癇、頭痛和阿爾茨海默病等[9-11],姜黃素聯合VNS 可減輕腦缺血再灌注損傷引起的行為障礙[12]。
調控腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)信號通路的自噬可改善認知障礙[13]。硒代蛋氨酸通過AMPK 激活下游哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR),從而激活皮層神經元自噬,改善阿爾茨海默病小鼠認知功能[14]。AMPK 激活需要α 亞基蘇氨酸(Threonine)172 位點磷酸化,通過活化AMPK/mTOR/Unc-51 樣自噬活化激酶信號通路可激活自噬[15]。
沉默信息調節因子2 相關酶1 (silent mating type information regulation 2 homolog 1,Sirt1)是一種重要的去乙酰化酶,在神經退行性疾病中保護神經元[16]。Sirt1 能與微管相關蛋白1 輕鏈3 (microtubule-associated protein 1 light chain 3,LC3)相互作用,在自噬泡形成階段起重要作用。Sirt1 的活化可正向調節AMPK,AMPK-Sirt1通路與認知障礙有關[17]。
本研究探討VNS在缺血性腦卒中大鼠缺血半影區細胞自噬中的作用及其分子機制。
1 材料與方法
1.1 實驗動物及造模
成年雄性SPF 級Sprague-Dawley 大鼠56 只,由蘭州大學實驗動物中心提供,分為正常組(n=14)、假手術組(n=14)、模型組(n=14)和VNS 組(n=14)。后兩組參照文獻[18-19]線栓法阻斷大腦中動脈(middle cerebral artery occlusion,MCAO) 1 h 再 灌 注。VNS 組 在 血流阻斷0.5 h 時,行左側VNS(因左側迷走神經發出支配心臟纖維少),實驗參數和操作參照文獻[20]。再灌注24 h后,行以下測試。
所有操作遵循動物福利與倫理原則。
1.2 Longa評分和TTC染色
各組取5 只,采用Longa 評分法[18]行神經缺損程度評估。
各組取4 只斷頭取腦,切5 片,TTC(美國SIGMA公司)染色,Image-pro plus軟件計算梗死體積。
1.3 Western blotting
各組取5 只大鼠腦缺血半影區腦組織,制備蛋白樣品,并進行凝膠電泳(上海江美生物科技有限公司)、轉膜,牛奶封閉,加抗Beclin-1、β-actin (PROTEINTECH 公司)、LC3、AMPK、P-AMPK(Thr172)、Sirt1(CST 公司)一抗體孵育,發光顯影曝光目的蛋白。stern blotting其他試劑由SIGMA公司提供。計算各條帶與正常組的光密度百分比。
1.4 統計學分析
采用SPSS 17.0 統計軟件行數據分析。結果以()表示,組間比較采用單因素方差分析,兩兩比較采用LDS檢驗。顯著性水平α=0.05。
2 結果
2.1 腦梗死體積
模型組和VNS 組明顯出現白色梗死區(圖1),與模型組相比,VNS組梗死區體積顯著減少(P<0.001)。見表1。
2.2 Longa評分
與假手術組相比,模型組和VNS 組Longa 評分明顯升高(P<0.01)。與模型組相比,VNS 組大鼠Longa評分下降(P<0.05)。見表2。
2.3 Western blotting
與假手術組相比,模型組和VNS 組Beclin-1、LC3-Ⅱ/LC3-I比、P-AMPK(Thr172)和Sirt1 蛋白表達顯著下降(P<0.001)。與模型組相比,VNS 組Beclin-1、LC3-Ⅱ/LC3-I比、P-AMPK(Thr172)和Sirt1 蛋白表達顯著升高(P<0.001)。見圖2、表3。
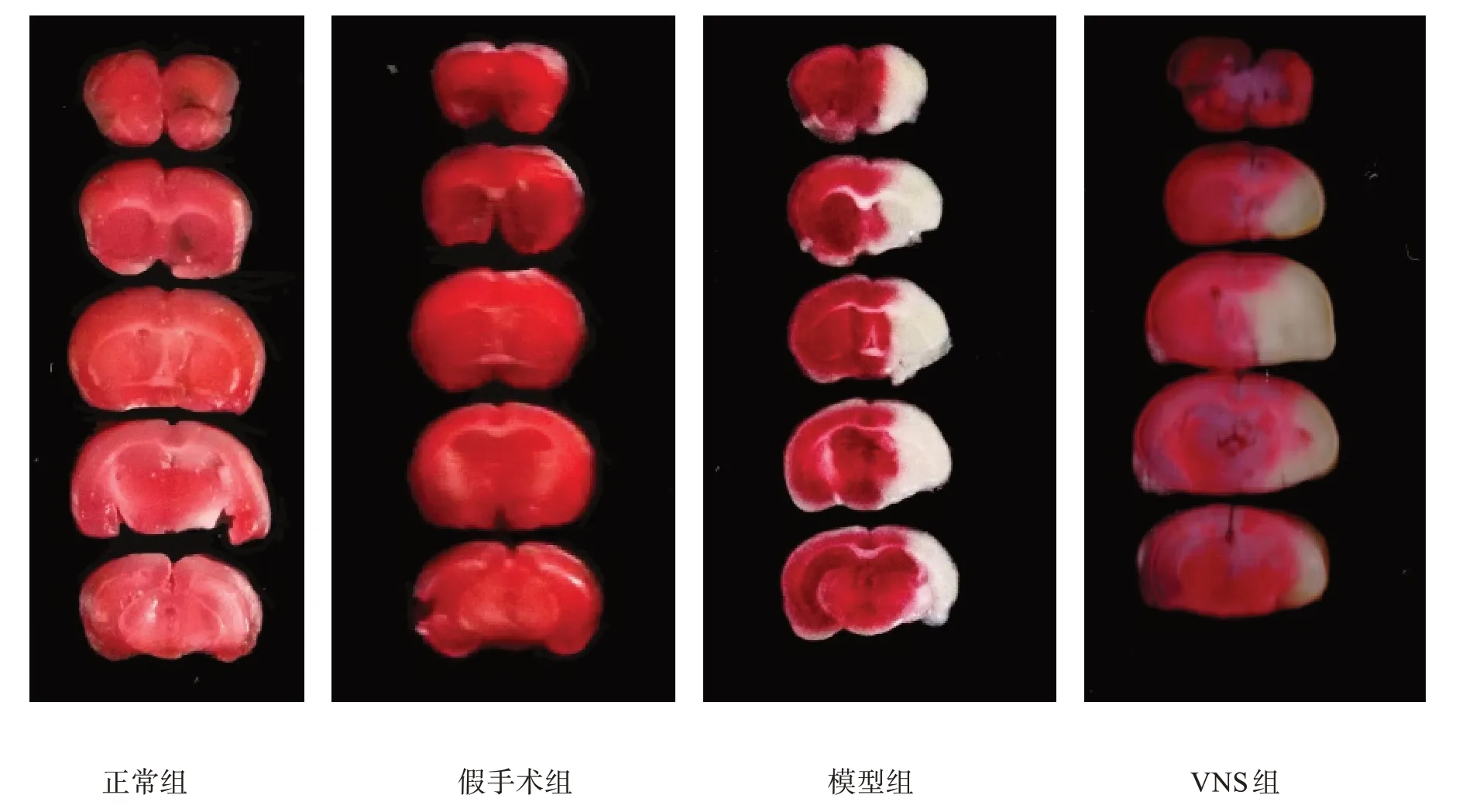
圖1 各組腦梗死體積(TTT染色)
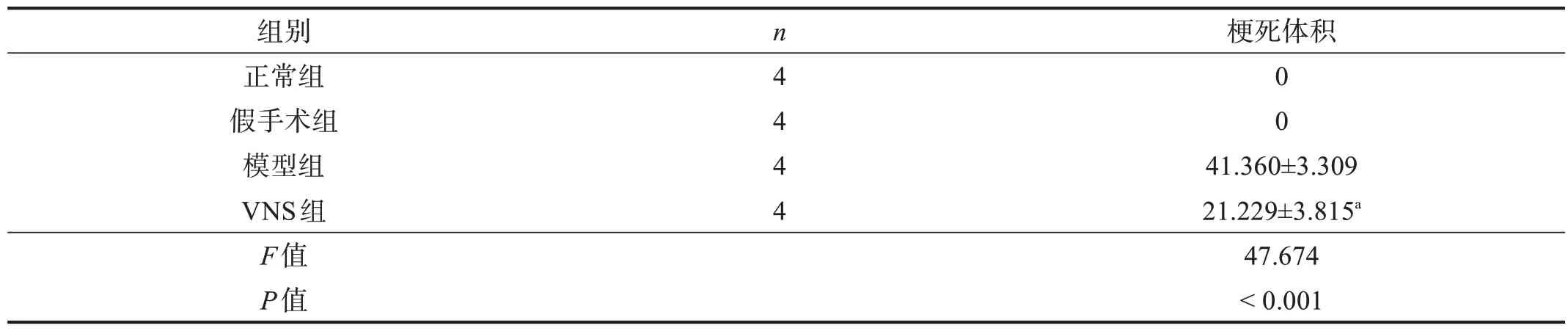
表1 各組腦梗死體積(%)
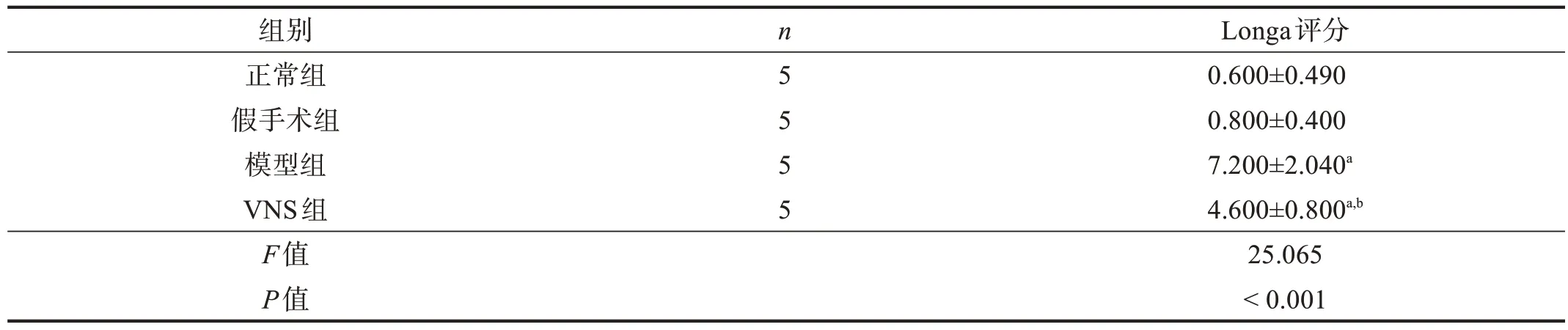
表2 各組大鼠Longa評分比較
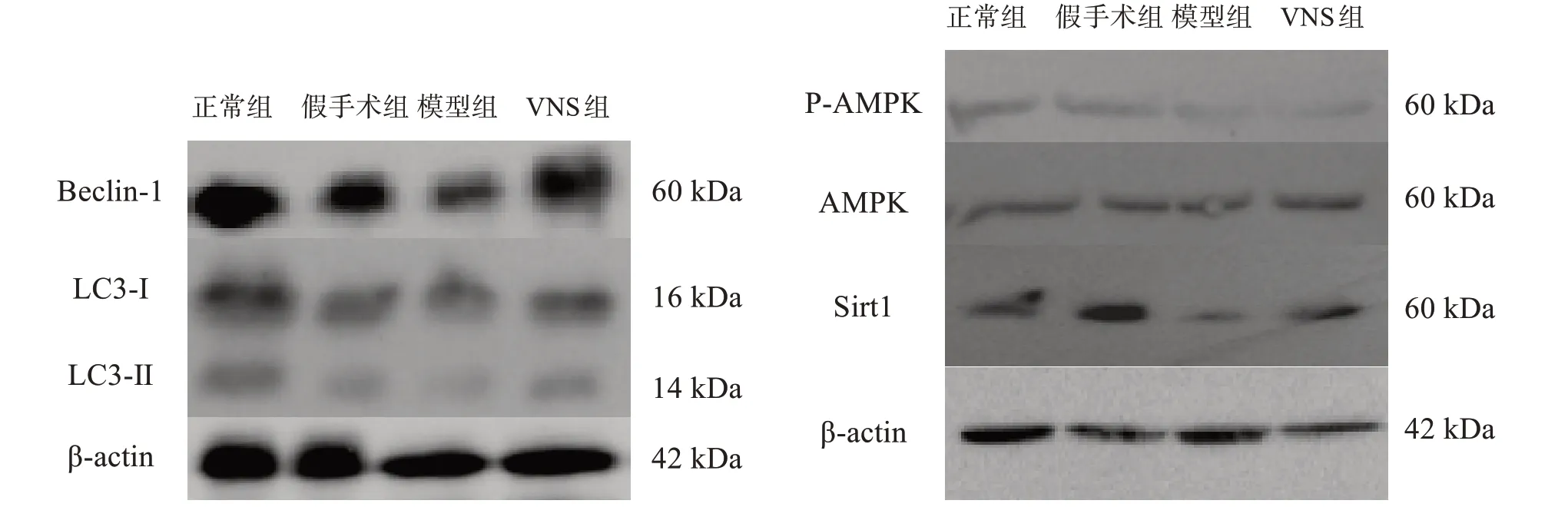
圖2 各組腦缺血半影區自噬相關蛋白表達(Western blotting)
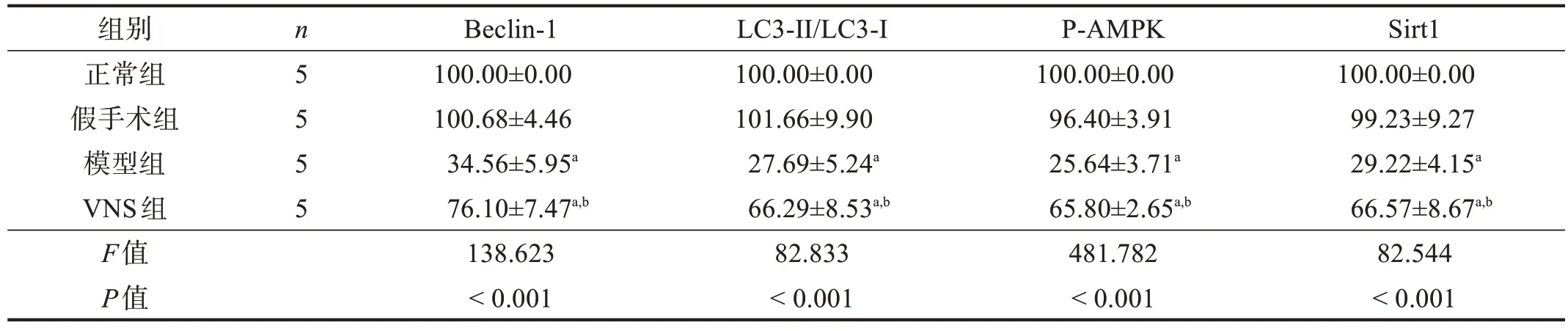
表3 各組腦缺血半影區自噬相關蛋白表達(%)
3 討論
減輕腦缺血后神經元損傷可改善缺血性腦卒中的預后[19]。本研究顯示,VNS 能減少大鼠腦梗死體積,減輕神經功能缺損,與以前報道VNS能減輕腦缺血損傷相符[20]。本研究還顯示,腦缺血后,半影區自噬水平下降,而VNS 能使自噬水平回升,可能與AMPK磷酸化水平和Sirt1蛋白水平回升有關。
在缺血性腦卒中復雜的缺血再灌注損傷過程中,自噬是一個連續更新的生理過程。自噬有雙刃劍作用[21]。自噬調控大多數在自噬誘導階段,其中AMPK通過調控mTOR 對自噬進行調節和反饋[22]。AktmTOR 通路屬于經典通路,激活Akt-mTOR 通路調節自噬水平,可實現腦保護作用[23]。Sirt1 是AMPK 下游靶蛋白[24]。VNS 通過激活AMPK-Sirt1 通路活化自噬,減少神經病理演變進程,改善由于急速血流阻斷引起的神經細胞壞死,發揮腦保護作用。然而,過度自噬將加重腦損傷[25]。VNS 通過激活自噬減輕腦缺血損傷的機制有待進一步研究。
綜上所述,VNS 可能通過調節AMPK-Sirt1 自噬通路,減輕大鼠缺血性腦損傷。但自噬是把雙刃劍,何種水平自噬有利于神經保護、VNS的具體參數與自噬水平的相關性、VNS 的介入時機等,尚需進一步研究。
利益沖突聲明:所有作者聲明不存在利益沖突。

