聚乙二醇修飾BaGdF5納米粒子的合成及胃腸道CT/磁共振雙模成像研究
崔鳳至 劉建華 劉洋 袁碧營 龔雪 袁慶海 弓婷婷 王雷
摘 要 分子影像在疾病診斷和預后評估,尤其在胃腸道相關疾病成像領域中發揮了重要作用,納米造影劑的設計合成與臨床應用已成為分子影像領域的研究熱點。本研究采用溶劑熱法制備了聚乙二醇修飾的BaGdF5納米粒子,并將其用于胃腸道計算機斷層掃描(CT)/磁共振(MR)雙模成像。此納米粒子的CT成像效果優于商用碘對比劑。此外,由于引入了Gd元素,此納米粒子可用于活體層面的MR成像研究。通過透射電子顯微鏡(TEM)、X-射線衍射儀(XRD)、紅外光譜(FT-IR)和熱重分析(TGA)等對聚乙二醇修飾BaGdF5納米粒子進行了表征。細胞MTT實驗與活-死細胞染色實驗等結果表明,合成的納米粒子具有極低的細胞毒性和優良的生物相容性;同時,溶血實驗結果表明,此納米粒子具有較高的血液相容性。基于蘇木精-伊紅(H&E)染色的病理學方法評估了小鼠給藥BaGdF5納米粒子后的體內長期毒性,結果表明,此納米粒子未造成上下消化道組織損傷,具有較高的生物安全性。BaGdF5納米粒子在胃腸道CT/MR雙模態成像研究中具有良好的應用前景。
關鍵詞 CT成像; 磁共振成像; 納米粒子; 造影劑
1 引 言
隨著現代醫學與納米技術的有機融合,分子影像成為當今醫學領域最具發展前景的技術之一,可實現對各種疾病的篩查、診斷及預后評估。造影劑的使用可以增加良性與惡性腫瘤組織之間及腫瘤與正常組織之間的對比度,從而獲得更清晰的組織影像,能夠為診斷提供更多信息,提高疾病的早期檢出率,促進精準醫療的發展[1]。在商用造影劑中,碘劑是最常用的臨床對比劑,然而其存在體內代謝速度快、易引發生過敏反應等缺點,限制了碘劑的廣泛應用[2,3]。近年來,生物醫用納米粒子因具有良好的膠體穩定性、粒子直徑小、體內循環代謝時間長和肝腎毒性小等優勢而備受關注[4~6]。研究表明,原子序數較大的元素具有較高的X射線吸收能力,可用于制備X射線成像和計算機斷層掃描(CT)成像造影劑。目前,基于稀土、鎢、鉭、金和鉍等金屬的CT造影劑已被廣泛研究,相關小分子與納米造影劑具有良好的組織對比增強能力,是理想的腫瘤靶向造影劑[7~10]。臨床上,磁共振成像(MRI)造影劑通常包括陽性造影劑和陰性造影劑,分別影響T1和T2的弛豫時間。陽性造影劑可縮短T1弛豫時間,磁共振信號增強,進而使圖像變亮; 而陰性造影劑能縮短T2弛豫時間,磁共振信號減弱,使MRI圖像變暗[11]。在臨床實際應用中,MRI陽性造影劑的增強成像由于可以極大地減少病灶出血的干擾而更為常用。相比單一模態成像,多模態成像綜合了多種成像模式的優點,可獲得更優質的影像和疾病診斷信息,因而得到廣泛應用。
根據2018年全球癌癥統計數據結果,隨著全球惡性腫瘤發病率及死亡率逐年增長,結直腸癌成為全球死亡率排名第二的惡性腫瘤,緊隨其后是胃癌,我國結直腸癌的發病率逐年上升,已位居全球第四[12]。早期診斷和及時治療是治療胃腸道惡性腫瘤的關鍵[13,14]。傳統醫學檢查方法包括消化道胃腸鏡檢查和氣-鋇雙重造影檢查。消化道胃腸鏡檢查是一種侵入性檢查技術,氣-鋇雙重造影檢查對胃腸道早期病灶顯示效果欠佳[15]; 此外,上述兩種檢查方法均不能準確測量腫瘤浸潤腸壁的深度,也無法評估對鄰近器官結構的侵犯程度。隨著各種成像方法的迅速發展和在醫學診療過程中的應用,MRI、CT、單光子發射計算機斷層掃描(SPECT)、超聲成像(US)、正電子發射計算機斷層掃描(PET)以及光學成像技術無創性檢查技術被廣泛用于胃腸道相關疾病的臨床診斷檢測[16,17]。研究表明,CT及MRI技術因具有虛擬內鏡及多種后處理技術,目前常用于胃腸道惡性腫瘤的診斷[18~21]。應用造影劑可清楚勾勒出病灶輪廓,更易分辨出正常組織與病灶之間的界線,評估病灶大小、形態、生長方式等,進而提高疾病診斷的精確度[22~25]。碘劑的X射線吸收能力有限,常需要通過加大造影劑的使用劑量提高成像效果,因此常伴隨因過量使用而引起的不良反應[26]。綜上,設計并合成具有高效成像能力,并適用于胃腸道成像的造影劑具有重要意義。
本研究采用一步溶劑熱法合成了聚乙二醇修飾BaGdF5納米粒子,將其作為胃腸道CT/MRI雙模造影劑應用于生物醫學成像。與碘劑相比,聚乙二醇BaGdF5納米粒子在相同使用濃度下具有更高的X射線吸收能力和更好的CT成像效果。由于引入了Gd元素,此納米造影劑可用于活體層面的T1加權MR成像。體內外長時間毒性實驗結果表明,聚乙二醇修飾BaGdF5納米粒子具有較高的生物兼容性和較低的細胞組織毒性。本研究為胃腸道造影劑的設計提供了思路,并為納米造影劑的臨床應用提供了理論和實踐基礎[27~31]。
2 實驗部分
2.1 儀器與試劑
JEOL JEM-2010EX透射電鏡(TEM,日本電子公司); D8 ADVANCE X-射線衍射儀(XRD,德國布魯克公司),應用Cu Kα 射線照射,其中λ=0.15406 nm; 電感耦合等離子體-發射光譜儀(美國賽默飛世爾公司); Perkin-Elmer TGA-2熱重分析儀(美國PE公司); 256層螺旋計算機斷層掃描儀(CT,荷蘭Philips公司); GE Discovery MR750 3.0T磁共振儀(MRI,美國GE公司)。
聚乙二醇(PEG-2000)、Gd(NO3)3·6H2O(美國西格瑪奧德里奇公司); 乙二醇(EG)、NH4F、BaCl2·2H2O(阿拉丁試劑有限公司)。所用試劑均為分析純,未經進一步純化直接使用。
2.2 實驗過程
2.2.1 聚乙二醇修飾BaGdF5納米粒子的合成 將Gd(NO3)3·6H2O(1 mmol)加入含有PEG-2000(1.5 g)的EG(20 mL)溶液中,持續攪拌。將BaCl2·2H2O (1 mmol)加入上述溶液中,隨后,加入含有NH4F(6 mmol)的EG(15 mL),并持續攪拌1.5 h。得到的反應混合物轉移到聚四氟乙烯內襯反應釜(50 mL)中, 200℃反應24 h,自然冷卻至室溫,將反應產物離心,用水和乙醇交替洗滌,冷凍干燥后,密閉保存。
2.2.2 細胞培養 Hela細胞(人宮頸癌細胞)由美國菌種保藏中心(ATCC)提供。細胞于37℃、 5% CO2的條件下, 在改良Eagle培養基(DMEM,含10% 胎牛血清(FBS))中培養。
2.2.3 細胞毒性實驗
通過3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)實驗測定聚乙二醇修飾BaGdF5納米粒子的細胞毒性。將分散均勻的Hela細胞以每孔5×104 個細胞的密度接種于96孔細胞培養板中,培養12 h保證細胞貼壁。去除培養液,將細胞清洗2次,置于不同濃度的納米粒子中繼續培養24 h,去除培養基內的納米粒子,加入MTT繼續培養4 h,隨后加入DMSO溶解藍紫色結晶甲瓚。測量各孔吸收值,計算細胞存活率。此外,分散的Hela細胞以每孔105個細胞的密度置于6孔細胞培養板中培養,12 h后,加入不同濃度的納米粒子繼續培養24 h,以鈣黃綠素AM(calcein AM)和碘化丙啶(PI)進行染色,檢測納米粒子對細胞的毒性。
2.2.4 血液兼容性評估 EDTA穩定的人血標本來自當地醫院的志愿者,均知情同意。將1 mL血樣加入2 mL磷酸鹽緩沖液(PBS)中,以5000 r/min離心10 min,從血清中分離出紅細胞,用5 mL PBS洗滌3次后,用PBS稀釋至其體積的1/10。將0.8 mL PBS與0.2 mL稀釋的紅細胞懸液混合,記為陰性對照,陽性對照為0.8 mL純水,與0.8 mL納米粒子懸液混合,作為測試樣本,上述混合物置于搖床上孵育3 h。最后,將混合物以5000 r/min離心5 min,用紫外-可見光分光光度計測定上述各組清液在541 nm處的吸光度。紅細胞溶血百分按下式計算:
溶血百分率(%)=[(樣品吸光度-陰性對照吸光度)/(陽性對照吸光度-陰性對照吸光度)]×100%。
2.2.5 動物實驗 本研究所涉及的所有動物實驗均通過倫理委員會審批,昆明小鼠和Wiser大鼠購于吉林大學實驗動物中心。
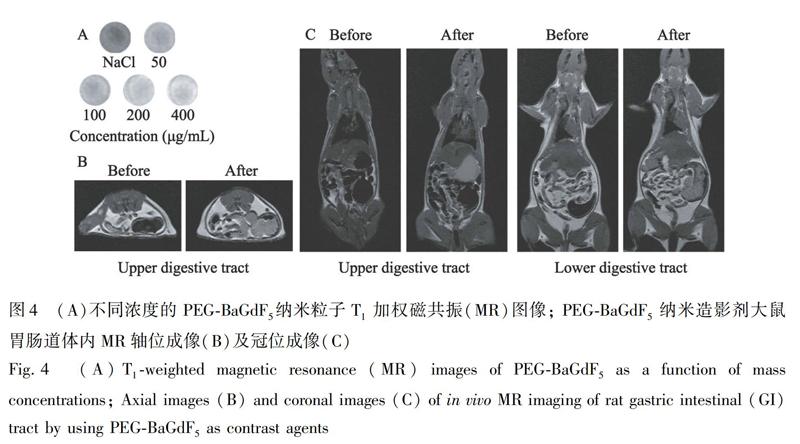
2.2.6 MR成像 采用磁共振儀掃描獲取體內及體外T1加權MR圖像。將不同濃度的納米粒子和0.9% NaCl溶液(生理鹽水)封裝于EP管中,其中,生理鹽水作為空白對照,隨后用3.0T核磁共振儀進行掃描。為了獲得體內成像效果,需要將Wiser大鼠禁食12 h。實驗前,大鼠腹腔注射10%水合氯醛,將其麻醉。胃內灌注含有納米粒子的生理鹽水(0.4 mg/mL)以獲得胃部MR圖像。將含有納米粒子的生理鹽水通過肛門灌注,以獲取低位腸管的MR圖像。T1加權MR成像參數如下:重復時間(TR),3000 ms; 回波時間(TE),104.6 ms; 掃描野(FOV), 200 mm×200 mm; 層厚, 2.0 mm。
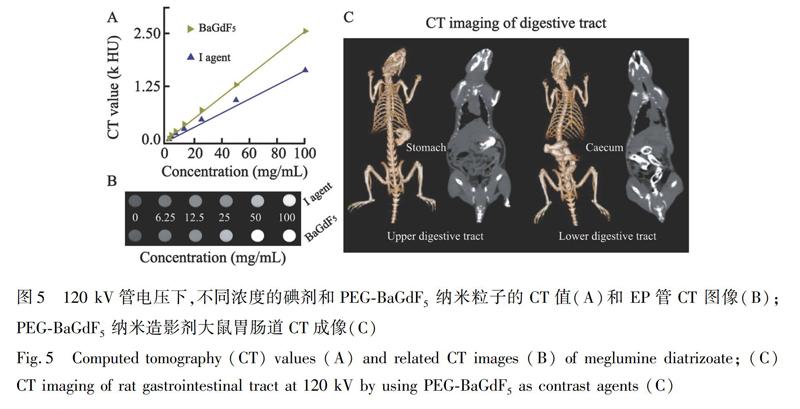
2.2.7 CT成像 為評估體內及體外的CT成像效果,將不同濃度的納米粒子、碘劑分別溶解于生理鹽水,并封裝于EP管中,隨后進行CT掃描。實驗前,Wiser大鼠需禁食 12 h,使用10%水合氯醛進行腹腔麻醉。口服或肛門灌注含有納米粒子的生理鹽水(40 mg/mL)獲取胃腸道CT圖像。CT掃描參數:層厚0.9 mm,螺距0.99,管電壓120 kVp,管電流300 mA,掃描野(FOV)350 mm,通過后處理重建獲得胃腸道矢狀位圖像及三維圖像。
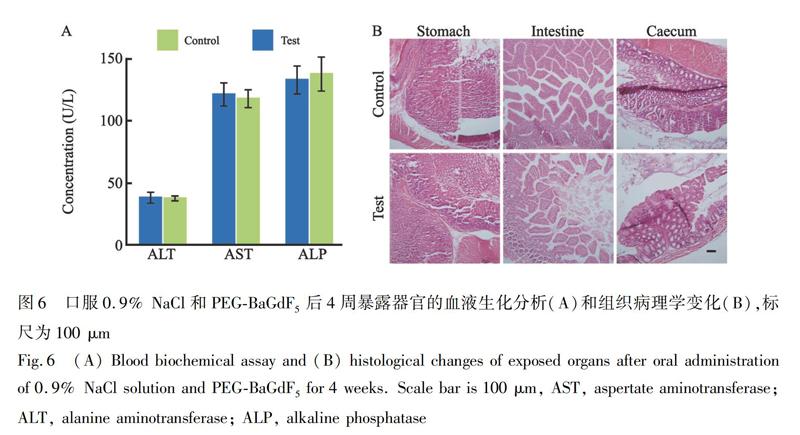
2.2.8 長期毒性 將體重約25 g的昆明小鼠分為對照組和實驗組,每組6只。實驗組小鼠單次口服納米粒子懸濁液(100 mg/只),對照組小鼠予以1 mL生理鹽水。觀察小鼠行為4周,記錄其行為。 隨后分別處死實驗組和對照組小鼠,取出包括胃、腸、盲腸在內的小鼠消化系統主要受影響的器官,用10%福爾馬林浸泡固定,石蠟包埋,將采集的樣本切成薄片,以獲取各組織病理圖像。
3 結果與討論
3.1 聚乙二醇修飾BaGdF5納米粒子的制備與表征
圖1A為BaGdF5納米粒子合成過程的示意圖。Gd(NO3)3·6H2O、BaCl2·2H2O和NH4F分別提供Ba、Gd、F元素,聚乙二醇作為結構導向劑,通過溶劑熱法合成了聚乙二醇修飾BaGdF5納米粒子,此方法與層層組裝及配體交換修飾方法不同。有研究表明,聚乙二醇分子不僅可降低納米粒子之間的相互作用力,調節和控制納米粒子直徑大小,而且具有良好的生物相容性,在體內應用時,可顯著增加材料的穩定性[32]。由圖1B可見,合成的納米粒子呈近似球形,尺寸分布均勻; 高分辨透射電子顯微鏡(HR-TEM)測得納米粒子的晶格間距為0.21 nm,結果與納米粒子(220)晶格間距(圖1C)相一致。如圖1C右上角選擇性區域電子衍射(SAED)顯示,此納米粒子具有多晶體特征。應用廣角 X 射線衍射(XRD)對納米粒子的晶體結構進行測試,此納米粒子的衍射峰強度和峰位置與標準的BaGdF5(JCPDS:24-0098)完全匹配(圖2A),表明成功合成了晶體相BaGdF5。圖2B顯示聚乙二醇修飾BaGdF5納米粒子在溶液中的大小約為(12±4) nm。紅外光譜(FT-IR, 圖2C)證實了納米粒子表面成功修飾了聚乙二醇,而且在不同溶液中(PBS、FBS和DMEM中)可穩定存在,無粒子的聚集現象,具有良好的膠體穩定性。熱重分析(TGA)結果表明,納米粒子表面聚乙二醇含量約為10.94%。綜上,本研究成功合成了結晶化程度高的聚乙二醇修飾BaGdF5納米粒子。
3.2 體外毒性實驗
低毒性或無毒性是納米粒子作為造影劑用于臨床疾病診斷的基本條件,因此對聚乙二醇修飾BaGdF5納米粒子進行了毒性評估。采用MTT實驗考察納米粒子的細胞毒性。如圖3A所示,納米粒子的濃度高達1.0 mg/mL時,細胞的存活率>90%,說明所合成的納米粒子具有較低的細胞毒性。此外,濃度依賴的活-死細胞染色實驗同樣證實了此納米粒子良好的細胞兼容性(圖3B)。體外溶血實驗可系統地闡述納米粒子與血液細胞的相互作用[33]。如圖3C和3D所示,水處理的紅細胞樣品在541 nm處的吸收數值明顯高于納米粒子和PBS處理的樣品,當納米粒子濃度在0.03~1 mg/mL時,均未出現溶血現象,表明此納米粒子具有高的血液兼容性 [34]。上述結果表明,聚乙二醇修飾BaGdF5納米粒子具有良好的生物相容性。
3.3 胃腸道MR成像
MR成像技術具有無X線無輻射、非侵入性、較高的空間分辨力及較強的組織穿透力等優勢,是目前診斷疾病最常用的影像檢查技術之一[35]。如圖4A所示,通過MR成像掃描含有不同濃度的聚乙二醇修飾BaGdF5納米粒子溶液,獲得T1加權圖像。結果表明,此T1加權成像效果與濃度相關,隨著納米粒子濃度增加,樣品T1加權圖像灰度逐漸變亮,對比成像效果逐漸增強。在灌注此納米粒子前后,對Wister大鼠胃腸道行MR成像檢查,評估該納米粒子的體內成像效果。如圖4B和4C所示,與未注入納米粒子的大鼠相比,注入納米粒子后,大鼠胃、小腸及盲腸輪廓可清晰顯示,正常組織與病變之間密度的對比度增加,提高了對胃腸道相關疾病的檢出率,可進行定量及定性的影像診斷,降低漏診率及誤診率。聚乙二醇修飾BaGdF5納米粒子具有較好的T1加權MR成像效果,未來可作為口服陽性造影劑,用于疾病的臨床診斷[36]。
3.4 胃腸道CT成像
CT檢查技術具有掃描速度快、圖像質量高、多平面重建等優勢[37],已成為臨床檢測的常規技術。前期研究結果表明,高原子序數元素合成的納米粒子具有良好的CT成像效果[38,39],稀土元素釓的原子序數為64,大于碘元素的原子序數(53),因此,含釓元素造影劑的成像能力優于臨床常用碘元素造影劑。本研究選則不同濃度的納米粒子及碘溶液,在管電壓120 kV下進行掃描,通過比較納米粒子與碘劑CT值的差異評估二者的成像能力。如圖5A和5B所示,隨著樣品濃度增加,其強化程度逐漸增強,并呈線性依賴關系; 與碘對比劑相比,在相同濃度下,納米粒子的CT值高于碘劑的CT值。通過對Wister大鼠胃腸道灌注納米粒子懸濁液以進一步評估其體內成像效果。首先,將納米粒子分散在生理鹽水中,經口灌入大鼠胃腸道后進行CT掃描,結果如圖5C所示,由大鼠的冠狀位圖像中可見,胃及盲腸亮度明顯增加,表明納米粒子已進入胃腸道內,而未灌注納米粒子的大鼠胃腸道為黑色。三維重建圖像可以更清晰地顯示大鼠胃腸道結構。上述結果表明,聚乙二醇修飾BaGdF5納米粒子具有作為CT造影劑的潛力。
3.5 長期毒性
生物安全性是納米粒子作為造影劑的前提條件[40~44]。通過血液生化及病理實驗評估了聚乙二醇修飾BaGdF5納米粒子的毒性。將小鼠分為實驗組和對照組,分別口服生理鹽水和納米粒子懸濁液。連續觀察4周,所有小鼠均未發生行為和精神異常。堿性磷酸酶(ALP)、谷草轉氨酶(AST)和谷丙轉氨酶(ALT)的血液生化指標檢測結果(圖6A)表明,灌注納米粒子后,小鼠的肝功能指標均未見明顯損傷。將兩組小鼠處死,并對主要臟器進行病理學評估。如圖6B所示,實驗組胃、小腸、盲腸等消化器官的組織切片沒有出現異常的病理變化。上述研究結果表明,聚乙二醇修飾BaGdF5納米粒子未引起實驗動物肝臟生化功能及胃腸道組織損傷。
4 結 論
采用溶劑熱法制得均一的聚乙二醇修飾BaGdF5納米粒子,并將其應用于胃腸道成像。體內外毒性實驗結果表明,此納米粒子具有優良的生物相容性和較低的細胞毒性,實驗小鼠口服灌注后,不影響血液生化指標,并且未對主要暴露器官造成傷害。與臨床常用的碘劑相比,相同質量濃度下,此納米粒子具有更好的CT成像效果。結合MR技術的多模態成像,此納米粒子有望發展為高性能納米造影劑,具有廣闊的生物醫用前景。
References
1 Faraji H, Nedaeinia R, Nourmohammadi E, Malaekeh-Nikouei B, Sadeghnia H R, Ziapour S P, Sarkarizi H K, Oskuee R K. J. Nano Res., 2018, 53: 22-36
2 Khademi S, Sarkar S, Shakeri-Zadeh A, Attaran N, Kharrazi S, Ay M R, Ghadiri H. Mater. Sci. Eng. C, 2018, 89: 182-193
3 Spinelli A, Girelli M, Arosio D, Polito L, Podini P, Martino G, Seneci P, Muzio L, Menegon A. J. Nanobiotechnol., 2019, 17: 49
4 Tian X, Liu S, Zhu J, Qian Z, Bai L, Pan Y. Nanotechnology,? 2019, 30(3): 032002
5 Saleh K A, Aldulmani S A A, Awwad NS, Ibrahium H A, Asiri TH, Hamdy M S. BMC Chem., 2019, 13: 8
6 LIU Jian-Hua, WANG Lei, ZHANG Tian-Qi, WANG Jian-Qiu, GONG Xue, CUI Feng-Zhi, ZHENG Jian-Jun, LI Bo, SHI Zhan. Chinese J. Anal. Chem, 2019, 47(5): 678-685
劉建華, 王 雷, 張天琪, 王建秋, 龔 雪, 崔鳳至, 鄭建軍, 李 波, 施 展. 分析化學, 2019, 47(5): 678-685
7 Lusic H, Grinstaff M W. Chem. Rev., 2013, 113(3): 1641-1666
8 Tsvirkun D, Ben-Nun Y, Merquiol E, Zlotver I, Meir K, Weiss-Sadan T, Matok I, Popovtzer R, Blum G. J. Am. Chem. Soc., 2018, 140(38): 12010-12020
9 Zhang P, Cui Y, Anderson C F, Zhang C, Li Y, Wang R, Cui H. Chem. Soc. Rev., 2018, 47(10): 3490-3529
10 Ai K, Liu Y, Liu J, Yuan Q, He Y, Lu L. Adv. Mater., 2011,? 23(42): 4886-4891
11 Zhou Z, Lu Z R. Wiley. Interdiscip. Rev. Nanomed. Nanobiotechnol., 2013, 5(1): 1-18
12 Bray F, Ferlay J, Soerjomataram I, Siegel R L, Torre L A, Jemal A. CA Cancer J. Clin., 2018, 68(6): 394-424
13 Singh R, Dumlupinar G, Andersson-Engels S, Melgar S. Int. J. Nanomed., 2019, 14: 1027-1038
14 Kaur H, Singh J, Narasimhan B. BMC Chem., 2019, 13(1): 49
15 Frkjaer J B, Drewes A M, Gregersen H. World J. Gastroenterol., 2009, 15(2): 160-168
16 Esposito F, Di Serafino M, Mercogliano C, Ferrara D, Vezzali N, Di Nardo G, Martemucci L, Vallone G, Zeccolini M. J. Ultrasound., 2019, 22: 409-422
17 Shin D, Rahimi H, Haroon S, Merritt A, Vemula A, Noronha A, LeBedis C A. Radiol. Clin. North. Am., 2020, 58(1): 19-44
18 Liu Y, Ai K, Lu L. Acc. Chem. Res.,? 2012, 45(10): 1817-1827
19 Wahsner J, Gale E M, Rodríguez-Rodríguez A, Caravan P. Chem. Rev., 2019, 119(2): 957-1057
20 Wang H, Zheng L, Peng C, Guo R, Shen M, Shi X, Zhang G. Biomaterials, 2011, 32(11): 2979-2988
21 Xing H, Bu W, Zhang S, Zheng X, Li M, Chen F, He Q, Zhou L, Peng W, Hua Y, Shi J. Biomaterials, 2012, 33: 1079-1089
22 Lee N, Choi S H, Hyeon T. Adv. Mater., 2013, 25(19): 2641-2660
23 Kobayashi H, Brechbiel M W. Adv. Drug Deliv. Rev., 2005, 57(15): 2271-2286
24 Liu Z, Ju E, Liu J, Du Y, Li Z, Yuan Q, Ren J, Qu X. Biomaterials, 2013, 34(30): 7444-7452
25 Levy A D, Remotti H E, Thompson W M, Sobin L H, Miettinen M. AJR Am. J. Roentgenol., 2003, 180(6): 1607-1612
26 Jun Y W, Lee J H, Cheon J. Angew. Chem. Int. Ed., 2008, 47(28): 5122-5135
27 LIU Jian-Hua, SHI Zhan, LI Bo, ZHANG Tian-Qi, CUI Feng-Zhi, YUAN Qing-Hai. Chem. J. Chinese Universities, 2018, 39(9): 1881-1885
劉建華, 施 展, 李 波, 張天琪, 崔鳳至, 袁慶海. 高等學校化學學報, 2018, 39(9): 1881-1885
28 Zhu W, Liang S, Wang J, Yang Z, Zhang L, Yuan T, Xu Z, Xu H, Li P. J. Mater. Sci. Mater. Med., 2017,? 28(5): 74
29 Xia A, Chen M, Gao Y, Wu D, Feng W, Li F. Biomaterials, 2012, 33(21): 5394-5405
30 Zeng S, Tsang M K, Chan C F, Wong K L, Hao J. Biomaterials, 2012, 33(36): 9232-9238
31 Cai J, Miao Y Q, Li L, Fan H M. Int. J. Mol. Sci., 2018,? 19(12): 4049
32 Xu L, Liu D, Chen D, Liu H, Yang J. Heliyon, 2019,? 5(1): e01165
33 de laHarpe K M, Kondiah P P D, Choonara Y E, Marimuthu T, du Toit L C, Pillay V. Cells, 2019, 8(10): 1209
34 Lin Y S, Haynes C L. J. Am. Chem. Soc., 2010, 132(13): 4834-4842
35 Wang L, Xu X, Mu X, Han Q, Liu J, Feng J, Zhang P, Yuan Q. Nanotechnology,? 2019,? 30(41): 415101
36 Ju K Y, Lee J W, Im G H, Lee S, Pyo J, Park S B, Lee J H, Lee J K. Biomacromolecules, 2013, 14(10): 3491-3497
37 Murray N, Darras K E, Walstra F E, Mohammed M F, McLaughlin P D, Nicolaou S. Radiographics, 2019, 39(1): 264-286
38 Liu Y, Ji X, Liu J, Tong W W L, Askhatova D, Shi J. Adv. Funct. Mater., 2017, 27(39): 1703261
39 Guo H, Zhao X, Sun H, Zhu H, Sun H. Nanotechnology,? 2019, 30(7):075101
40 Kumar R, Roy I, Ohulchanskky T Y, Vathy L A, Bergey E J, Sajjad M, Prasad P N. ACS Nano,? 2010, 4(2): 699-708
41 Cheng L, Yang K, Shao M, Lu X, Liu Z. Nanomedicine (Lond), 2011, 6(8): 1327-1340
42 Date AA, Hanes J, Ensign L M. J. Control. Release, 2016, 240: 504-526
43 Xiong L, Yang T, Yang Y, Xu C, Li F. Biomaterials, 2010, 31(27): 7078-7085
44 Yang K, Wan J, Zhang S, Zhang Y, Lee S T, Liu Z. ACS Nano, 2011, 5(1): 516-522
Synthesis of PEGylated BaGdF5 Nanoparticles as Efficient
CT/MRI Dual-modal Contrast Agents for Gastrointestinal Tract Imaging
CUI Feng-Zhi, LIU Jian-Hua, LIU Yang, YUAN Bi-Ying,
GONG Xue, YUAN Qing-Hai, GONG Ting-Ting*, WANG Lei*
(Department of Radiology, the Second Hospital of Jilin University, Changchun 130041, China)
Abstract Molecular imaging (MI) techniques have extremely significant effect on the diagnosis and prognosis of diseases, such as gastrointestinal (GI) tract-related diseases. Furthermore, nanomaterials as contrast agents have attracted a great deal of research attention due to their rational fabrication and biomedical application. Herein, a facile process to synthesis PEGylated BaGdF5 nanoparticles via a one-pot solvothermal route was reported as CT/MRI dual-modal contrast agents for in vivo imaging of GI tract. Compared to the commercially used iodine contrast agents, the well-prepared nanoparticles exhibited enhancement in computed tomography (CT) imaging. In the presence of Gd, nanoparticles could also be used in magnetic resonance imaging (MRI). PEGylated BaGdF5 nanoparticles were characterized by transmission electron microscopy (TEM), X-ray powder diffraction analysis (XRD), Fourier transform infrared (FT-IR) spectroscopy and thermogravimetric analysis (TGA). Besides, MTT assay revealed that the obtained PEGylated BaGdF5 nanoparticles proved to be low toxicity for Hela cells. Hemolytic assay illustrated that nanoparticles possessed favorable hemocompatibility. H & E histological staining assessed long-term toxicity of oral PEGylated BaGdF5 nanoparticles and the results showed that nanoparticles had overall safety for GI tissue with comparatively high biocompatibility. PEGylated BaGdF5 nanoparticles were admired multi-functional contrast agents to apply in CT and MRI imaging with prominent prospects.
Keywords Computed tomography imaging; Magnetic resonance imaging; Nanoparticles; Contrast agents
(Received 4 May 2020; accepted 12 June 2020)
This work was supported by the National Natural Science Foundation of China (No. 81571737).
2020-05-04收稿; 2020-06-12接受
本文系國家自然科學基金項目(No. 81571737)、吉林省科技廳自然科學基金項目(Nos. 20180101119JC,20190201218JC)、吉林省衛計委青年基金項目(No. 2017Q012)、吉林省財政廳衛生專項基金項目(Nos. 3D518V283429,2019SCE7025)和吉林大學大學生創新訓練計劃項目(No. 201910183592)資助
* E-mail: Wanglei_gy@sina.com; 369491837@qq.com

