枸杞子中甜菜堿含量測定方法的建立和提取方法的優化
黃鈺馨 馬玲 李苗 鄭國保 馬小榮


中圖分類號 R927.2 文獻標志碼 A 文章編號 1001-0408(2020)14-1700-04
DOI 10.6039/j.issn.1001-0408.2020.14.07
摘 要 目的:建立枸杞子中甜菜堿的含量測定方法,并優化其提取方法。方法:采用高效液相色譜法測定枸杞子中甜菜堿的含量,色譜柱為Waters Spherisorb NH2,流動相為乙腈-0.01 mol/L磷酸二氫鉀水溶液(75 ∶ 25,V/V),流速為0.7 mL/min,檢測波長為195 nm,柱溫為30 ℃,進樣量為10 μL。以甜菜堿含量為指標,在單因素試驗的基礎上,采用L9(34)正交試驗設計對枸杞子中甜菜堿超聲提取的甲醇體積分數、提取時間、料液比進行篩選并進行驗證。測定10批枸杞子中甜菜堿的含量,并與2015年版《中國藥典》收錄的薄層色譜法測定結果進行比較。結果:甜菜堿檢測質量濃度的線性范圍為2.035~2 035.04 μg/mL(R 2=0.999 3);檢測限、定量限分別為0.410、2.051 μg/mL,平均加樣回收率為97.41%~98.86%(RSD為0.8%~1.4%,n=3),精密度、重復性、穩定性(24 h)試驗的RSD均不大于1.2%。最優提取方法為料液比1 ∶ 30(g/mL)投料、甲醇超聲提取45 min。3次驗證試驗所得提取液中甜菜堿的平均含量為2.30%(RSD=0.43%, n=3)。10批枸杞子中甜菜堿的含量為1.91%~2.55%,與薄層色譜法的測定結果(1.88%~2.60%)無明顯差異(相對誤差為-1.92%~2.7%)。結論:成功建立了枸杞子中甜菜堿的含量測定方法,并優化了其提取工藝。
關鍵詞 枸杞子;甜菜堿;高效液相色譜法;含量測定;提取方法
Establishment of the Content Determination Method of Betaine in Lycium barbarum and Optimization of the Extraction Method
HUANG Yuxin1,MA Ling1,LI Miao2,ZHENG Guobao2,MA Xiaorong1(1. Ningxia Hui Autonomous Region Institute of Drug Control, Yinchuan 750002, China; 2. Agricultural Biotechnology Research Center of Ningxia Academy of Agricultural and Forestry Sciences, Yinchuan 750002, China)
ABSTRACT? ?OBJECTIVE: To establish the content determination method of betaine in Lycium barbarum, and to optimize the extraction method. METHODS:HPLC method was used to determine the content of betaine in L. barbarum. The determination was performed on Waters Spherisorb NH2 column with mobile phase consisted of acetonitrile-0.01 mol/L monopotassiun phosphate aqueous solution (75 ∶ 25, V/V) at the flow rate was 0.7 mL/min. The detection wavelength was 195 nm, and column temperature was 30 ℃. The sample size was 10 μL. Using the content of betaine as index, on the basis of single factor tests, L9(34) orthogonal test design were used to select the methanol volume fraction, extraction time and solid-liquid ratio of betaine in L. barbarum by ultrasonic extraction. The contents of betaine in 10 batches L. barbarum were determined, and compared with the results of TLC included in 2015 edition of Chinese Pharmacopeia. RESULTS: The linear range of betaine was 2.035-2 035.04 μg/mL(R2=0.999 3). The limits of detection and quantification were 0.410 μg/mL and 2.051 μg/mL, respectively. The average recovery were 97.41%-98.86% (RSDs were 0.8%-1.4%, n=3). RSDs of precision, reproducibility and stability (24 h) tests were not higher than 1.2%. The optimal extraction method included solid-liquid ration of 1 ∶ 30 (g/mL), ultrasonic extraction with methanol for 45 min. The average content of betaine in the extract from the three validation tests was 2.30% (RSD=0.43%, n=3). The contents of betaine in 10 batches L. barbarum were 1.91%-2.55%, which was no significantly different from the results of TLC (1.88%-2.60%)(RE were -1.92%-2.79%). CONCLUSIONS: The content determination method of betaine in L. barbarum was established successfully, and the extraction process was optinized.
KEYWORDS? ?Lycium barbarum; Betaine; HPLC; Content determination; Extraction method
枸杞子為茄科植物寧夏枸杞(Lycium barbarum L.)的干燥成熟果實[1],是我國傳統中藥材,具有治療糖尿病[2]、保護視網膜[3]、抗氧化[4]等作用。甜菜堿是枸杞果實、葉、柄中主要的生物堿類成分,在人體內起甲基供體的作用[5],具有促進脂肪代謝、調節滲透壓、抗應激等功效[6-8],被認為是枸杞子的主要活性物質之一[9]。目前,2015年版《中國藥典》(一部)記載的枸杞子中甜菜堿含量測定方法為薄層色譜法[1],該方法操作繁瑣、人為因素影響較大、靈敏度低、分離效果和重現性較差。高效液相色譜法(HPLC)作為一種現代分離分析技術,已被廣泛應用于中藥化學成分的分離分析和含量測定中[10-12]。已有研究報道,采用HPLC法測定甜菜堿提取物的含量,但多使用蒸發光散射檢測器,且柱前衍生等樣品處理和提取方法較為復雜[13-16],使得上述方法的精密度或準確性均受影響。在此基礎上,本研究建立了測定枸杞子中甜菜堿含量的HPLC法;并以甜菜堿含量為指標,采用單因素試驗和正交試驗對其提取方法進行了篩選;同時,將所建HPLC法與《中國藥典》方法進行了比較,旨在為枸杞子的質量控制和甜菜堿的提取提供方法支持。
1 材料
1.1 儀器
1260型HPLC儀(美國Agilent 公司);XS205DU型電子天平[梅特勒-托利多儀器(上海)有限公司];CQ- 200B-DST型超聲波清洗器(上海躍進醫用光學器械廠);800Y型粉碎機(永康市鉑歐五金制品有限公司)。
1.2 藥品與試劑
甜菜堿對照品(中國食品藥品檢定研究院,批號:110894-201604,純度:99.2%);10批枸杞子藥材(批號:NKY01~NKY10)采自寧夏銀川市賀蘭縣項目實驗基地,由寧夏農林科學院農業生物技術研究中心鄭國保副研究員鑒定為寧夏枸杞(L. barbarum L.)的成熟果實;甲醇、乙腈為色譜純,磷酸二氫鉀等其余試劑均為分析純,水為純化水。
2 方法與結果
2.1 甜菜堿含量測定方法的建立
2.1.1 對照品溶液制備
精密稱取甜菜堿對照品適量,置于15 mL量瓶中,加入甲醇溶解、稀釋并定容,制成質量濃度為5.087 6 mg/mL的對照品貯備液。精密量取上述對照品貯備液1 mL,置于5 mL量瓶中,用甲醇稀釋至刻度,搖勻,制成質量濃度為1 017.5 μg/mL的對照品溶液。
2.1.2 供試品溶液制備
取枸杞子樣品,于50 ℃烘干后,冷凍,粉碎,過二號篩,精密稱取粉末1.0 g,按一定方法提取后,用0.45 μm濾膜濾過,取續濾液作為供試品溶液。
2.1.3 色譜條件
色譜柱:Waters Spherisorb NH2(250 mm×4.6 mm,5 μm);流動相:乙腈-0.01 mol/L磷酸二氫鉀水溶液(75 ∶ 25,V/V);流速:0.7 mL/min;檢測波長:195 nm;柱溫:30 ℃;進樣量:10 μL。取對照品溶液、供試品溶液(批號:NKY01)和空白溶劑(甲醇)各適量,進樣測定,記錄色譜圖,詳見圖1。
2.1.4 標準曲線繪制
精密量取“2.1.1”項下對照品貯備液0.002、0.01、0.1、0.5、1.0、1.5、2.0 mL,分別置于5 mL量瓶中,加入甲醇稀釋至刻度,得系列工作溶液。按“2.1.3”項下色譜條件進樣測定,記錄峰面積。以甜菜堿的質量濃度(x,μg/mL)為橫坐標、峰面積(y)為縱坐標進行線性回歸,得回歸方程為y=2 848x+13.10(R 2=0.999 3),甜菜堿檢測質量濃度的線性范圍為2.035~2 035.04 μg/mL。
2.1.5 檢測限和定量限考察
精密量取“2.1.1”項下對照品貯備液適量,用甲醇逐級稀釋,分別以信噪比為3 ∶ 1、10 ∶ 1計算檢測限、定量限。結果,甜菜堿的檢測限為0.410 μg/mL,定量限為2.051 μg/mL。
2.1.6 精密度試驗
精密量取“2.1.1”項下質量濃度為1 017.5 μg/mL的對照品溶液適量,按“2.1.3”項下色譜條件連續進樣測定6次,記錄峰面積。結果,甜菜堿峰面積的RSD為0.5%(n=6),表明儀器精密度良好。
2.1.7 重復性試驗
精密稱取枸杞子樣品(批號:NKY01),共6份,按“2.1.2”項下方法制備供試品溶液,再按“2.1.3”項下色譜條件進樣測定,記錄峰面積,按外標法計算甜菜堿的含量。結果,甜菜堿含量的RSD為1.0%(n=6),表明該方法重復性良好。
2.1.8 穩定性試驗
精密量取“2.1.2”項下供試品溶液(批號:NKY01)適量,分別于室溫下放置0、4、8、12、16、20、24 h時按“2.1.3”項下色譜條件進樣測定,記錄峰面積。結果,甜菜堿峰面積的RSD為1.2%(n=7),表明供試品溶液在室溫下放置24 h內穩定性良好。
2.1.9 加樣回收率試驗
精密稱取已知含量的枸杞子樣品(批號:NKY01),粉碎,取粉末9份,置于具塞錐形瓶中,分別精密加入“2.1.1”項下對照品貯備液0.5、1.0、1.5 mL,按“2.1.2”項下方法制備供試品溶液,再按“2.1.3”項下色譜條件進樣測定,記錄峰面積并計算加樣回收率,結果見表1。
2.2 甜菜堿提取方法篩選
2.2.1 單因素試驗
(1)提取方法:精密稱取干燥后的枸杞子樣品(批號:NKY01)6份,每份1.0 g,分別置于具塞錐形瓶中,精密加入甲醇30 mL,稱定質量。取3份超聲(功率:250 W,頻率:33 kHz,下同)提取60 min,另外3份加熱回流提取60 min,均冷卻至室溫,再次稱定質量,用甲醇補足減失的質量,搖勻,用0.45 μm濾膜濾過,取續濾液,按“2.1.3”項下色譜條件進樣測定,記錄峰面積并按外標法計算甜菜堿含量。結果,超聲提取和加熱回流提取的提取液中甜菜堿的平均含量分別為2.20%和2.19%(n=3),兩種方法所得甜菜堿的含量相似。故綜合考慮實際操作和人為影響,最終選擇超聲提取作為枸杞子中甜菜堿的提取方法。
(2)提取溶劑:精密稱取干燥后的枸杞子樣品(批號:NKY01)7份,每份1.0 g,分別置于具塞錐形瓶中,精密加入甲醇、80%甲醇、70%甲醇、60%甲醇、50%甲醇、水和0.1 mol/L鹽酸溶液各30 mL,稱定質量,超聲處理40 min,冷卻至室溫,再次稱定質量,用相應提取溶劑補足減失的質量,搖勻,用0.45 μm濾膜濾過,取續濾液,按“2.1.3”項下色譜條件進樣測定,記錄峰面積并按外標法計算甜菜堿含量。結果,上述溶劑提取液中甜菜堿的含量分別為2.21%、2.10%、1.95%、1.82%、1.80%、1.51%、1.43%,其中含量較高的溶劑依次為甲醇、80%甲醇、70%甲醇。
(3)提取時間:精密稱取干燥后的枸杞子樣品(批號:NKY01)8份,每份1.0 g,分別置于具塞錐形瓶中,精密加入甲醇30 mL,稱定質量,分別超聲提取20、25、30、35、40、45、50、55 min,冷卻至室溫,再次稱定質量,用甲醇補足減失的質量,搖勻,用0.45 μm濾膜濾過,取續濾液,按“2.1.3”項下色譜條件進樣測定,記錄峰面積并按外標法計算甜菜堿含量。結果,上述提取時間提取液中甜菜堿的含量分別為1.68%、1.85%、2.02%、2.10%、2.13%、2.20%、2.21%、2.19%。可見,當提取時間超過45 min后,甜菜堿含量的變化不大。
(4)料液比:精密稱取干燥后的枸杞子樣品(批號:NKY01)5份,每份1.0 g,分別置于具塞錐形瓶中,精密加入甲醇10、20、30、40、50 mL,即料液比分別為1 ∶ 10、1 ∶ 20、1 ∶ 30、1 ∶ 40、1 ∶ 50(g/mL),稱定質量,超聲提取45 min,放至室溫,再次稱定質量,用甲醇補足減失的質量,搖勻,用0.45 μm濾膜濾過,取續濾液,按“2.1.3”項下色譜條件進樣測定,記錄峰面積并按外標法計算甜菜堿含量。結果,上述料液比提取液中甜菜堿含量分別為1.85%、1.92%、2.20%、2.21%、2.19%。可見,當料液比為1 ∶ 30、1 ∶ 40、1 ∶ 50時甜菜堿含量較高,且差異不大。
2.2.2 正交試驗
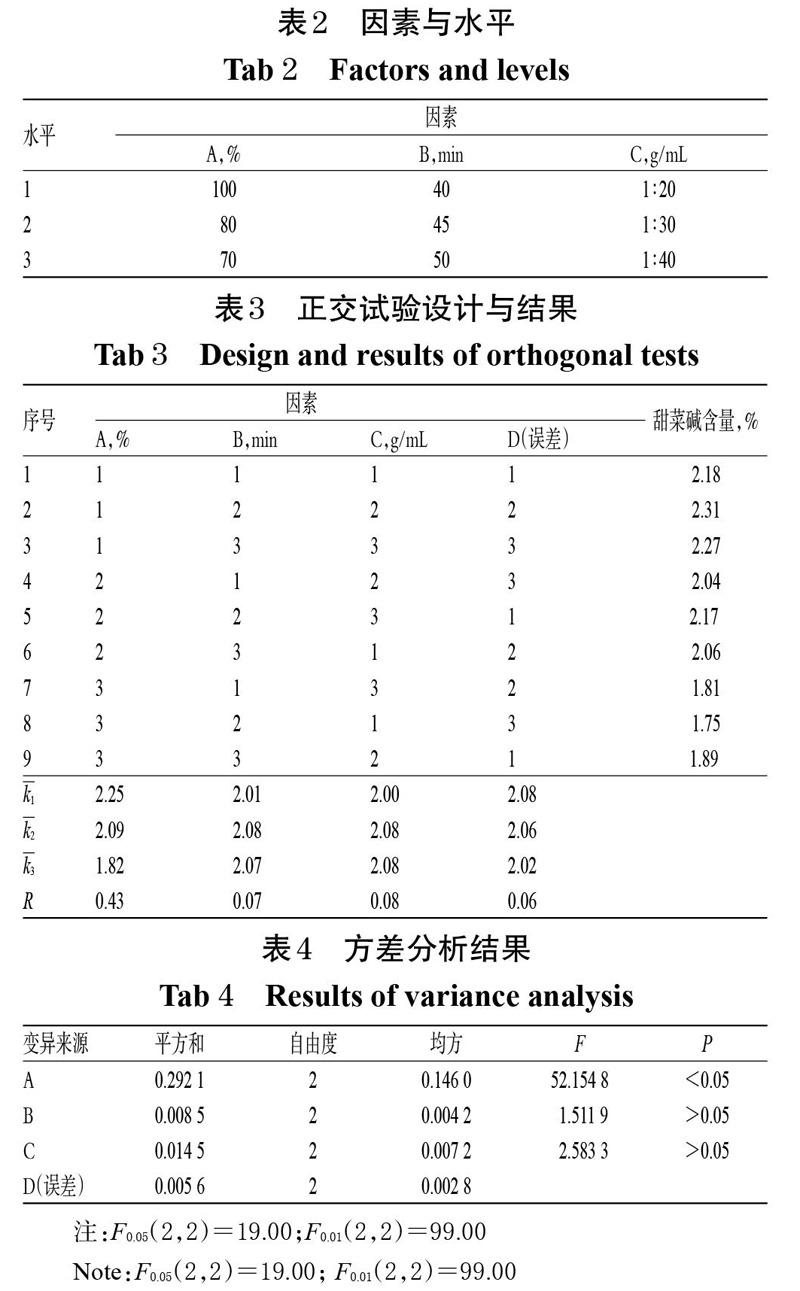
在單因素試驗結果的基礎上,以甲醇體積分數(A,%)、提取時間(B,min)、料液比(C,g/mL)為考察因素,甜菜堿含量為指標,采用L9(34)正交試驗設計對枸杞子中甜菜堿的提取方法進行優化。因素與水平見表2,正交試驗設計與結果見表3,方差分析結果見表4。
由表3結果可知,各因素對甜菜堿含量影響程度的排序為A>C>B,即甲醇體積分數>料液比>提取時間。由表4方差分析結果可知,甲醇體積分數對甜菜堿含量有顯著影響(P<0.05),提取時間和料液比對甜菜堿含量無顯著影響(P>0.05)。綜合考慮極差分析和方差分析結果,確定最優提取條件為A1B2C2,即以料液比1 ∶ 30投料,甲醇超聲提取45 min。
精密稱取枸杞子(批號:NKY01)1.0 g,共3份,按上述最優提取條件超聲提取甜菜堿,按“2.1”項下方法進樣測定,記錄峰面積并按外標法計算提取液中甜菜堿含量。結果,甜菜堿平均含量為2.30%(RSD=0.43%,n=3),表明此提取方法可行。
2.3 含量測定方法比較
分別取10批枸杞子樣品各1 g,按“2.2.2”項下最優提取方法提取,按“2.1.2”項下方法制備供試品溶液,再按“2.1.3”項下色譜條件進樣測定,記錄峰面積并按外標法計算甜菜堿含量;同時,按照2015年版《中國藥典》(一部)中收錄的薄層色譜法[1]測定供試品溶液中甜菜堿含量,結果見表5。由表5可見,兩種方法測定結果的相對誤差為-1.92%~2.79%,表明兩種方法測定結果幾乎無明顯差異。
3 討論
3.1 色譜條件的選擇
由于枸杞子中成分具有多樣性,將目標成分與其他成分有效分離是進行定量分析的關鍵。本課題組前期考察了不同色譜柱[Agilent Zorbax NH2色譜柱(150 mm×4.6 mm,5 μm)、Agilent Zorbax 300-SCXA色譜柱(250 mm×4.6 mm,5 μm)、Waters Spherisorb NH2色譜柱(250 mm×4.6 mm,5 μm)]、不同流動相比例(60 ∶ 40、70 ∶ 30、75 ∶ 25、80 ∶ 20,V/V)對甜菜堿分離的影響。結果,Waters Spherisorb NH2柱中甜菜堿色譜峰與其他成分色譜峰的分離效果優于其他色譜柱,且當乙腈-0.01mol/L磷酸二氫鉀水溶液的比例為75 ∶ 25(V/V)時,色譜峰之間分離效果較好。
3.2 浸潤提取法的考察
本研究在前期篩選提取方法時,還考察了浸潤提取法的提取效果,分別測定了浸潤20、25、30、35、40、45、50、55 min時同一批枸杞子(批號:NKY01)提取液中甜菜堿的含量。結果,上述提取時間的提取液中甜菜堿含量均低于2.00%,均較超聲提取法和加熱回流提取法的含量低,故未將該法列入單因素試驗。
綜上所述,本研究建立了甜菜堿含量測定的HPLC法,并通過單因素試驗和正交試驗篩選了枸杞子中甜菜堿的最佳提取方法,通過比較本研究所建HPLC法測定結果與《中國藥典》薄層色譜法測定結果的差異,發現幾乎無明顯差異。由此表明,本研究成功建立了枸杞子中甜菜堿的定量分析方法和提取方法,可為枸杞子中甜菜堿的含量測定提供方法支持。
參考文獻
[ 1 ] 國家藥典委員會.中華人民共和國藥典:一部[S].2015年版.北京:中國醫藥科技出版社,2015:249.
[ 2 ] LIND B,JIANG Y,WARK L,et al. Dietary wolfberry increases hepatic insulin sensitivity in obese mice[J]. FASEB J,2012,6(3):828-837.
[ 3 ] CHU PHW,LI HY,CHIN MP,et al. Effect of lyciumbarbarum(Wolfberry)polysaccharides on preserving retinal function after partial optic nerve transaction[J]. PLoS One,2013. DOI:10.1371/journal.pone.0081339.
[ 4 ] 武改梅,賈躍勝,袁世宏.枸杞抗癌的免疫藥理研究進展[J].中國藥房,2002,13(1):54-55.
[ 5 ] 史蓉,李婷婷,周麗,等.甘肅枸杞功能性物質及其功效研究綜述[J].甘肅農業科技,2019(9):81-86.
[ 6 ] 李炳龍,齊永秀,馬向忠,等.甜菜堿藥物分析進展[J].泰山醫學院學報,2008,29(3):238-240.
[ 7 ] 張宇金,高世勇,何立巍,甜菜堿的生物活性研究[J].哈爾濱商業大學學報(自然科學版),2006,22(1):13-16.
[ 8 ] 賀天雨,樂勝鋒,杜寧,等.液相色譜法在枸杞甜菜堿含量測定中的應用[J].食品安全質量檢測學報,2019,10(11):3444-3451.
[ 9 ] 謝忱,徐麗珍,李憲銘,等.枸杞子化學成分研究[J].中國中藥雜志,2001,26(5):323-324.
[10] 張怡,張宗山,王芳,等.高效液相色譜法測定阿維菌素在枸杞果實中的殘留動態[J].西北農業科技大學學報(自然科學版),2006,34(12):181-184.
[11] 翟雪蓓,武曉媛,徐曉陽,等.高效液相色譜測定中藥夏枯草活性成分含量[J].世界最新醫學信息文摘,2019,19(69):118.
[12] 鄢玉芬,徐雙美,梁乙川,等. HPLC法測定不同貯藏條件下川芎中10種化學成分的含量[J].中國藥房,2019,30(6):807-812.
[13] 盧艷婷.枸杞中甜菜堿的含量測定[J].食品安全導刊,2018(18):49-50.
[14] 梁景輝,賈芙蓉,時璐,李攀龍.HPLC-ELSD測定枸杞子中甜菜堿的含量[J].中國處方藥,2016,14(2):32-33.
[15] 谷大建,李旭. SPE-HPLC法測定枸杞中甜菜堿的含量[J].齊魯藥事,2007,4(12):213-214.
[16] 張自萍,郭榮,廖國玲,等.枸杞甜菜堿含量測定方法的比較研究[J].西北農業學報,2007,16(6):292-295.
(收稿日期:2020-03-20 修回日期:2020-06-04)
(編輯:鄒麗娟)

