香茅醇亞微乳的處方工藝優化研究
楊佳佳 李婉蓉 彭劍青 肖婷 吳林菁 周雪 楊增秋 姜豐 丁楊 沈祥春 陶玲
中圖分類號 R944.1 文獻標志碼 A 文章編號 1001-0408(2020)14-1704-07
DOI 10.6039/j.issn.1001-0408.2020.14.08
摘 要 目的:優化香茅醇亞微乳的制備工藝。方法:采用高效液相色譜法測定香茅醇亞微乳中的香茅醇含量;采用高速剪切分散-高壓均質法制備香茅醇亞微乳,以離心穩定常數(ke)、粒徑為指標,對其處方及工藝進行優化并進行驗證;測定所得制劑的載藥量的包封率。結果:香茅醇檢測質量濃度的線性范圍為4~64 μg/mL(R 2= 0.999 9);精密度、穩定性(24 h)、重復性試驗的RSD均小于3%;加樣回收率為97.64%~101.97%(RSD=2.28%,n=3)、97.71%~99.50%(RSD=1.29%,n=3)、96.87%~101.48%(RSD=2.86%,n=3)。最優處方為大豆油+中鏈甘油三酯(1 ∶ 1,g/g)總質量3.75 g,1.2%大豆磷脂0.6 g,膽固醇0.06 g,香茅醇1.25 g,0.6%油酸鈉0.3 g,15-羥基硬脂酸聚乙二醇酯0.75 g,泊洛沙姆188 0.75 g,加水至50 mL。最優工藝為于4 ℃下以13 000 r/min高速剪切5 min制得初乳后,經稀鹽酸調pH至7,再以600 Bar高壓均質5 min。按最優處方及工藝制備的3批香茅醇亞微乳的平均粒徑為(91.05±0.26)nm,多分散系數為(0.20±0.01),Zeta電位為(-30.86±0.39)mV,ke值為9.23,香茅醇的平均含量為(100.21±0.01)%;載藥量為(2.481 7±0.000 7)mg/mL,包封率為(99.27±0.03)%。結論:優化所得處方及工藝穩定、可行。
關鍵詞 香茅醇;亞微乳;高速剪切分散-高壓均質法;處方;工藝;優化;高效液相色譜法;含量
Study on Optimization of Formulation and Technology of Citronellol Submicroemulsion
YANG Jiajia1,LI Wanrong1,PENG Jianqing1,XIAO Ting1,WU Linjing1,ZHOU Xue1,YANG Zengqiu1,JIANG Feng1,DING Yang2,SHEN Xiangchun1,TAO Ling1(1. School of Pharmacy, Guizhou Medical University/Engineering Center for the Highly Efficient Utilization of Natural Medicine Resources in Guizhou Province/Key Lab for Pharmacology and Pharmacogenesis Evaluation of Natural Medicine in Guizhou Universities/Guizhou Medical University-Guiyang Joint Key Laboratory/Key Laboratory for Optimal Utilization of Natural Medicine Resources, Guiyang 550025, China; 2. Pharmaceutics Teaching and Research Section, China Pharmaceutical University/State Key Laboratory of Bioactive Substance and Function of Natural Medicines, Nanjing 210009, China)
ABSTRACT? ?OBJECTIVE: To optimize the preparation technology of citronellol submicroemulsion. METHODS: The content of citronellol in Citronellol submicroemulsion was determined by HPLC. Citronellol submicroemulsion by high-speed shearing dispersion-high pressure homogenization method, with centrifugation stability constant (ke) and particle size were used as evaluation indexes. Its formulation and preparation technology were optimized and validated. Drug-loading amount and encapsulation rate of the preparation were detected. RESULTS: The linear range of citronellol were 4-64 μg/mL (R 2=0.999 9). RSDs of precision, stability (24 h) and reproducibility tests were all lower than 3%. The recoveries were 97.64%-101.97%(RSD=2.28%,n=3), 97.71%-99.50%(RSD=1.29%,n=3), 96.87%-101.48%(RSD=2.86%,n=3). The optimal formulation included that total weight of soybean oil and medium chain triglycerides (1 ∶ 1,g/g) was 3.75 g, 1.2% soybean phospholipid was 0.6 g, cholesterol was 0.06 g, citronellol was 1.25 g, 0.6 % sodium oleate was 0.3 g, 15-hydroxystearic acid polyethylene glycol ester was 0.75 g, poloxamer 188 was 0.75 g, water added to 50 mL. After prepared by optimal technology at 4 ℃ which contained shearing speed of 13 000 r/min, lasting for 5 min, primary emulsion was adjusted to pH 7 with dilute hydro- chloric acid, and homogenized with 600 Bar high pressure for 5 min. The parameters of Citronellol submicroemulsion accor- ding to optimal formulation and technology contained mean particle size of (91.05±0.26) nm, PDI of (0.20±0.01), Zeta-potential of (-30.86±0.39) mV, average content of citronellol (100.21±0.01) %, the drug-loading amount was (2.481 7±0.000 7) mg/mL, the encapsulation rate was (99.27±0.03)%. CONCLUSIONS: The optimal formulation and technology is stable and feasible.
KEYWORDS? ?Citronellol; Submicroemulsion; High-speed shearing dispersion-high pressure homogenization method; Formula- tion;Technology; Optimization; HPLC; Content
香茅醇是一種于香茅屬植物香茅[Cymbopogon citratus (dC.) Stapf]精油中發現的單萜烯類化合物[1]。目前,香茅醇已被作為添加劑廣泛應用于煙草、日化及食品領域[2-3]。有研究發現,該化合物具有抗菌、抗炎、鎮痛、抗氧化和抗腫瘤等藥理作用[4-5]。本課題組前期研究發現,香茅醇對人喉癌上皮細胞Hep-2具有顯著的增殖抑制作用。但因香茅醇揮發性較強,對光線、氧氣、溫度等條件較敏感,且難溶于水,故其臨床應用受到限制[6]。
亞微米乳劑(以下簡稱“亞微乳”)作為一種新型的藥物遞送系統,其乳滴粒徑介于乳劑和微乳之間[7-8],藥物可與油相混溶或停留在油相界面層內,除可減少藥物不良反應、提高生物膜透過率和生物利用度、增強藥物靶向性外,還具有增加難溶性藥物溶解度和穩定性、促進藥物持續釋放等優點[9-11],是目前藥劑學領域研究的熱點之一[12]。高速剪切分散-高壓均質法是指借助介質研磨或高壓均質等機械力來減小藥物分子粒徑的方法,與傳統方法(如膠體磨乳化法、超聲波乳化法、剪切攪拌乳化法等)相比,該方法可大幅減少乳化劑用量、降低藥物毒副作用,所得微粒的粒度分布范圍更窄、靶向分布更具特異性,且易于工業化生產,是微(納)米級混懸液最受歡迎的制備方法[13-14]。為此,本研究采用高效液相色譜法(HPLC)測定制劑中香茅醇的含量,采用高速剪切分散-高壓均質法制備香茅醇亞微乳,并對其處方及工藝進行優化,旨在為該化合物新劑型的開發和合理應用提供參考。
1 材料
1.1 儀器
U3000 型HPLC儀,配備四元泵、紫外檢測器、進樣器、柱溫箱(美國Thermo Fisher Scientific公司);85-2B型恒溫加熱磁力攪拌器(金壇市科析儀器有限公司);NANOJ H10型高速剪切乳化機、4802型高壓均質機均由ATS工業系統有限公司提供;UV 2700型紫外-可見分光光度計(日本Shimadzu公司);KQ3200型超聲波清洗器(昆山市超聲儀器有限公司);NANO-ZA型Zeta電位及粒徑測定儀(英國Malvern公司);ME104/02型千分之一電子天平[梅特勒-托利多儀器(上海)有限公司];BS-223S型百分之一分析天平(北京賽多利斯儀器系統有限公司)。
1.2 藥品與試劑
香茅醇對照品[阿拉丁試劑(上海)有限公司,批號:J1713062,純度:≥95%];大豆磷脂(PC,上海太偉藥業有限公司,批號:201806032);15-羥基硬脂酸聚乙二醇酯(15-HS,批號:0339458800)、泊洛沙姆188(F-68,批號:WPAK539B)均購自德國BASF公司;膽固醇(CH,國藥集團化學試劑有限公司,批號:69008214);中鏈甘油三酯(MCT,批號:20190802)、甘油(批號:20180116)均購自浙江遂昌惠康藥業有限公司;大豆油(LCT,浙江田雨山藥用油有限公司,批號:20190802);油酸(西隴科學股份有限公司,批號:170329);油酸鈉(天津市光復精細化工研究所,批號:20191022);乙腈、甲醇均為色譜純,水為超純水。
2 方法與結果
2.1 香茅醇亞微乳的制備
根據本課題組前期預試驗初步確定香茅醇亞微乳處方。取LCT、PC和油酸各適量,置于燒杯中,于55 ℃水浴中超聲(功率:240 W,頻率:40 kHz)使溶解,冷卻至25 ℃左右,加入香茅醇對照品,混勻,即得油相。另取15-HS、F-68各0.75 g,置于燒杯中,加水至50 mL,于55 ℃加熱溶解,以1 000 r/min攪拌5 min,得水相,冷卻至25 ℃左右。于4 ℃水溶條件下將油相緩慢注入至水相中,采用高速剪切乳化機以10 000 r/min高速剪切5 min,得香茅醇亞微乳初乳。經稀鹽酸調節pH至7,采用高壓均質機以300 Bar高壓均質5 min,得香茅醇亞微乳。另同法制備不含香茅醇對照品的空白亞微乳。
2.2 香茅醇的含量測定
采用HPLC法測定香茅醇亞微乳中香茅醇的含量。
2.2.1 色譜條件 色譜柱:Ultimate? LP-C18(150 mm×4.6 mm,5 ?m);流動相:乙腈-水(70 ∶ 30,V/V);檢測波長:205 nm;流速:1.0 mL/min;柱溫:30 ℃;進樣量:20 μL。
2.2.2 對照品溶液的制備 精密稱取香茅醇對照品5.0 mg,置于25 mL量瓶中,加乙腈溶解并定容,得質量濃度為200 μg/mL的對照品溶液。
2.2.3 供試品溶液的制備 精密吸取“2.1”項下香茅醇亞微乳0.2 mL,置于10 mL量瓶中,加乙腈破乳并定容至刻度,搖勻。精密吸取上述溶液1.0 mL,置于10 mL量瓶中,加乙腈定容,經0.22 μm微孔濾膜濾過,取續濾液,即得供試品溶液。
2.2.4 空白亞微乳對照溶液 精密吸取“2.1”項下空白亞微乳0.2 mL,按“2.2.3”項下方法制備空白亞微乳對照溶液。
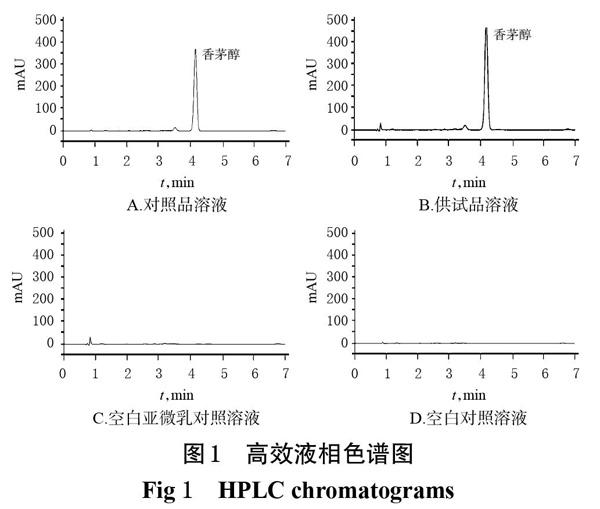
2.2.5 專屬性考察 分別吸取上述對照品溶液、供試品溶液、空白亞微乳對照溶液及空白對照溶液(乙腈)各20 μL,按“2.2.1”項下色譜條件進樣測定,記錄色譜圖。結果,供試品溶液與對照品溶液在相同保留時間處有同一色譜峰;空白亞微乳對照溶液、空白對照溶液均不干擾測定;理論板數以香茅醇計均不低于 6 000,分離度均大于3,詳見圖1。
2.2.6 線性關系考察 精密吸取“2.2.2”項下對照品溶液0.2、0.6、1.0、1.6、3.2 mL,分別置于10 mL量瓶中,加乙腈定容至刻度,制成質量濃度分別為4、12、20、32、64 μg/mL的線性溶液,按“2.2.1”項下色譜條件進樣測定,記錄峰面積。以香茅醇的質量濃度(X,μg/mL)為橫坐標、峰面積(Y)為縱坐標進行線性回歸,得回歸方程為Y=0.576 2X+0.128 5(R 2=0.999 9),表明香茅醇檢測質量濃度的線性范圍為4~64 μg/mL。
2.2.7 精密度試驗 精密吸取“2.2.6”項下20 μg/mL的線性溶液適量,按“2.2.1”項下色譜條件連續進樣測定6次,記錄峰面積。結果,香茅醇峰面積的RSD為2.23%(n=6),表明儀器精密度良好。
2.2.8 重復性試驗 精密吸取“2.1”項下香茅醇亞微乳適量,共6份,按“2.2.3”項下方法制備供試品溶液,再按“2.2.1”項下色譜條件進樣測定,記錄峰面積并按外標法計算樣品中香茅醇的含量。結果,香茅醇含量的RSD為2.19%(n=6),表明該方法重復性良好。
2.2.9 穩定性試驗 精密吸取“2.2.3”項下供試品溶液適量,分別于室溫放置0、2、4、6、8、10、12、24 h時,按“2.2.1”項下色譜條件進樣測定,記錄峰面積。結果,香茅醇峰面積的RSD為1.08%(n=8),表明供試品溶液在室溫下放置24 h內穩定性良好。
2.2.10 加樣回收率試驗 精密吸取“2.1”項下空白亞微乳適量,置于10 mL量瓶中,加入一定量的對照品溶液(取“2.2.2”項下對照品溶液,加乙腈稀釋至質量濃度分別為12、20、32 μg/mL),按“2.2.3”項下方法制備供試品溶液,再按“2.2.1”項下色譜條件進樣測定,記錄峰面積并計算加樣回收率。結果,上述3種質量濃度樣品的加樣回收率分別為97.64%~101.97%(RSD=2.28%,n=3)、97.71%~99.50%(RSD=1.29%,n=3)、96.87%~101.48%(RSD=2.86%,n=3)。
2.3 離心穩定常數的測定
乳劑在一定轉速下離心后產生的影響相當于自然靜置較長時間后產生的影響[12]。當乳劑中乳滴的表面張力過大而不穩定時,離心易導致乳劑分層,其吸光度值可能發生變化,因此本研究采用離心-分光光度法測定乳劑離心前后吸光度值變化百分率即離心穩定常數(ke),ke值越小表示乳劑體系越穩定[15]。取“2.1”項下香茅醇亞微乳(或初乳)3 mL,以3 500 r/min離心15 min,取下層液50 μL,加水稀釋至10 mL,以水為空白,采用紫外-可見分光光度計于500 nm 波長處測定吸光度值(A)[15];另取“2.1”項下香茅醇亞微乳(或初乳)50 μL,同法稀釋后測定吸光度值(A0);并計算ke:ke=(A0-A)/A0×100%[12]。
2.4 處方的優化
采用單因素試驗,以初乳粒徑(經Zeta電位及粒徑測定儀檢測)和ke值(按“2.3”項下方法檢測)為指標。
2.4.1 油相 參考相關文獻,固定油相總量為10%[16],加香茅醇2.5 g、PC 0.6 g、油酸0.2 g、15-HS 0.75 g、FS-68 0.75 g,再加水至50 mL,考察不同油相對香茅醇亞微乳初乳粒徑及ke值的影響。結果,LCT、MCT與香茅醇均有較好的相容性,且粒徑及ke值較適中,詳見表1。但有研究認為,單獨使用LCT或MCT的毒性較大[17-18],因此本研究以LCT+MCT作為混合油相進行后續試驗。
2.4.2 LCT與MCT比例 參考相關文獻,固定油相總量為10%[16],LCT+MCT總質量為2.5 g,加香茅醇2.5 g、PC 0.6 g、油酸0.2 g、15-HS 0.75 g、FS-68 0.75 g,再加水至50 mL,考察不同質量比LCT與MCT對香茅醇亞微乳初乳粒徑及ke值的影響。結果,當LCT ∶ MCT為1 ∶ 1(g/g)時,初乳的粒徑和ke值均較小,故選擇LCT ∶ MCT為1 ∶ 1(g/g),詳見表2。
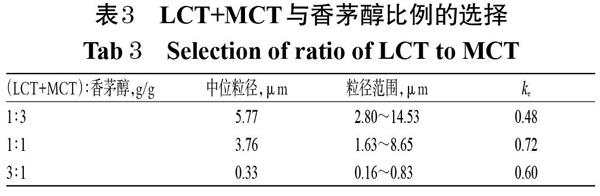
2.4.3 LCT+MCT與香茅醇比例 參考相關文獻,固定油相總用量為10%[16],LCT和MCT(1 ∶ 1,g/g)總質量為3.75 g,加PC 0.6 g、油酸0.2 g、15-HS 0.75 g、FS-68 0.75 g,再加水至50 mL,考察不同質量比LCT+MCT與香茅醇對香茅醇亞微乳初乳粒徑及ke值的影響。結果,雖然當LCT+MCT ∶ 香茅醇為1 ∶ 3(g/g)時,初乳的ke值最小,但因其對應的粒徑范圍較大且有乳滴掛壁、表面浮油現象,故最終選擇了LCT+MCT ∶ 香茅醇為3 ∶ 1(g/g),詳見表3。
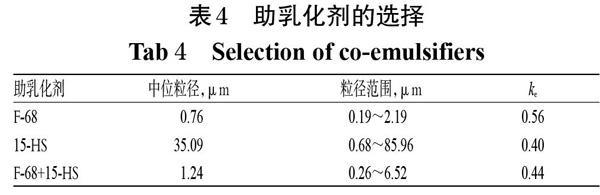
2.4.4 助乳化劑 參考相關文獻,固定油相總量為10%[16],LCT+MCT和香茅醇(3 ∶ 1,g/g)總質量為3.75 g,加PC 0.6 g、油酸0.2 g、15-HS 0.75 g、F-68 0.75 g,再加水至50 mL,考察不同助乳化劑[F-68、15-HS、兩者組合(1 ∶ 1,g/g)]對香茅醇亞微乳初乳粒徑及ke值的影響。結果,以F-68為助乳化劑時,初乳的濾過速度極慢,且在燒杯內壁存有大量油滴;以15-HS為助乳化劑,初乳的ke值雖然最小,但粒徑差異較大,故選擇F-68+15-HS作為助乳化劑,詳見表4。
2.4.5 15-HS與F-68比例 參考相關文獻,固定油相總量為10%[16],LCT+MCT和香茅醇(3 ∶ 1,g/g)總質量為3.75 g,加PC 0.6 g、油酸0.2 g,再加水至50 mL,考察不同質量比15-HS與F-68對香茅醇亞微乳初乳粒徑及ke值的影響。結果,15-HS ∶ F-68為1 ∶ 1(g/g)時,初乳的ke值最小,且粒徑適中,故選擇15-HS ∶ F-68為1 ∶ 1(g/g),詳見表5。
2.4.6 PC質量分數 參考相關文獻,固定油相總量為10%[16],LCT+MCT和香茅醇(3 ∶ 1,g/g)總質量為3.75 g,加PC 0.6 g、油酸0.2 g、15-HS 0.75 g、F-68 0.75 g,再加水至50 mL,考察不同質量分數PC對香茅醇亞微乳初乳粒徑及ke值的影響。結果,當PC質量分數為1.2%時,初乳的ke值最小,且粒徑適中,故選擇PC質量分數為1.2%,詳見表6。
2.4.7 穩定劑種類 參考相關文獻,固定油相總量為10%,穩定劑用量為0.4%[16],LCT+MCT和香茅醇(3 ∶ 1,g/g)總質量為3.75 g,加1.2%PC 0.6 g、15-HS 0.75 g、F-68 0.75 g,再加水至50 mL,考察不同穩定劑對香茅醇亞微乳初乳粒徑及ke值的影響。結果,以油酸鈉為穩定劑時,初乳的ke值最小,且粒徑適中故選擇油酸鈉為穩定劑,詳見表7。
2.4.8 油酸鈉質量分數 參考相關文獻,固定油相總量為10%,穩定劑用量為0.4%[16],LCT+MCT ∶和香茅醇(3 ∶ 1,? g/g)總質量為3.75 g,加1.2%PC 0.6 g、15-HS 0.75 g、F-68 0.75 g、油酸鈉 0.3 g,加水至50 mL,考察不同油酸鈉質量分數對香茅醇亞微乳初乳粒徑及ke值的影響。結果,當油酸鈉質量分數為0.6%時,初乳的ke值最小,且粒徑適中,故選擇油酸鈉質量分數為0.6%,詳見表8。
2.4.9 PC與CH比例 有研究認為,適量的膽固醇對生物膜穩定性具有雙相調節作用[19]。參考相關文獻,固定油相總量為10%,穩定劑用量為0.4%[16],LCT+MCT和香茅醇(3 ∶ 1,g/g),總質量為3.75 g,加1.2%PC 0.6 g、15-HS 0.75 g、F-68 0.75 g、0.6%油酸鈉 0.3 g,再加水至50 mL,考察不同質量比PC與CH對香茅醇亞微乳初乳粒徑及ke值的影響。結果,當PC與CH為10 ∶ 1(g/g)時,初乳的ke值最小,且粒徑適中,故選擇PC ∶ CH為10 ∶ 1(g/g),詳見表9。
2.5 高速剪切機的工藝優化
2.5.1 乳化溫度 按“2.4”項下處方,固定剪切轉速為10 000 r/min、剪切時間為5 min。將油相加熱溶解后,冷卻至25 ℃左右,加入香茅醇;于水相中加入上述溶液,分別于4、25 ℃條件下進行高速剪切,考察乳化溫度對香茅醇亞微乳初乳粒徑及ke值的影響。結果,當乳化溫度為4 ℃時,亞微乳的ke值最小,且粒徑適中,故選擇乳化溫度為4 ℃,詳見表10。
2.5.2 剪切轉速 按“2.4”項下處方,固定剪切時間為5 min、乳化溫度為4 ℃,按“2.5.1”項下方法考察不同剪切轉速對香茅醇亞微乳初乳粒徑及ke的影響。結果,剪切轉速10 000、13 000 r/min時的ke值相差不大,但13 000 r/min時的粒徑范圍更小,故選擇剪切轉速為13 000 r/min,詳見表11。
2.5.3 剪切時間 固定乳化溫度為4 ℃、剪切轉速為13 000 r/min,按“2.5.1”項下方法考察不同剪切時間對香茅醇亞微乳初乳粒徑及ke值的影響。結果,隨著剪切時間的延長,粒徑呈減小的趨勢,粒徑范圍變化顯著,但隨著時間繼續延長,粒徑范圍的變化趨勢減小;當剪切時間為7 min時,ke值增加明顯,這可能會導致亞微乳體系不穩定,故綜合考慮,最終選擇剪切時間為5 min,詳見表12。
2.6 高壓均質機的工藝優化
2.6.1 均質壓力 按“2.4”項下處方以及“2.5”項下高速剪切機工藝,固定均質時間為7 min,考察不同均質壓力對香茅醇亞微乳粒徑及ke值的影響。結果,當均質壓力為600 Bar時,亞微乳的粒徑和ke值均最小,故選擇均質壓力為600 Bar,詳見表13。
2.6.2 均質時間 按“2.4”項下處方以及“2.5”項下高速 剪切機工藝,固定均質壓力為600 Bar,考察不同均質時間對香茅醇亞微乳粒徑及ke值的影響。結果,均質時間為5 min時,ke值最小,且粒徑適中,故選均質時間為5 min,詳見表14。
2.7 最優處方工藝的確定及驗證試驗
最優處方如下:LCT+MCT(1 ∶ 1,g/g)總質量為3.75 g,1.2%PC為0.6 g,CH為0.06 g,香茅醇為1.25 g,0.6%油酸鈉為0.3 g,15-HS為0.75 g,F-68為0.75 g,加水至50 mL。最優工藝如下:于4 ℃下以13 000 r/min高速剪切5 min制得初乳后,經稀鹽酸調pH至7,再以600 Bar高壓均質5 min。按上述最優處方及工藝制備3批香茅醇亞微乳,觀察外觀后,采用Zeta電位及粒度儀測定其粒徑、多分散系數、Zeta電位,并按“2.3”項下方法檢測ke值;分別按“2.2.3”項下方法制備供試品溶液,再按“2.2.1”項下色譜條件進樣測定,記錄峰面積并按外標法計算樣品中香茅醇的含量。所得香茅醇亞微乳外觀見圖2,粒徑分布及Zeta電位圖見圖3,驗證試驗結果見表15。
2.8 載藥量及包封率的測定
2.8.1 載藥量 取按“2.7”項下最優處方及工藝制備的香茅醇亞微乳適量,按“2.2.3”項下方法制備供試品溶液,再按“2.2.1”項下色譜條件進樣測定,記錄峰面積并按外標法計算亞微乳中香茅醇的含量,換算為總質量(W總)后,計算載藥量:載藥量(%)=(W總/香茅醇亞微乳的質量)×100%[20]。每樣品重復測定3次。結果,香茅醇亞微乳的載藥量為(2.481 7±0.000 7)mg/mL。
2.8.2 包封率 取按“2.7”項下最優處方及工藝制備的香茅醇亞微乳3 mL,置于50 kDa超濾管中,以3 500 r/min離心30 min,取續濾液0.2 mL,置于1.0 mL量瓶中,加乙腈定容至刻度,經0.22 μm微孔濾膜濾過,取續濾液,按“2.2.1”項下色譜條件進樣測定,記錄峰面積并按外標法計算游離香茅醇的含量,并換算為未包封入亞微乳、游離在水相中的香茅醇質量(W游),計算包封率:包封率(%)=(W總-W游)/W總×100%[20]。結果,香茅醇亞微乳的包封率為(99.27±0.03)%。
3 討論
LCT具有升高肺動脈壓、抑制胃腸功能等毒副作用,其作為油相在亞微乳中的應用由此受到限制[16-17]。有研究認為,MCT因相對分子量較小,有較好的水溶性及較低的酸度系數,故其勿需依賴肉毒堿即可進入線粒體而被快速氧化,且在血液循環中清除速度較快,不易在肝臟中蓄積,這對肉毒堿缺乏的危重患者和新生兒無疑是有利的[16]。但也有研究認為,單用MCT可引起代謝性酸中毒和神經系統副作用[17],因此不宜單獨作為油相。文獻報道,以LCT與MCT混合作為油相可減少毒性并降低游離藥物的濃度,且對網狀內皮系統無影響,因此臨床推薦LCT與MCT作為混合乳劑使有,以降低單用LCT或MCT引起的相應風險[18]。
有研究認為,油相黏度、油水界面張力均與溫度有關[17]。由于香茅醇易揮發,因此高壓均質過程中的溫度控制對其亞微乳的穩定性具有十分重要的意義。當溫度過低時,油相黏度較大,形成的乳滴粒度大且粒徑分布廣;升高溫度雖然可降低油相黏度,有利于亞微乳的形成,但溫度過高可造成乳滴動能增加,從而加速乳滴間的相互碰撞,發生聚集而產生大油滴,導致油水分層、乳劑破裂,最終影響亞微乳的穩定性[19,21]。
在處方及工藝優化過程中,隨著均質壓力的增加和均質時間的延長,所得亞微乳粒徑和ke值逐漸降低,但當均質壓力和均質時間達到一定值時,粒徑減小不明顯,但ke值變化較大,其原因可能為壓力增大時會產生較多的熱量,導致乳滴聚集,從而影響穩定性[22-23]。
綜上所述,優化所得處方及工藝穩定、可行。
參考文獻
[ 1 ] SANTOS PL,MATOS JPSCF,PICOT L,et al. Citronellol,a monoterpene alcohol with promising pharmacological activities:a systematic review[J]. Food Chem Toxicol,2019. DOI:10.1016/j.fct.2018.11.030.
[ 2 ] 姜豐,王益,嚴俊麗,等.香茅醇微乳凝膠的制備及體外抗菌試驗[J].中國實驗方劑學雜志,2017,23(20):8-13.
[ 3 ] 項佳媚,鄭希龍,魏建和,等.香茅草及香茅草茶的研究進展[J].世界科學技術:中醫藥現代化,2017,19(5):874- 879.
[ 4 ] 廉曉紅,李德山,竇玉琴,等.香茅草提取物的免疫調節作用與腫瘤抑制作用[J].沈陽藥科大學學報,2005,22(4):295-297、300.
[ 5 ] YU WN,LAI YJ,MA JW,et al. Citronellol induces ne- croptosis of human lung cancer cells Ⅶ TNF-α pathway and reactive oxygen species accumulation[J]. In Vivo,2019,33(4):1193-1201.
[ 6 ] 陶紫,趙振剛.香茅草精油微乳液的構建及其抗氧化活性分析[J].現代食品科技,2018,34(10):162-170.
[ 7 ] 岳鵬飛,袁海龍,楊明,等.葛根素亞微乳的制備及表征[J].藥學學報,2007,42(6):649-655.
[ 8 ] 趙麗珊,吳素香.亞微乳作為靜脈給藥載體的研究進展[J].醫藥導報,2008,27(5):74-75.
[ 9 ] GAO K,SUN J,LIU K,et al. Preparation and characterization of a submicron lipid emulsion of docetaxel:submicron lipid emulsion of docetaxel[J]. Drug Dev Ind Pharm,2008, 34(11):1227-1237.
[10] WANG JJ,SUNG KC,HU YP,et al. Submicron lipid emulsion as a drug delivery system for nalbuphine and its prodrugs[J]. J Control Release,2006,115(2):140-149.
[11] 和素娜,王東凱,李林穗,等.多烯紫杉醇磷脂復合物亞微乳的制備與工藝優化[J/CD].中國藥劑學雜志:網絡版,2010,8(1):9-16.
[12] LI WQ,LIN X,YANG ZHH,et al. A bufadienolide-loaded submicron emulsion for oral administration:stability,antitumor efficacy and toxicity[J]. Int J Pharm,2015,479(1):52-62.
[13] 張多婷.中心復合設計-效應面法優化泊沙康唑口服混懸液制備工藝[J].沈陽藥科大學學報,2019,36(8):655- 661、698.
[14] 宋婷.松蘿酸脂微球載藥系統的設計、制備及動物體內藥代動力學研究[D].重慶:重慶理工大學,2018.
[15] 李桂玲,林瑞紅.新型麻醉藥異丙酚靜注乳劑的制務及其物理性質的測定[J].沈陽藥科大學學報,1999,16(2):92-94.
[16] 劉穎.氟比洛芬酯脂微球注射液的研究[D].沈陽:中國醫科大學,2013.
[17] 王艷嬌,王濤,李芳,等.地西泮亞微乳注射液處方及制備工藝的研究[J].中國新藥雜志,2007,16(2):142-146.
[18] LI Y,HE H,WANG Q,et al. Preparation,stability and pharmacokinetics evaluation of lipid microspheres loading a promising antitumor candidate:timataxel[J]. Asian J Pharm Sci,2016. DOI:10.1016/j.ajps.2016.07.004.
[19] 祝丹平. ZRANB1和SENP1調控LDLR蛋白穩定性的功能與機制研究[D].武漢:武漢大學,2017.
[20] 劉碧林,石明芯,朱照靜,等.星點設計-效應面法優化姜黃素正負離子納米結構脂質載體處方[J].中草藥,2016,47(19):3401-3406.
[21] 翟宇,黃青.黃體酮亞微乳注射劑的處方和制備工藝研究及其性質考察[J].寧夏醫科大學學報,2014,36(8):872- 875.
[22] 王思玲,李玉娟,張景海,等.電泳光散射法測定異丙酚微乳劑的動電電位[J].沈陽藥科大學學報,2002,19(5):313-315、331.
[23] 馬濤.全合一混合液(all in one admixture)的穩定性[J]. 中國藥房,2000,11(2):40-42.
(收稿日期:2020-02-06 修回日期:2020-06-14)
(編輯:陳 宏)

