環(huán)形RNA在腫瘤增殖與轉(zhuǎn)移中的作用
侯艷艷, 范基農(nóng), 劉湘帆, 倪培華
(1.上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院檢驗(yàn)系,上海 200025;2.上海市臨床檢驗(yàn)中心,上海 200126)
環(huán)形RNA(circular RNA,circRNA)是一種新型的非編碼RNA,是由前體RNA的5'端和3'端共價(jià)閉合形成的環(huán)狀結(jié)構(gòu),其多數(shù)定位于細(xì)胞質(zhì),且序列高度保守,不易被核酸酶降解,在體內(nèi)非常穩(wěn)定,并具有組織或發(fā)育階段特異性。高度豐富并進(jìn)化保守的circRNA已被發(fā)現(xiàn)在心血管疾病、神經(jīng)系統(tǒng)疾病、感染和癌癥中發(fā)揮重要作用。我們主要討論circRNA在腫瘤發(fā)生與發(fā)展中的作用,包括腫瘤的增殖和轉(zhuǎn)移,并進(jìn)一步展望circRNA對(duì)腫瘤的篩查、診斷、預(yù)后評(píng)估以及靶向治療的可能性。
1 circRNA的形成、生物特征、作用機(jī)制與檢測(cè)方法
circRNA在真核細(xì)胞中分布廣泛,且具有許多顯著特性和重要生物學(xué)功能,因此成為非編碼RNA領(lǐng)域的研究熱點(diǎn)。
circRNA根據(jù)不同的組成和循環(huán)機(jī)制可以分為4類(lèi):外顯子circRNA、內(nèi)含子circRNA、外顯子-內(nèi)含子circRNA和tRNA內(nèi)含子所形成的circRNA。目前存在3種假設(shè)模型來(lái)解釋外顯子circRNA的形成[1]。(1)套索驅(qū)動(dòng)的環(huán)化,指由外顯子組成的剪接供體和剪接受體共價(jià)結(jié)合;(2)內(nèi)含子配對(duì)驅(qū)動(dòng)的環(huán)化,由2個(gè)內(nèi)含子互補(bǔ)配對(duì)結(jié)合從而形成環(huán)化結(jié)構(gòu);(3)RNA結(jié)合蛋白誘導(dǎo)的環(huán)化,由前體RNA的內(nèi)含子兩側(cè)的RNA結(jié)合蛋白相互作用形成環(huán)狀結(jié)構(gòu),發(fā)生末端連接,形成circRNA。
circRNA是一類(lèi)具有顯著特征的RNA分子。(1)高豐度,circRNA廣泛表達(dá)于各種物種中,在人類(lèi)細(xì)胞中circRNA占所有轉(zhuǎn)錄本的10%以上[2];(2)穩(wěn)定性,無(wú)5'帽子和3'poly A尾的結(jié)構(gòu)特征使環(huán)狀RNA具有對(duì)核糖核酸酶的消化抗性,大多數(shù)環(huán)形RNA的半衰期超過(guò)48 h,而其線性對(duì)應(yīng)物的半衰期<20 h[3];(3)保守性,circRNA的保守性主要表現(xiàn)為哺乳動(dòng)物之間circRNA的共同表達(dá),例如,大約15 000個(gè)circRNA在人類(lèi)和小鼠的同源基因座中均有表達(dá),分別占人類(lèi)和小鼠circRNA總量的15%和40%[4];(4)特異性,circRNA通常以細(xì)胞特異性和組織特異性方式表達(dá),例如由外顯子組成的circRNA通常位于細(xì)胞質(zhì)中[5];(5)在人類(lèi)和小鼠中,circRNA傾向于在大腦和血小板中富集[6]。
目前研究認(rèn)為,circRNA具有強(qiáng)大的生物學(xué)功能。(1)通過(guò)“海綿作用”吸附微小RNA(microRNA,miRNA)。circRNA上存在miRNA結(jié)合位點(diǎn),可以結(jié)合特定的miRNA,調(diào)節(jié)miRNA和mRNA的結(jié)合,發(fā)揮競(jìng)爭(zhēng)性?xún)?nèi)源RNA的功能。高水平的circ_0020710可以通過(guò)結(jié)合miR-370-3p來(lái)上調(diào)趨化因子CXC配體12(CXC-motif-chemokine 12,CXCL12)表達(dá)。CXCL12的下調(diào)可逆轉(zhuǎn)由circ_0020710表達(dá)引起的黑色素瘤細(xì)胞的惡性行為[5]。(2)吸附RNA結(jié)合蛋白(RNA-binding protein,RBP)。在細(xì)胞質(zhì)中表達(dá)的circRNA能與蛋白質(zhì)結(jié)合,進(jìn)而抑制蛋白質(zhì)向細(xì)胞核的運(yùn)輸。circZKSCAN1可充當(dāng)RBP海綿,與脆性X智力低下蛋白(fragile X mental retardation protein,F(xiàn)MRP)靶基因CCAR1競(jìng)爭(zhēng),隨后使Wnt/β-catenin信號(hào)通路失活從而抑制腫瘤行為[7]。(3)編碼蛋白質(zhì)和多肽。circ-MALAT1在臨床肝細(xì)胞癌樣本的癌癥干細(xì)胞中高表達(dá),circMALAT1通過(guò)與核糖體和mRNA形成三元復(fù)合物,阻止PAX5 mRNA的翻譯并促進(jìn)癌癥干細(xì)胞的自我更新[8]。(4)調(diào)節(jié)基因轉(zhuǎn)錄和選擇性剪切。circRNA可通過(guò)與RNA聚合酶Ⅱ以及其他轉(zhuǎn)錄因子相互作用來(lái)調(diào)節(jié)親本基因的表達(dá)。
目前用于檢測(cè)circRNA的方法有很多種,各個(gè)檢測(cè)方法都有一定的優(yōu)點(diǎn)與局限性,見(jiàn)表1。
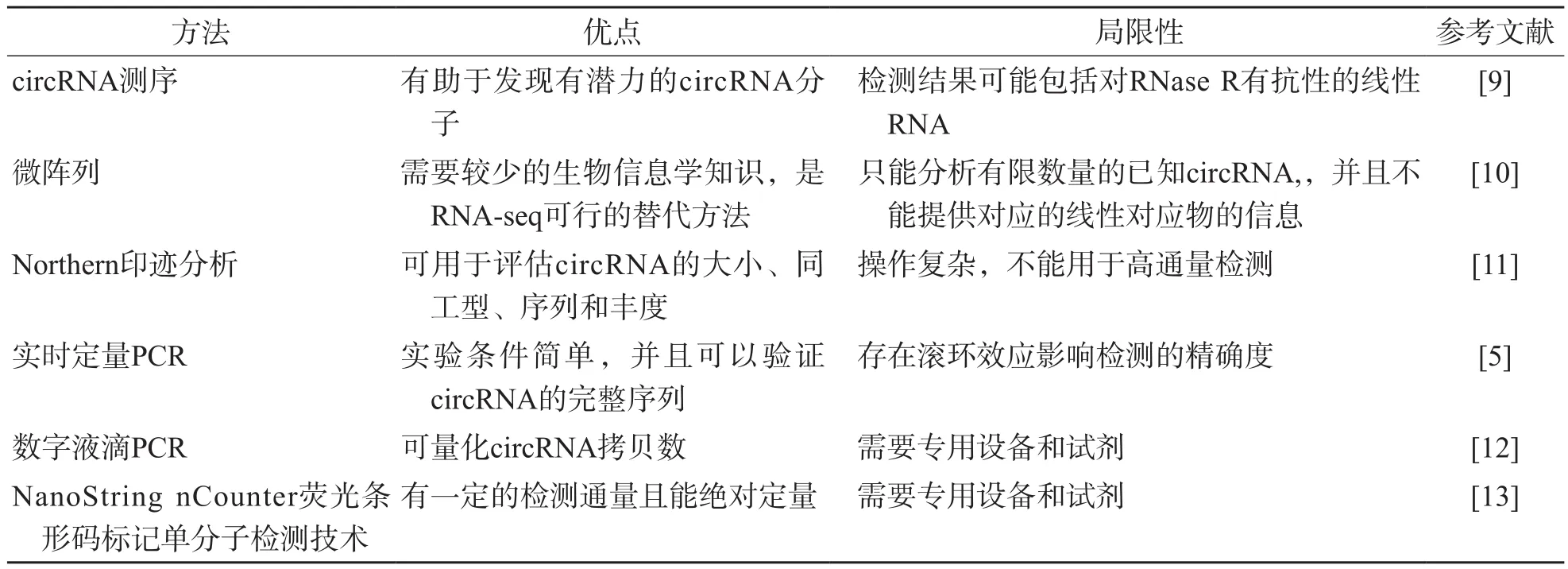
表1 常用檢測(cè)circRNA的方法
2 circRNA在腫瘤生長(zhǎng)和轉(zhuǎn)移過(guò)程中的作用
circRNA在腫瘤細(xì)胞的增殖和轉(zhuǎn)移過(guò)程中發(fā)揮著重要作用,在細(xì)胞周期、上皮間質(zhì)轉(zhuǎn)化,以及增殖與轉(zhuǎn)移相關(guān)信號(hào)通路中circRNA作用均有最新成果。
2.1 circRNA對(duì)細(xì)胞周期相關(guān)蛋白/激酶的調(diào)控
細(xì)胞周期的進(jìn)展是高度有序、逐步發(fā)生的,主要受cyclin細(xì)胞周期素、細(xì)胞周期素依賴(lài)性激酶(cyclin-dependent kinase,CDK)以及細(xì)胞周期素依賴(lài)性激酶抑制劑(cyclin-dependent kinase inhibitor,CKI)的控制。因此,細(xì)胞周期各階段推進(jìn)的核心機(jī)制是cyclin、CDK、CKI之間合成組裝、修飾活化、拆卸降解和轉(zhuǎn)換的過(guò)程。
circRNA參與調(diào)節(jié)周期蛋白或激酶的表達(dá),被認(rèn)為是細(xì)胞周期的基本參與者。ZHENG等[14]發(fā)現(xiàn),來(lái)源于NR3C1的circRNA(circNR3C1)在膀胱癌組織和細(xì)胞系中表達(dá)量顯著下調(diào),circNR3C1直接作用于miR-27a-3p可阻止其與cyclinD1 mRNA 5'UTR的相互作用,并隨后通過(guò)抑制cyclin D1蛋白的表達(dá)來(lái)抑制細(xì)胞周期進(jìn)程。同樣,在肝癌細(xì)胞中has-circ-0000204可以通過(guò)“海綿作用”吸附miR-191,miR-191的上調(diào)抑制了Kruppel樣因子6(Krüppel-like factor 6,KLF6) mRNA和蛋白表達(dá),從而促進(jìn)了G1-S/G2-M期的過(guò)渡[15],KLF6屬于鋅指轉(zhuǎn)錄因子家族成員,其靶標(biāo)蛋白有P21、cyclin D、c-MYC等,在細(xì)胞增殖和細(xì)胞周期中扮演著非常重要的角色。circ-ZKSCAN1是使用circRNA微陣列技術(shù)在膀胱癌中篩選出表達(dá)顯著下降的circRNA,circ-ZKSCAN1可以充當(dāng)miR-1178-3p海綿,通過(guò)削弱miR-1178-3p使靶標(biāo)蛋白P21的mRNA和蛋白表達(dá)上調(diào),進(jìn)而其抑制膀胱癌細(xì)胞的增殖和侵襲[16]。與此類(lèi)似,BCRC-3在膀胱癌組織中表達(dá)降低,通過(guò)RNA下拉實(shí)驗(yàn)確認(rèn)miR-182-5p是其唯一結(jié)合的miRNA,P27是miRNA結(jié)合的靶基因,因此circ-BCRC-3可以直接結(jié)合膀胱癌細(xì)胞中的miR-182-5p,從而促進(jìn)下游效應(yīng)子p27的表達(dá)[17]。DU等[18]的研究發(fā)現(xiàn),circ-Foxo3的表達(dá)抑制了細(xì)胞增殖和細(xì)胞周期進(jìn)程,circ-Foxo3在細(xì)胞內(nèi)可以與P21、CDK2形成circ-Foxo3/p21/CDK2三元復(fù)合物,這個(gè)復(fù)合物的形成,不但使p21阻止了CDK2作用于cyclin E,避免了cyclin E/CDK2復(fù)合物的形成,從而阻斷了G1期向S期的過(guò)渡,同時(shí)其還能消除p21對(duì)cyclin A/CDK2復(fù)合物的抑制作用,從而阻斷S期細(xì)胞周期的進(jìn)展。同樣,circ-Ccnb1可以與cyclin B1和CDK1結(jié)合,從而解除cyclin B1/CDK1復(fù)合物的形成和核轉(zhuǎn)移,使Ccnb1和CDK1不能發(fā)揮有絲分裂活性,抑制了腫瘤的生長(zhǎng)并延長(zhǎng)了小鼠的生存能力[19]。
2.2 CircRNA與上皮間充質(zhì)轉(zhuǎn)化相關(guān)蛋白
上皮-間質(zhì)轉(zhuǎn)化(epithelial-mesenchymal transformation,EMT)是細(xì)胞侵襲和轉(zhuǎn)移的關(guān)鍵驅(qū)動(dòng)因素,其中上皮標(biāo)志物E-鈣黏蛋白(E-cadhefin,E-cad)的表達(dá)下降是EMT的重要標(biāo)志。Snail、Twist、Slug和ZEB等EMT相關(guān)的轉(zhuǎn)錄因子可以與E-cad的E-box結(jié)合調(diào)節(jié)EMT。
Snail是轉(zhuǎn)錄阻遏物,它與E-box序列的調(diào)節(jié)區(qū)和啟動(dòng)子結(jié)合,調(diào)節(jié)許多不同基因的表達(dá),并以此方式調(diào)節(jié)EMT。在膀胱尿道上皮癌中,circPRMT5的表達(dá)上調(diào)且circPRMT5會(huì)吸附miR-30c,通過(guò)circPRMT5/miR-30c/Snail1/E-cadherin途徑促進(jìn)尿道上皮癌細(xì)胞的EMT[20]。同樣,在宮頸癌細(xì)胞中發(fā)現(xiàn)circRNA_000284上調(diào),miR-506已被鑒定為circRNA-000284相關(guān)miRNA,Snail-2是miR-506的直接靶標(biāo),因此,circRNA-000284可以間接增加Snail-2的表達(dá)并促進(jìn)侵襲和轉(zhuǎn)移[21]。ZEB由ZEB1和ZEB2組成,與Snail基因家族成員相似,ZEB家族成員通過(guò)其2個(gè)鋅指結(jié)構(gòu)域與E-cadherin基因啟動(dòng)子中的E-box結(jié)合并觸發(fā)EMT。例如CircNUP214在甲狀腺乳頭狀癌細(xì)胞中發(fā)揮致癌作用,CircNUP214充當(dāng)miR-145的海綿,而ZEB2是miR-145的功能靶標(biāo),CircNUP214/miR-145/ZEB2軸在甲狀腺乳頭狀癌的發(fā)病機(jī)制中起關(guān)鍵作用[22]。Twist是一種重要的EMT,可直接或間接控制EMT相關(guān)基因的轉(zhuǎn)錄。有研究結(jié)果表明,Twist1通過(guò)與泛素化連接酶2(Cullin 2,Cul2)啟動(dòng)子結(jié)合來(lái)促進(jìn)Cul2轉(zhuǎn)錄并上調(diào)Cul2的circRNA(circ-10720)表達(dá),但抑制Cul2表達(dá),circ-10720與Twist1正相關(guān),并促進(jìn)了EMT進(jìn)展,因此circ-10720通過(guò)吸附miR-490-5p來(lái)上調(diào)波形蛋白的表達(dá)[23]。KLF屬于含鋅指的轉(zhuǎn)錄因子家族,可調(diào)節(jié)細(xì)胞增殖、分化和凋亡。ciRS-7在食管鱗狀細(xì)胞癌中過(guò)表達(dá),并可通過(guò)調(diào)節(jié)miR-7/KLF4軸和激活核因子-κB(nuclear factor kappa B,NF-κB)-p65信號(hào)來(lái)觸發(fā)食管鱗狀細(xì)胞癌的遷移和侵襲[24]。
除了以上circRNA在轉(zhuǎn)錄因子的調(diào)控作用外,某些circRNA還通過(guò)直接或間接調(diào)節(jié)細(xì)胞黏附分子和細(xì)胞骨架蛋白的表達(dá)來(lái)發(fā)揮作用。例如:波形蛋白[25]、原鈣黏蛋白α[26]、神經(jīng)性鈣黏素[27]等,此類(lèi)失調(diào)的circRNA可以充當(dāng)腫瘤抑制因子或致癌基因,以控制細(xì)胞增殖、侵襲和轉(zhuǎn)移。我們總結(jié)了近年來(lái)circRNA在腫瘤增殖和轉(zhuǎn)移中的作用,見(jiàn)表2。
2.3 circRNA與生長(zhǎng)和轉(zhuǎn)移相關(guān)信號(hào)通路
circRNA除了對(duì)上述蛋白分子進(jìn)行調(diào)控之外,還對(duì)腫瘤增殖和轉(zhuǎn)移的相關(guān)通路發(fā)揮著重要作用。SU等[28]的研究發(fā)現(xiàn),circRIP2可吸附miR-1305,升高膀胱癌中的TGF-β2,并通過(guò)TGF-β2/Smad3途徑誘導(dǎo)EMT,在膀胱癌中阻斷TGF-β2會(huì)使circRIP2誘導(dǎo)的癌癥進(jìn)展和EMT喪失。CircMYO10通過(guò)吸附miR-370-3p上調(diào)RUVBL1促進(jìn)染色質(zhì)重塑而促進(jìn)骨肉瘤進(jìn)展,RUVBL1與β-catenin/LEF1復(fù)合物的結(jié)合增強(qiáng)β-catenin/LEF1復(fù)合物的轉(zhuǎn)錄活性[29]。在神經(jīng)膠質(zhì)瘤中,circNFIX通過(guò)靶向miR-34a-5p調(diào)控Notch1和Notch信號(hào)通路[30]。ZHANG等[31]的研究發(fā)現(xiàn),在胃癌中有較高的circNRIP1表達(dá),circNRIP1的下游是miR-149-5p,通過(guò)circNRIP1-miR-149-5p-Akt1/mTOR軸負(fù)責(zé)胃癌細(xì)胞中新陳代謝的改變,Akt/mTOR途徑是介導(dǎo)腫瘤代謝穩(wěn)態(tài)的經(jīng)典信號(hào)途徑之一,對(duì)腫瘤的生長(zhǎng)和轉(zhuǎn)移有益。circRNA-000911在乳腺癌細(xì)胞中起抗癌作用,miR-449a是circRNA-000911潛在的miRNA,circRNA-000911通過(guò)使miR-449a海綿化而正向調(diào)節(jié)Notch1表達(dá),有學(xué)者鑒定出NF-κB信號(hào)通路是circRNA-000911/miR-449a途徑的功能靶標(biāo)[32]。見(jiàn)表2。
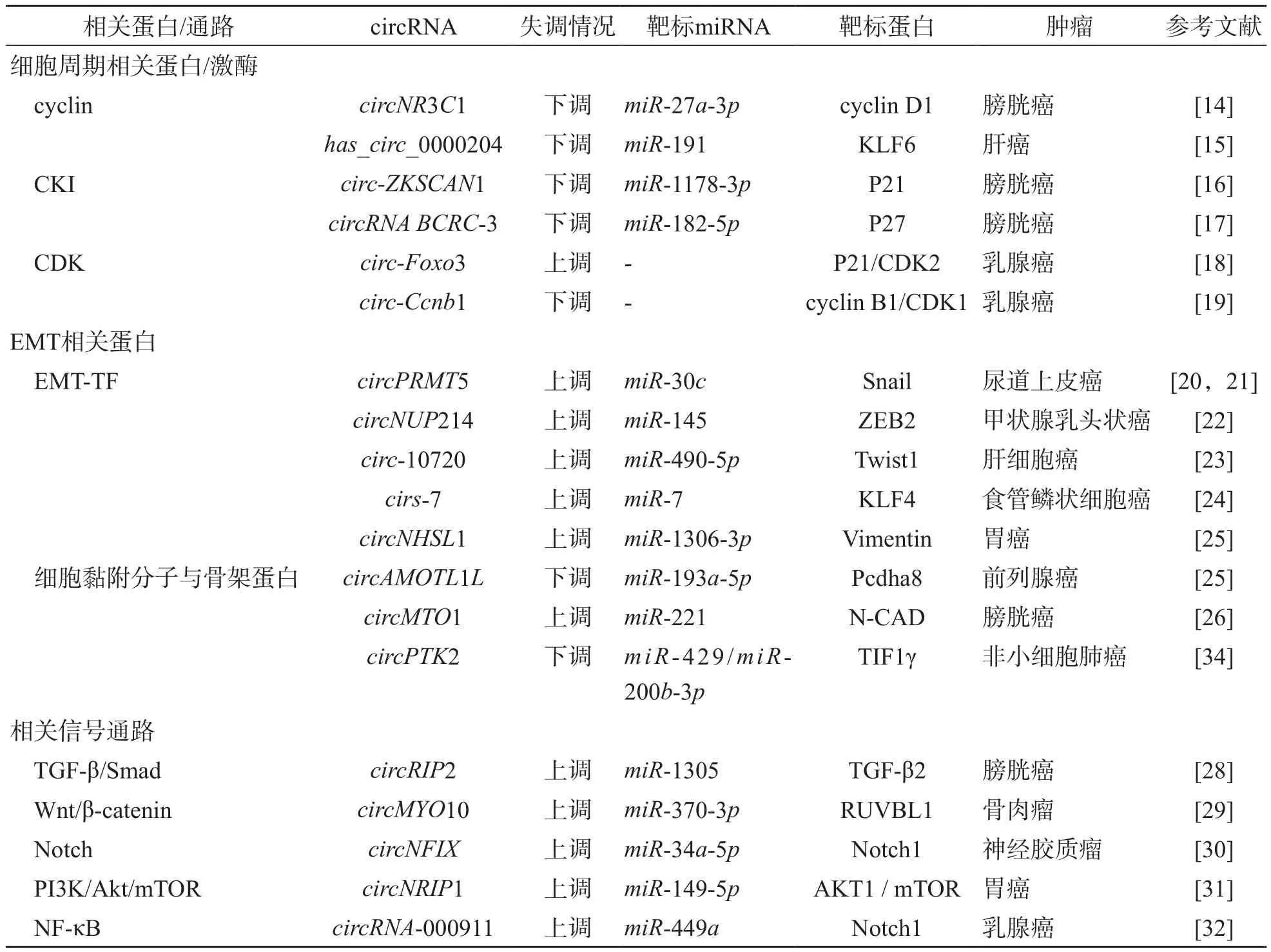
表2 circRNA在腫瘤增殖和轉(zhuǎn)移中的作用
3 總結(jié)和展望
circRNA的發(fā)現(xiàn)豐富了人們對(duì)腫瘤生物學(xué)的認(rèn)知,加深了對(duì)RNA更全面的理解,使其成為腫瘤生長(zhǎng)和轉(zhuǎn)移研究領(lǐng)域的熱點(diǎn),也為檢驗(yàn)診斷開(kāi)拓了新方向。常規(guī)檢驗(yàn)已經(jīng)被證明是很有前途的,但是開(kāi)發(fā)臨床驗(yàn)證的腫瘤檢測(cè)生物標(biāo)志物仍是一個(gè)挑戰(zhàn)。近年來(lái),circRNA在腫瘤增殖和轉(zhuǎn)移方面是非常有潛力的腫瘤標(biāo)志物。例如,血清circSETDB1在高級(jí)漿液性卵巢癌中上調(diào),較高水平的circSETDB1與漿液性卵巢癌患者的臨床分期、淋巴結(jié)轉(zhuǎn)移呈正相關(guān);原發(fā)化學(xué)耐藥患者的血清circSETDB1水平顯著增加,circSETDB1水平較高的患者的無(wú)進(jìn)展生存期較短,因此血清circSETDB1可以作為一種新型的非侵入性生物標(biāo)志物[33]。circMUC16在上皮性卵巢癌患者血清中的表達(dá)增加,其表達(dá)與腫瘤的分級(jí)和分期有關(guān),因此,circMUC16可以作為上皮性卵巢癌的潛在生物標(biāo)志物[34]。exo-hsa_circRNA_0056616的表達(dá)與肺腺癌的T期、M期和TNM分級(jí)之間存在顯著負(fù)相關(guān),因此,exo-hsa_circRNA_0056616是有價(jià)值的淋巴結(jié)轉(zhuǎn)移性肺腺癌的診斷學(xué)生物標(biāo)志物[35]。在多發(fā)性骨髓瘤患者中,hsa_circRNA_101237的表達(dá)升高,hsa_circRNA_101237可以用作多發(fā)性骨髓瘤新的診斷和預(yù)后生物標(biāo)志物以及潛在的治療靶標(biāo)[36]。總之,circRNA在生物標(biāo)志物的開(kāi)發(fā)中顯示出巨大的潛力,與線性RNA相比,具有環(huán)狀結(jié)構(gòu)的circRNA更穩(wěn)定并且具有較長(zhǎng)的半衰期,因此更適用于生物標(biāo)志物的開(kāi)發(fā)。雖然circRNA在檢驗(yàn)診斷方面的應(yīng)用還處于初級(jí)階段,但是對(duì)大量臨床樣本的研究展現(xiàn)了其良好的臨床應(yīng)用價(jià)值,未來(lái)需要挖掘更多更有意義的circRNA,進(jìn)一步評(píng)估其在臨床檢驗(yàn)工作的實(shí)際作用。相信隨著新一代RNA測(cè)序技術(shù)的發(fā)展以及對(duì)更多臨床樣本的研究,circRNA會(huì)成為檢驗(yàn)診斷和臨床治療的新模型。
- 檢驗(yàn)醫(yī)學(xué)的其它文章
- 外來(lái)醫(yī)療器械在臨床檢驗(yàn)及護(hù)理中的規(guī)范化管理
——評(píng)《外來(lái)醫(yī)療器械清洗消毒及滅菌技術(shù)操作指南》 - 風(fēng)險(xiǎn)管理在頭頸外科臨床檢驗(yàn)與護(hù)理中的應(yīng)用效果分析
——評(píng)《臨床檢驗(yàn)手冊(cè)》 - 1例妊娠晚期合并重癥新型冠狀病毒肺炎孕婦臨床特征及實(shí)驗(yàn)室檢測(cè)結(jié)果分析
- 腦梗死患者血清炎性因子、同型半胱氨酸與頸動(dòng)脈內(nèi)膜中層厚度的關(guān)系
- 快速凝膠熒光染色法在尿液蛋白電泳分析中的應(yīng)用
- 新型冠狀病毒肺炎診斷的相關(guān)實(shí)驗(yàn)室檢測(cè)技術(shù)應(yīng)用

