超聲造影結節大小變化在甲狀腺微小乳頭狀癌診斷中的價值
李 剛,賈 超,高 峰,張 凡,史秋生,吳 蓉,杜聯芳,邢晉放
1. 南京醫科大學附屬上海一院臨床醫學院超聲醫學科,上海 200080;
2. 上海交通大學附屬第一人民醫院超聲科,上海 200080;
3. 復旦大學附屬浦東醫院超聲醫學科,上海 201399
世界衛生組織(World Health Organization,WHO)在甲狀腺腫瘤分類系統中將腫瘤最大徑≤10 mm的甲狀腺乳頭狀癌(papillary thyroid carcinoma,PTC)定義為甲狀腺微小乳頭狀癌(papillary thyroid microcarcinoma,PTMC)[1]。PTMC是甲狀腺微小癌(thyroid microcarcinoma,TMC)中最常見的類型,其常同甲狀腺良性結節并存,因原發灶微小、常規超聲缺乏特異性聲像圖表現,術前僅行常規超聲檢查可與較小良性結節重疊而導致誤診、漏診[2]。近年來,超聲造影(contrast-enhanced ultrasound,CEUS)應用于PTMC的臨床診斷中,可望提高診斷準確率。目前,CEUS對甲狀腺惡性結節的研究主要集中在灌注模式方面,達峰時間晚、峰值灌注強度低、不均勻性低增強等為惡性結節的造影特征[3-5]。但對于CEUS后結節大小測值變化對診斷PTMC的價值鮮有報道。因此,本研究回顧并分析南京醫科大學附屬上海一院臨床醫學院超聲醫學科有病理學檢查結果的甲狀腺微小結節患者CEUS和灰階超聲圖像資料,探討CEUS后結節大小測值變化在診斷PTMC方面的價值,現報道如下。
1 資料和方法
1.1 一般資料
研究對象為2018年7月—2019年12月于南京醫科大學附屬上海一院臨床醫學院超聲醫學科實施甲狀腺手術的346例患者,均有明確的病理學檢查結果,共414個結節,且每個結節的最大徑≤10 mm。患者術前均進行灰階超聲及CEUS檢查,影像學資料符合以下標準。① 術前灰階超聲和CEUS檢查由同一位從事超聲檢查工作有5年以上經驗的醫師完成;② 圖像清晰、資料完整;③結節以實性、非囊性及囊性為主;④ 結節內無粗大鈣化或環狀鈣化。所有患者的CEUS檢查均經醫院倫理審查委員會批準,檢查前均已獲得患者知情同意。
1.2 儀器與方法
超聲檢查儀器為日本Toshiba公司的Aplio 600,探頭為線陣14L5(頻率為5~14 MHz),造影劑采用意大利Bracco公司生產的聲諾維(SonoVue)。患者取仰臥位,頸肩部墊高,充分暴露前頸部檢查區域,囑受試者保持平和、均勻呼吸且勿咳嗽或吞咽;先行灰階超聲檢查,清晰顯示甲狀腺結節的灰階圖像,選擇甲狀腺長軸切面評估結節大小,采用十字交叉法(縱徑×橫徑)測量結節大小,保持該測量切面不變,啟動CEUS。將59 mg六氟化硫注入5.0 mL 0.9%的NaCl溶液搖勻成微泡混懸液制成造影劑,注入方式為經肘靜脈團注,每次成像造影劑的劑量為2.0 mL微泡混懸液;檢查過程實時存儲圖像,隨后分析,在增強達峰時刻進行結節大小測量。
根據病理學診斷結果對結節進行分組,病理學診斷結果為PTMC的結節歸入PTMC組,病理學診斷結果為良性病變的歸入良性組。
1.3 統計學處理
分別對PTMC組和良性組結節大小的灰階超聲測值和CEUS測值進行統計學比較,采用配對符號秩和檢驗。統計軟件采用SAS 9.4,P<0.05為差異有統計學意義。
2 結 果
2.1 PTMC組和良性組結節的一般資料
PTMC組共計313個結節,其中男性73例(23.3%),女性240例(76.7%),男性女性比例為1.0∶3.3,年齡為24~72歲,平均年齡(45.6±10.5)歲。良性組共計101個結節,其中男性27例(26.7%),女性74例(73.3%),男性女性比例為1.0∶2.7,年齡為18~70歲,平均年齡(56.3±10.3)歲。101個良性結節中結節性甲狀腺腫86個,腺瘤7個,局灶性結節樣增生6個,亞甲炎2個(表1)。
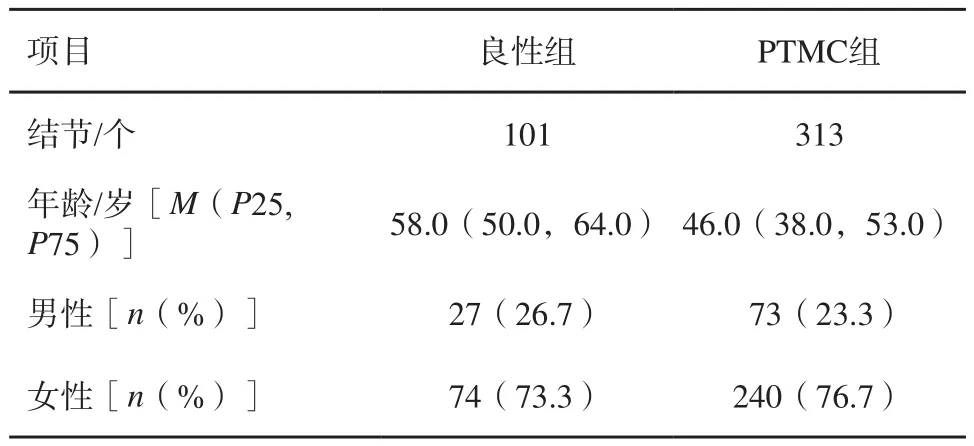
表1 PTMC組和良性組結節的一般資料
2.2 結節大小的灰階超聲和CEUS測值比較
圖1顯示PTMC組結節大小的CEUS測值小于灰階超聲測值,圖2顯示良性組結節大小的CEUS測值與灰階超聲測量相近。表2顯示PTMC組結節大小的CEUS測值明顯小于灰階超聲測值(P<0.05)、良性組結節大小的CEUS測值與灰階超聲測值差異無統計學意義(P>0.05)。
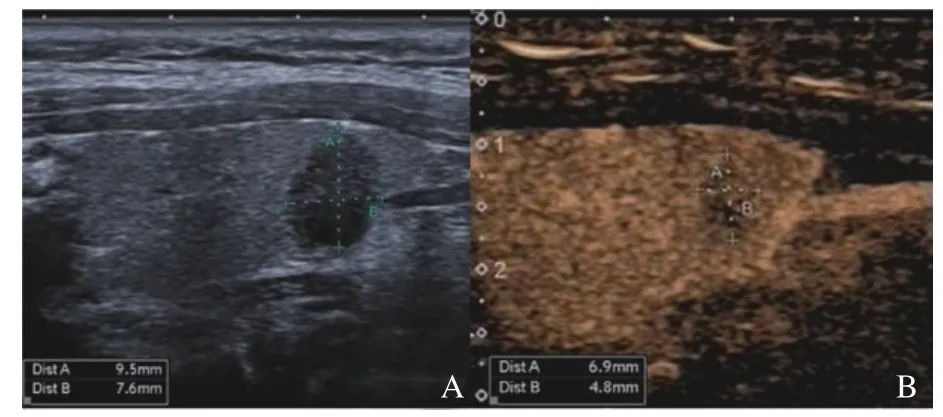
圖1 PTMC組結節大小測量
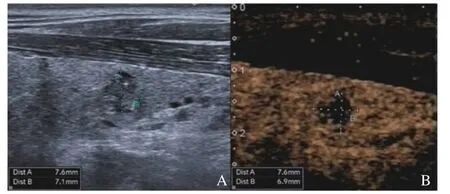
圖2 良性組結節大小測量
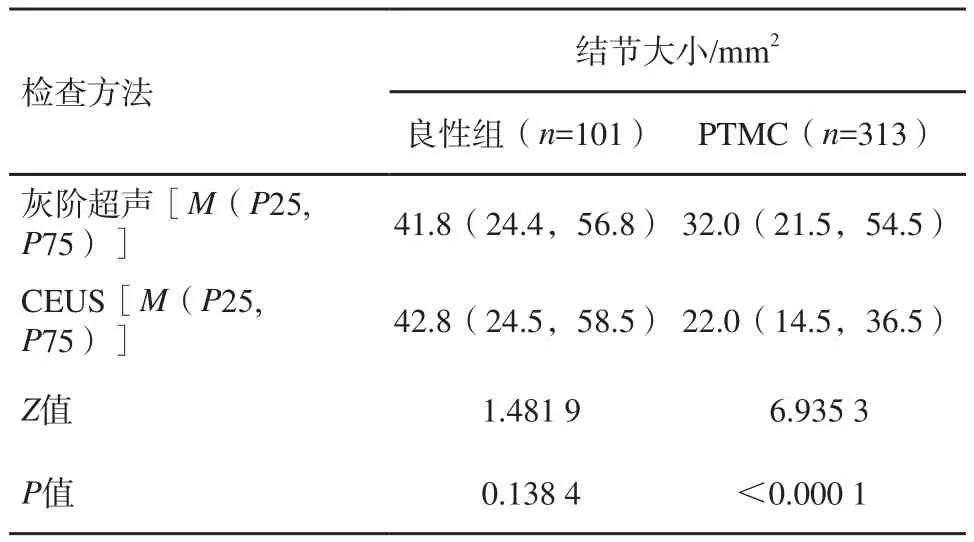
表2 結節大小的灰階超聲和CEUS測值比較
3 討 論
隨著CEUS應用與普及,有研究發現,甲狀腺結節CEUS的增強回聲強度與結節微循環血流灌注量之間存在高度正相關[6],CEUS檢查在鑒別甲狀腺結節良惡性方面具有較高臨床應用價值。同時,相關研究發現,最大徑≤10 mm的甲狀腺良惡性結節的CEUS模式(增強強度、均勻性、邊界)存在一定重疊[7-8],不同學者的研究結果之間存在分歧。CEUS結節大小測值在鑒別甲狀腺結節良惡性方面的臨床價值研究鮮見報道。
本研究發現,PTMC組結節大小的CEUS測值明顯小于灰階超聲測值,而良性組結節大小的CEUS測值與灰階超聲測值無明顯差異。有學者認為,甲狀腺惡性結節呈浸潤性生長,與正常組織交界處血管內皮生長因子的濃度較高可促進微小血管的生成,CEUS聲像可顯示惡性結節增強的范圍較其灰階超聲顯示增大;而良性結節周邊組織與正常組織之間成分沒有明顯的差異,因而CEUS與灰階超聲圖像顯示結節的大小一致[9]。本研究結果與這一觀點不一致,可能存在以下原因。腫瘤新生血管決定其生長與侵襲性的生物學行為,大部分惡性腫瘤具有豐富的新生血管并向周圍組織浸潤的特性,然而多數學者認為甲狀腺癌的新生血管與其生物學行為并不相關。李小鵬等[10]研究發現,甲狀腺惡性結節的微血管密度(microvessel density,MVD)顯著低于甲狀腺良性結節(如結節性甲狀腺腫、腺瘤等),提示PTMC中新生血管較少,CEUS呈低增強。程紅等[11]研究表明,PTMC邊緣區域新生血管較中心區域分布密度高,故CEUS模式下PTMC周邊區域增強強度高于中心區域,周邊區域增強程度可與周圍正常甲狀腺實質增強后重疊,故CEUS模式下所顯示的結節范圍小于灰階超聲顯示的范圍;此外,有些甲狀腺惡性結節中心及邊緣常伴有鈣化、顯著的纖維化及瘢痕形成[11]。Inaba等[12]發現腫瘤內部40%~60%都表現為廣泛的間質纖維化,由于鈣化、纖維化及瘢痕區的血流灌注明顯減少甚至消失,從而導致結節的造影增強范圍減少,結節大小的CEUS測值小于灰階超聲測值。通過以上分析可以推測,對于PTMC結節來講,CEUS測得的結節大小可能不是結節的實際大小,但是,可以利用CEUS顯示結節范圍較灰階超聲縮小這一特征進行PTMC和良性小結節的鑒別診斷。本研究尚存在一定的局限性,主要表現在對于形態不規則的結節來講,采用交叉測量法(縱徑×橫徑)評估結節大小的誤差明顯增大。
本項研究提示,結節大小的CUES測值可以進一步拓展超聲檢查在鑒別甲狀腺良惡性方面的臨床應用,結節大小CEUS測值小于灰階超聲測值可以作為診斷PTMC結節的一個獨立性指標,有必要開展進一步的臨床和基礎研究。

