HDAC抑制劑對食管癌細胞FKBP3的調節作用
程曉敏,丁一楠,姬 強,馮 成,饒德法,劉曉穎
中國是食管癌發病率和死亡率較高的國家,亟需更有效的診斷及預后指標。組蛋白去乙酰化酶(histone deacetylases, HDAC)對染色質的結構修飾和基因表達調控有重要作用。正常細胞中,組蛋白乙酰基轉移酶(histone acetyltransferase, HAT)與HDAC共同調節組蛋白的乙酰化和去乙酰化,而在惡性腫瘤細胞中這種平衡會被打破,進而影響染色質的結構及基因表達等[1-2]。核心組蛋白N末端的可逆修飾是重構高級染色質結構及控制基因表達的主要表觀遺傳機制[3]。HDAC抑制劑所導致的開放染色質可上調或抑制基因表達。已知FK506結合蛋白3(FK506 binding protein 3, FKBP3)可通過HDAC2/SP1/p27這一通路調節腫瘤細胞的增殖能力[4],但尚無證據表明HDAC抑制劑可以調節FKBP3。該研究從食管癌細胞入手,探索多種HDAC抑制劑對FKBP3的調節作用,進一步揭示FKBP3/HDACs在腫瘤中的作用。
1 材料與方法
1.1 主要試劑與儀器
1.1.1主要試劑 二甲亞砜(dimethyl sulfoxide, DMSO)購于德國Sigma-Aldrich公司;抑制劑辛二酰苯胺異羥肟酸(suberoylanilide hydroxamic acid, SAHA)、恩替諾特(MS-275)、MC1568和地西他濱(5-AZA)購于上海Selleck公司;胎牛血清購于以色列Biological Industries公司;RPMI-1640和Opti-MEM培養基購自美國GE公司;胰酶細胞消化液、青霉素-鏈霉素混合液、Western及IP細胞裂解液、苯甲基磺酰氟(PMSF)、Western一抗稀釋液購于上海碧云天生物技術有限公司;Lipofectamine RNAi MAX試劑購于美國Thermo-Fisher公司;Total RNA提取試劑盒購于美國Omega公司;NovoScript?Plus All-in-one 1st Strand cDNA 逆轉錄試劑盒、NovoStart?SYBR qPCR試劑盒 購于江蘇近岸蛋白公司;FKBP3抗體購于英國Abcam公司;HDAC1、HDAC2、HDAC3、beta-actin抗體購于武漢Proteintech公司。
1.1.2主要儀器 二氧化碳恒溫培養箱(VIOS 160i)、BSC-2級生物安全柜(1300)、微量分光光度計(NanoDrop)、實時熒光定量PCR儀(Quant studio 6 Flex)(美國Thermo-Fischer公司);倒置光學顯微鏡(TS-100,日本株式會社尼康);高速冷凍離心機(Microfuge 20R,美國Beckman Coulter公司);恒壓電泳儀(PowerPacTMBasic,美國BIO-RAD公司);微型垂直電泳槽(VE-180,上海天能科技)。
1.1.3siRNA和qPCR引物 HDAC siRNA和陰性對照siRNA合成于上海吉瑪生物科技有限公司,序列見表1。qPCR引物合成于通用生物系統(安徽)有限公司,序列見表2。
1.1.4細胞 食管癌細胞系ECA109和KYSE30為本實驗室保存。

表2 qPCR引物序列
1.2 實驗方法
1.2.1細胞培養和加藥實驗 ECA109和KYSE30細胞系使用含10%胎牛血清的RPMI-1640培養基,置于37 ℃、5% CO2、95%濕度的培養箱中分別培養;培養的細胞每1~2 d換液1次,細胞密度大于90%時進行傳代,使用胰酶對細胞進行消化,以培養基終止消化反應并計數。加藥實驗時,按照3×105個/孔的數量接種于12孔板,待細胞貼壁生長穩定后,在培養基中加入藥物:SAHA(終濃度為4 μmol/L,下同)、MS-275(5 μmol/L)、MC1568(5 μmol/L)、5-AZA(5 μmol/L);設置未處理和陰性對照(加入1 ∶1 000 的DMSO)組;連續培養48 h后,胰酶消化并收集細胞。
1.2.2siRNA knockdown實驗 轉染前1 d,將待轉染細胞以1.5×105個/孔的數量接種于6孔板。次日觀察貼壁后,使用Opti-MEM以50 nmol/L的終濃度稀釋siRNA儲液;再以1 ∶1的比例稀釋Lipofectamine RNAi MAX試劑,將二者混勻,靜置15 min;棄盡培養皿中的培養液,加入上述混合轉染液繼續培養;轉染6 h后更換新鮮培養液;轉染48 h后,胰酶消化并收集細胞以進行后續實驗。
1.2.3逆轉錄和qPCR 使用Total RNA 提取試劑盒對收集的細胞進行總RNA提取,NanoDrop 2000分光光度計測定RNA濃度;按試劑盒要求進行逆轉錄,獲得的cDNA保存于-80 ℃;按試劑盒要求進行實時熒光定量PCR擴增,并以GAPDH為內參,通過2-ΔΔCt法分析相對基因表達,計算各組mRNA的相對含量。
1.2.4Western blot 加入適量Western細胞裂解液裂解收集的細胞,冰浴30 min;4 ℃、14 000 r/min離心20 min;收集上清液,Bradford法進行總蛋白濃度測定;各取30 μg總蛋白樣品,沸水浴5 min變性,SDS-PAGE電泳分離目的蛋白,轉移蛋白于PVDF膜;5%脫脂牛奶于室溫封閉1.5 h,TBST室溫洗膜3次,每次10 min;一抗孵育4 ℃過夜,TBST洗膜3次;室溫孵育二抗1.5 h,TBST洗膜3次;ECL顯影液顯影。使用ImageJ軟件(美國國立衛生研究院)進行條帶的光密度分析,并以β-actin為內參計算FKBP3的相對表達。
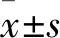
2 結果
2.1 HDAC抑制劑抑制食管癌細胞FKBP3的表達對培養的ECA109和KYSE30細胞進行HDAC抑制劑加藥處理,Western blot結果顯示SAHA和MS-275處理48 h后,FKBP3的蛋白含量有所降低,而MC1568、5-AZA和DMSO處理后的細胞,其FKBP3的含量沒有明顯變化。使用ImageJ對條帶的灰度值進行測定,以β-actin作為內參進行半定量分析,對3次重復實驗的結果進行匯總,同時以DMSO組的數據為基準,制作加藥后FKBP3蛋白相對含量的直方圖(圖1)。依據圖1的數據,HDAC抑制劑SAHA及MS-275處理48 h對ECA109細胞及KYSE30細胞中的FKBP3蛋白表達有一定的抑制作用,但統計分析該結果差異無統計學意義(P>0.05)。
經qPCR實驗結果顯示FKBP3的mRNA水平同樣被SAHA和MS-275所抑制(圖2)。在ECA109細胞中,經2-ΔΔCt法分析后,FKBP3的mRNA含量為DMSO:(0.039±0.003);SAHA:(0.020±0.001);MS-275:(0.017±0.005)。在KYSE30細胞中為DMSO:(0.022±0.001);SAHA:(0.008±0.001);MS-275:(0.009±0.001)。這說明SAHA和MS-275對于FKBP3的抑制作用起始于mRNA水平。鑒于SAHA是廣譜的HDAC抑制劑,而MS-275特異性抑制HDAC1和HDAC3,提示HDAC對FKBP3表達的影響,可能主要是通過HDAC1發揮作用的。

圖1 Western blot法檢測HDAC抑制劑處理后食管癌細胞FKBP3表達

圖2 qPCR檢測HDAC抑制劑對食管癌細胞FKBP3 mRNA水平的影響
2.2 HDAC1和HDAC2調節FKBP3的表達為了進一步確定FKBP3被HDAC調控的具體機制,在ECA109細胞中進行了HDAC1、HDAC2、HDAC3的siRNA敲低實驗。經qPCR結果顯示,轉染48 h后,對比陰性對照組(siNC),3種siRNA敲低組的對應HDAC基因的mRNA的相對含量均減少60%以上(圖3)。Western blot結果顯示,HDAC1和HDAC2敲低的細胞中,FKBP3的蛋白表達受到一定程度的抑制,而HDAC3的敲低對FKBP3沒有明顯影響(圖4)。該結果表明,HDACs對FKBP3的調控很可能是通過HDAC1或HDAC2實現。
2.3 對FKBP3和HDAC相互作用的預測在STRING數據庫中檢索人類FKBP3相互作用蛋白(圖5)。圖5中顯示與FKBP3相互作用置信度最高的10個蛋白,HDAC2和HDAC1蛋白分別位于FKBP3相互作用列表的第1、2位,得分分別為0.958和0.954分(分數區間為0~1分,1分代表相互作用程度最高);FKBP3和HDAC2、HDAC1的相互作用,均獲得了直接實驗及文獻資料庫的支持。并且,根據NCI-Nature Pathways Interaction Database數據庫,FKBP3、HDAC1、HDAC2 這3個蛋白可以作為一個復合體,共同發揮生物學功能。其他諸如CSNK2A1、YY1、哺乳動物雷帕霉素靶標蛋白(mammalian target of rapamycin, mTOR)等蛋白也存在于該相互作用網絡中。

圖3 qPCR檢測ECA109細胞中HDAC siRNA的敲低效果

圖4 ECA109細胞中HDAC siRNA敲低后的

圖5 STRING數據庫中FKBP3的蛋白相互作用網絡
3 討論
組蛋白乙酰化是基因表達的重要決定因素。乙酰化通常與轉錄活化有關,而去乙酰化的組蛋白通常與轉錄抑制有關。HDAC是基因表達的關鍵調節因子,可以從核心組蛋白中去除乙酰基。已有研究表明在結腸癌、乳腺癌和肺癌等多種惡性腫瘤中存在HDAC的異常表達[5]。
近年來,隨著研究的深入和臨床試驗的推進,HDAC抑制劑已被廣泛應用于惡性腫瘤的治療中[6],如美國FDA于2006年批準SAHA用于頑固性T細胞淋巴瘤,于2014年批準PXD101用于周圍性T細胞淋巴瘤。本研究結果表明,SAHA和MS-275不僅可以調節HDAC的水平,還可以調節HDAC相互作用蛋白FKBP3,并且SAHA和MS-275對于FKBP3的調節作用是在mRNA水平發揮作用的。進一步研究顯示,FKBP3蛋白受HDAC調節主要來自于HDAC1和HDAC2,而非HDAC3。本研究中,經SAHA和MS-275處理后的食管癌細胞,對FKBP3的mRNA抑制效應比蛋白水平更顯著,推測可能是蛋白水平的變化存在滯后性,以及FKBP3的翻譯后修飾增強了蛋白的穩定性。
FKBP3是PPIase超家族的一員,其蛋白的C端是FKBP家族共有的PPIase結構域,并且也是FK506結合結構域,與免疫抑制劑FK506、雷帕霉素(Rapamycin)均可結合。在哺乳動物組織中發現的18種FKBPs中,FKBP3和Rapamycin的結合能力僅次于FKBP12,已證明FKBP3的FRB區域可以通過Rapamycin在活細胞中產生物理結合[7],這為FKBP3結合并影響mTOR提供了依據。mTOR作為磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)相關激酶,參與許多細胞增殖和細胞周期相關的重要調節功能,包括在PI3K/Akt通路的下游發揮作用并被磷酸化,進而調節4E-BP1和70S核糖體蛋白6激酶(p70 S6K)通路。mTOR在腫瘤組織中的表達也明顯高于正常組織,是研究腫瘤發生和開發新型抗腫瘤藥物的重點靶點。乙酰化是表觀遺傳修飾的重要機制,組蛋白的乙酰化一般伴隨基因的活化,有報道稱Rapamycin抑制mTOR后可以使Esa1酶從核糖體蛋白基因的啟動子釋放,導致組蛋白H4去乙酰化[8]。mTOR和HDACs的關系密切,PI3K/AKT/mTOR通路調節HDAC3 S424的磷酸化,從而促進HDAC3和磷酸甘油酸激酶1(phosphoglycerate kinase 1, PGK1)相互作用及PGK1 K220去乙酰化[9]。Rapamycin和MS-275聯用也被報道在多種癌癥治療中有效,可顯著下調MYC和E2F1的表達,進而抑制腫瘤細胞生長[10]。基于FKBP3對Rapamycin有較強的結合能力,提示FKBP3在細胞周期調控中發揮作用,可能為潛在的腫瘤藥物靶點。
STRING數據庫整合了基因組背景、高通量測序、共表達、已發表文本挖掘和其他數據庫內容[11]。該數據庫的結果進一步預測了HDAC1、HDAC2和FKBP3之間的相互作用,并且提示這三者可能共同組成復合物發揮作用。綜上,本研究表明,HDAC抑制劑可能在mRNA水平調節FKBP3的表達,而且很可能通過HDAC1、HDAC2實現的,具體分子機制還需進一步研究。

