洛匹那韋/利托那韋藥物相互作用研究進(jìn)展
蘇丹 張蕾 沈愛宗
摘 要 目的:了解洛匹那韋/利托那韋(LPV/r)藥物相互作用的研究進(jìn)展,為其臨床安全、合理、有效使用提供參考。方法:以“洛匹那韋/利托那韋”“藥物相互作用”“藥物代謝酶”“細(xì)胞色素”“藥動(dòng)學(xué)”“藥效學(xué)”“Lopinavir/ritonavir”“Drug-drug interaction”“Herb-drug interactions”“Drug-metabolizing enzymes”“Cytochrome”“Pharmacokinetics”“Pharmaco-dynamics”等為關(guān)鍵詞,在中國知網(wǎng)、萬方數(shù)據(jù)、維普網(wǎng)、PubMed、Micromedex等數(shù)據(jù)庫中組合查詢2000年2月-2020 年2月發(fā)表的相關(guān)文獻(xiàn),對(duì)復(fù)合型蛋白酶抑制LPV/r治療人類免疫缺陷病毒感染等疾病時(shí)與其他藥物聯(lián)用時(shí)的相互作用進(jìn)行綜述。結(jié)果:LPV/r主要經(jīng)肝臟細(xì)胞色素 P450(CYP)酶代謝,并可抑制轉(zhuǎn)運(yùn)蛋白P-糖蛋白(P-gp),對(duì)藥物代謝酶和轉(zhuǎn)運(yùn)體有廣泛的作用,在聯(lián)合用藥中LPV/r或CYP3A底物暴露量的增加可導(dǎo)致顯著的不良反應(yīng),或致使LPV/r療效喪失并產(chǎn)生耐藥性。結(jié)論:臨床上LPV/r與其他藥物聯(lián)合使用廣泛,與經(jīng)相關(guān)酶或轉(zhuǎn)運(yùn)體代謝的藥物聯(lián)用時(shí)需考慮其用藥劑量的調(diào)整,充分考慮可能出現(xiàn)的藥物相互作用或潛在風(fēng)險(xiǎn),并結(jié)合患者的個(gè)體差異,選擇相互作用較小的藥物,同時(shí)加強(qiáng)相關(guān)藥學(xué)監(jiān)護(hù)。
關(guān)鍵詞 洛匹那韋/利托那韋;細(xì)胞色素P450酶;P-糖蛋白;藥物相互作用
洛匹那韋/利托那韋(LPV/r)是第一個(gè)上市的復(fù)合型蛋白酶抑制劑,是在2000年被美國食品和藥物管理局(FDA)批準(zhǔn)的由洛匹那韋與利托那韋組成的一種復(fù)合制劑[商品名:克力芝(Kaletra)][1]。LPV/r的配方為200 mg/80 mg的洛匹那韋與50 mg/20 mg的利托那韋(即洛匹那韋-利托那韋質(zhì)量比為4 ∶ 1),其配伍機(jī)制是小劑量的利托那韋對(duì)細(xì)胞色素P450(CYP)3A4酶有強(qiáng)烈的抑制作用,從而增強(qiáng)洛匹那韋的生物利用度[2]。目前,LPV/r主要用于人類免疫缺陷病毒(HIV)感染/艾滋病(AIDS)、重癥急性呼吸綜合征(SARS)、中東呼吸綜合征(MERS)、新型冠狀病毒肺炎(COVID-19)等患者的治療[3-5]。這些疾病的患者也往往伴隨眾多基礎(chǔ)疾病,如高血壓、糖尿病、慢性阻塞性肺疾病等,這使得臨床上藥物聯(lián)合應(yīng)用的情況十分普遍。藥物相互作用是一種臨床常見的影響藥物療效的因素[6]。LPV/r主要通過CYP酶代謝,可與經(jīng)過這些酶代謝途徑消除的藥物發(fā)生相互作用;另外,LPV/r在藥物吸收和轉(zhuǎn)運(yùn)過程中受轉(zhuǎn)運(yùn)體介導(dǎo),因而與經(jīng)過相關(guān)轉(zhuǎn)運(yùn)體途徑分布的藥物也可發(fā)生相互作用[6]。因此,筆者以“洛匹那韋/利托那韋”“藥物相互作用”“藥物代謝酶”“細(xì)胞色素”“藥動(dòng)學(xué)”“藥效學(xué)”“Lopinavir/ritonavir” “Drug-drug interaction”“Herb-drug interactions” “Drug-metabolizing enzymes” “Cytochrome” “Pharmacokinetics” “Pharmaco-dynamics”等為關(guān)鍵詞,在中國知網(wǎng)、萬方數(shù)據(jù)、維普網(wǎng)、PubMed、Micromedex等數(shù)據(jù)庫中組合查詢2000年2月-2020 年2月發(fā)表的相關(guān)文獻(xiàn),就LPV/r臨床使用中可能產(chǎn)生的藥物相互作用作一綜述,以期為提高LPV/r臨床用藥的安全性和有效性提供參考。
1 LPV/r的藥物相互作用機(jī)制
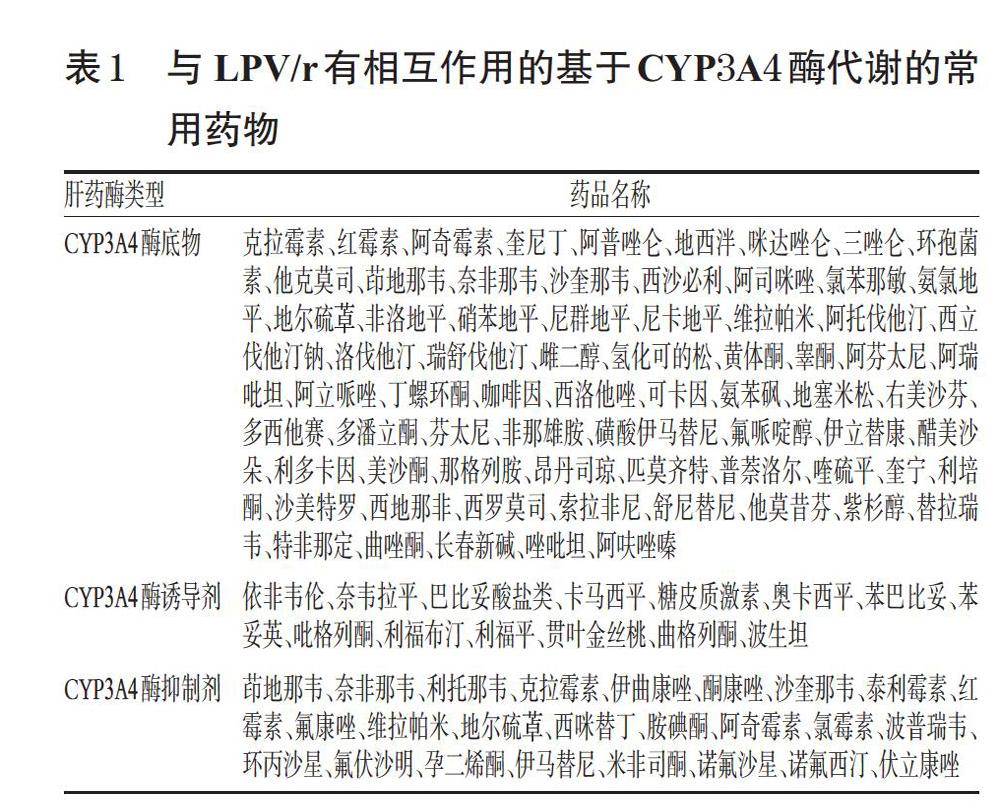
LPV/r是CYP異構(gòu)體CYP3A酶的體外抑制劑,該藥與通過 CYP3A 酶代謝的藥物(如硼替佐米、氟康唑、利福布汀等)聯(lián)用時(shí)可能會(huì)增加藥物的血藥濃度,進(jìn)而導(dǎo)致藥物作用時(shí)間延長和不良反應(yīng)發(fā)生的增加[7]。與 LPV/r有相互作用的基于CYP3A4酶代謝的常用藥物見表1。在臨床用藥濃度范圍內(nèi),LPV/r不會(huì)抑制CYP2D6、CYP2C9、CYP2C19、CYP2E1、CYP2B6 或 CYP1A2 酶的活性[7]。已經(jīng)證明,LPV/r在體內(nèi)能夠誘導(dǎo)其自身代謝,并且可以增加一些藥物如丙戊酸、拉莫三嗪等的生物轉(zhuǎn)化,這些藥物通過CYP 酶系(包括CYP2C9和CYP2C19)與葡萄糖醛酸結(jié)合進(jìn)行代謝,而LPV/r有可能降低這類合用藥物的血藥濃度從而影響藥物的療效[7]。P-糖蛋白(P-gp)是一種膜結(jié)合的細(xì)胞轉(zhuǎn)運(yùn)蛋白,抑制或誘導(dǎo)P-gp可影響藥物的吸收率;利托那韋就是一種P-gp強(qiáng)抑制劑,對(duì)藥物相互作用有很大的影響。Sato T等[8]研究發(fā)現(xiàn),白蛋白水平較低的慢性病患者使用利托那韋,可增強(qiáng)基于有機(jī)陰離子轉(zhuǎn)運(yùn)多肽4C1(OATP4C1)介導(dǎo)的藥物相互作用。
2 與LPV/r有相互作用的常用藥物
2.1 抗病毒藥物
2.1.1 核苷類反轉(zhuǎn)錄酶抑制劑(NRTIS) LPV/r可顯著增加替諾福韋的血藥濃度[9],使受試者工作特征曲線(ROC)下面積(AUC)升高32%、谷濃度(cmin)降低51%、達(dá)峰濃度(cmax)不變,而高濃度的替諾福韋可導(dǎo)致相關(guān)不良反應(yīng),引起腎小管損傷和慢性腎臟疾病[10]。阿巴卡韋/齊多夫定可導(dǎo)致葡萄糖醛酸苷化增強(qiáng),LPV/r與之聯(lián)用后可同時(shí)降低阿巴卡韋和齊多夫定的血藥濃度,但兩藥血藥濃度降低的臨床意義尚未知[7]。
2.1.2 非核苷類反轉(zhuǎn)錄酶抑制劑(NNRTIS) LPV/r與依非韋倫(600 mg,qd)聯(lián)用時(shí),LPV/r的AUC或cmin降低,兩者聯(lián)用時(shí)LPV/r的劑量應(yīng)增加至500 mg/125 mg,bid[11]。依曲韋林主要通過CYP2C9、CYP2C19和CYP3A酶代謝,LPV/r與依曲韋林聯(lián)用時(shí),CYP2C9、CYP2C19酶的表型會(huì)對(duì)依曲韋林的藥動(dòng)學(xué)產(chǎn)生影響,使其AUC下降35%、cmin下降45%、cmax下降30%[11]。LPV/r聯(lián)用可導(dǎo)致利匹韋林的血藥濃度升高、AUC升高52%、cmin升高74%、cmax升高29%,但聯(lián)用時(shí)無需調(diào)整劑量[7]。
2.1.3 HIV趨化因子受體5(CCR5)拮抗劑 馬拉韋羅是CYP3A4酶的底物,LPV/r與馬拉韋羅聯(lián)用時(shí),由于LPV/r對(duì)CYP3A酶的抑制,會(huì)使馬拉韋羅的AUC升高295%、cmax升高97%。與LPV/r(400 mg/100 mg,bid)聯(lián)用時(shí),應(yīng)將馬拉韋羅的劑量減至150 mg,bid[7]。
2.1.4 整合酶抑制劑 雷特格韋是AIDS抗病毒藥物中的第一個(gè)整合酶抑制劑,可與整合酶的鎂或鎂的輔酶因子結(jié)合,阻止前嵌合復(fù)合體形成,從而抑制鏈轉(zhuǎn)移反應(yīng)。與LPV/r聯(lián)用時(shí),雷特格韋的AUC和cmax不變、c12 h降低30%,但洛匹那韋的藥動(dòng)學(xué)參數(shù)不變,故無需進(jìn)行劑量調(diào)整[12]。
2.1.5 融合酶抑制劑 LPV/r與長效HIV-1融合酶抑制劑艾博韋泰聯(lián)用,對(duì)艾博韋泰的暴露量影響較小,會(huì)降低LPV/r的血漿暴露量,但藥物相互作用可能不會(huì)降低兩藥聯(lián)合應(yīng)用的藥效[7]。
2.1.6 其他HIV蛋白酶抑制劑 LPV/r與福沙那韋聯(lián)用后,可顯著降低洛匹那韋的暴露量,其抗病毒的作用沒有增強(qiáng),而胃腸道不良反應(yīng)事件和三酰甘油水平升高的發(fā)生率反而增加[13]。茚地那韋、阿扎那韋分別與LPV/r聯(lián)用時(shí),茚地那韋的cmax上升3.5倍,阿扎那韋的血漿濃度明顯升高[7]。替拉那韋與利托那韋(500 mg/100 mg,bid)聯(lián)用,可使利托那韋的AUC降低55%、cmax降低47%、cmin降低70%[8]。阿米那韋與利托那韋聯(lián)用后,聯(lián)合用藥的cmax和AUC0-∞分別為單用阿米那韋(400 mg)的11%和28%[13]。
2.1.7 直接抗病毒藥物(DAAs) 格卡瑞韋/派侖他韋用于治療基因1、2、3、4、5或6型慢性丙型肝炎(HCV)感染的無肝硬化或代償期肝硬化的成人患者具有良好療效[14]。與利托那韋聯(lián)用后,格卡瑞韋的AUC增加了4倍,而派侖他韋的濃度無變化[15]。艾爾巴韋/格拉瑞韋均為CYP3A酶和P-gp的底物,F(xiàn)eng HP等[16]研究發(fā)現(xiàn),LPV/r顯著增加了艾爾巴韋/格拉瑞韋的暴露量,艾爾巴韋幾何均數(shù)穩(wěn)態(tài)AUC0-2 h為 3.71[90%置信區(qū)間(CI):3.05~4.53]。因此,對(duì)于正在接受艾爾巴韋/格拉瑞韋治療的HCV/HIV合并感染者,不宜使用HIV蛋白酶抑制劑。
2.2 抗菌藥物
吡咯類抗真菌藥是CYP3A4酶和P-gp的抑制劑,LPV/r可使該類藥物的血漿濃度明顯升高,因此聯(lián)用時(shí)需減小抗真菌藥的劑量[17]。利托那韋聯(lián)合伊曲康唑或酮康唑可抑制疣狀瓶霉的生長,但利托那韋與氟康唑聯(lián)用時(shí)具有風(fēng)險(xiǎn)警示的禁忌[18]。小劑量的利托那韋可與伏立康唑聯(lián)用,但應(yīng)根據(jù)治療藥物監(jiān)測(cè)(TDM)來調(diào)整伏立康唑的劑量[19]。酮康唑通過抑制P-gp可使利托那韋在腦脊液中的濃度升高,可用于中樞神經(jīng)系統(tǒng)并發(fā)癥的治療,但一般不推薦LPV/r與高劑量的酮康唑(>200 mg/d)或伊曲康唑(>200 mg/d)聯(lián)用。由于LPV/r可抑制CYP3A酶,故可預(yù)測(cè)LPV/r與克拉霉素聯(lián)用時(shí),克拉霉素的AUC會(huì)輕度增加,因此對(duì)于腎功能不全的患者應(yīng)減少克拉霉素的用藥劑量[7]。
利福平可誘導(dǎo)CYP3A酶,降低HIV/梅毒(TB)合并感染患者中洛匹那韋的濃度,因此對(duì)此類患者使用超劑量的LPV/r(800 mg/200 mg或400 mg/100 mg)是安全有效的[20]。也有研究者將利托那韋添加到LPV/r(4 ∶ 1)中以達(dá)到1 ∶ 1的比例,來克服HIV/TB合并感染患兒因聯(lián)合使用利福平而導(dǎo)致的洛匹那韋濃度降低,然而這種調(diào)整可導(dǎo)致患兒丙氨酸轉(zhuǎn)氨酶(ALT)/天冬氨酸轉(zhuǎn)氨酶(AST)的升高及胃腸道功能絮亂;若必須使用,應(yīng)在使用利福平后逐漸增加LPV/r的劑量[21]。由于利福布汀誘導(dǎo)CYP3A4酶的強(qiáng)度相對(duì)于利福平更小,與LPV/r聯(lián)用可增加利福布汀的暴露量,故推薦利福布汀的劑量為150 mg,以每周3次、間隔相同天數(shù)的方式給藥,同時(shí)應(yīng)加強(qiáng)監(jiān)測(cè)不良反應(yīng)(如中心粒細(xì)胞減少癥[22]、葡萄膜炎[23])。有研究者以HIV/TB合并感染患兒為研究對(duì)象,發(fā)現(xiàn)治療多重耐藥結(jié)核病的藥物(如高劑量異煙肼、吡嗪酰胺、乙胺丁醇、乙硫異煙胺、特立齊酮、氟喹諾酮類藥物和阿米卡星)對(duì)LPV/r的主要藥動(dòng)學(xué)參數(shù)水平無影響[24]。LPV/r可使貝達(dá)喹啉的AUC升高22%、cmax不變,一項(xiàng)單劑量貝達(dá)喹啉和多劑量LPV/r的相互作用研究結(jié)果顯示,貝達(dá)喹啉的AUC增加了22%,說明LPV/r可顯著增加貝達(dá)喹啉的暴露量[25]。
2.3 抗瘧疾藥物
Rattanapunya S等[26]研究了健康泰國成年人中青蒿琥酯-甲氟喹與LPV/r聯(lián)用的藥動(dòng)學(xué)作用,發(fā)現(xiàn)青蒿素的cmax和全身暴露量增加了45%~80%,而雙氫青蒿素與青蒿素的代謝率降低了72%;甲氟喹的cmax和系統(tǒng)暴露量減少了19%~37%,洛匹那韋的cmax顯著降低了22%,但全身藥物的暴露量無顯著變化,患者耐受良好,未發(fā)生嚴(yán)重不良反應(yīng)。目前,青蒿素-本芴醇是廣泛推薦的治療無并發(fā)癥瘧疾的藥物,與洛匹那韋聯(lián)用可使本芴醇的暴露量明顯增加,但需加強(qiáng)用藥安全的監(jiān)測(cè)[27]。該研究對(duì)健康泰國成人中LPV/r與奎寧聯(lián)用的藥動(dòng)學(xué)作用的研究結(jié)果顯示,奎寧的AUC0-48 h、AUC0-∞、cmax分別降低56%、57%和47%,其中利托那韋對(duì)葡萄糖醛酸轉(zhuǎn)移酶(UGT)的誘導(dǎo)以及洛匹那韋的蛋白置換可能是降低奎寧血藥濃度的關(guān)鍵因素。
2.4 抗腫瘤藥物
硼替佐米為CYP3A4酶的代謝底物,與LPV/r聯(lián)用可造成硼替佐米的代謝障礙,從而導(dǎo)致轉(zhuǎn)氨酶升高等不良反應(yīng)的增加,這與其用藥劑量及累積劑量呈正相關(guān)[29]。王延濤等[30]利用因果關(guān)系評(píng)估方法(Roussel-Uclaf)評(píng)價(jià)藥物與肝臟損傷之間的相關(guān)性,分析了LPV/r與硼替佐米聯(lián)用導(dǎo)致肝臟損傷的臨床特點(diǎn)和預(yù)后情況,發(fā)現(xiàn)兩藥聯(lián)用所致的藥物性肝臟損傷以肝細(xì)胞損傷為主,同時(shí)還與ALT和總膽紅素(TBIL)的升高及預(yù)后有關(guān)。利托那韋通過對(duì)癌細(xì)胞中CYP3A4酶的誘導(dǎo)來抑制多西他賽代謝,從而升高多西他賽的血藥濃度,增強(qiáng)對(duì)雄激素非依賴性前列腺癌的療效,提示利托那韋與其他抗腫瘤藥物聯(lián)用有利于治療耐藥性癌癥,但會(huì)增加不良反應(yīng)的發(fā)生[31]。長春新堿可通過P-gp轉(zhuǎn)運(yùn)及CYP3A5酶代謝,與LPV/r聯(lián)用時(shí)可能會(huì)延遲長春新堿的清除,并誘導(dǎo)晚期耐藥癌細(xì)胞(KBV20C)的凋亡,也可能引起顯著的血液學(xué)或胃腸道不良反應(yīng)(如麻痹性腸梗阻)[31]。與LPV/r聯(lián)用時(shí),維奈妥拉的血清濃度會(huì)增加,從而導(dǎo)致劑量起始和遞增階段出現(xiàn)腫瘤溶解綜合征的風(fēng)險(xiǎn)增加;對(duì)于已經(jīng)完成了劑量遞增階段,且每日服用穩(wěn)定劑量維奈妥拉的患者,聯(lián)用LPV/r時(shí)維奈妥拉的劑量可減少至75%,同時(shí)需密切監(jiān)測(cè)患者與維奈妥拉毒性相關(guān)的體征[31]。
2.5 抗心絞痛和抗心律失常藥物
地高辛與LPV/r聯(lián)用時(shí),由于LPV/r對(duì)P-gp的抑制作用可導(dǎo)致地高辛的血藥濃度顯著升高,對(duì)于已經(jīng)服用LPV/r的患者的地高辛血藥濃度增加幅度較小,易發(fā)生腎功能損傷[32]。由于LPV/r對(duì)CYP3A酶的抑制作用,故與如雷諾嗪、決奈達(dá)隆、胺碘酮、芐普地爾、利多卡因(全身給藥)、奎尼丁聯(lián)用時(shí),會(huì)導(dǎo)致這些藥物的血藥濃度升高,故聯(lián)用時(shí)需謹(jǐn)慎,并建議對(duì)患者的血藥濃度進(jìn)行監(jiān)測(cè)。
2.6 調(diào)脂藥物
他汀類藥物(如洛伐他汀、辛伐他汀、阿托伐他汀)的代謝明顯受CYP3A4酶抑制,尤其是利托那韋可導(dǎo)致羥甲基戊二酸單酰輔酶A(HMG-CoA)還原酶的血藥濃度升高,從而出現(xiàn)他汀類藥物肝毒性和橫紋肌溶等不良反應(yīng)的發(fā)生[33-34],因此上述藥物在臨床上與LPV/r聯(lián)用時(shí)應(yīng)使用最低有效劑量。有研究表明,LPV/r和利托那韋均不能影響健康志愿者中非諾貝特的藥動(dòng)學(xué)水平,故非諾貝特聯(lián)合LPV/r仍是HIV感染合并高血脂患者進(jìn)行常規(guī)治療的重要選擇[35]。Dai L等[36]研究了LPV/r對(duì)北京地區(qū)HIV/AIDS初治患者血脂水平的影響,發(fā)現(xiàn)與依非韋倫的方案比較,LPV/r方案治療的患者血脂異常(如高膽固醇血癥、高三酰甘油血癥或混合性高脂血癥)的概率會(huì)增加,但低密度脂蛋白膽固醇水平未受明顯影響。
2.7 抗凝血藥物
利托那韋可誘導(dǎo)CYP1A2、CYP1A4、CYP2C9、CYP2C19酶,導(dǎo)致口服抗凝劑硝芐香豆素過度代謝,使其國際標(biāo)準(zhǔn)化比率(INR)下降,即使增加硝芐香豆素的劑量也不能恢復(fù)到聯(lián)用利托那韋前的抗凝效果[37],因此需避免二者同時(shí)使用,必須聯(lián)用時(shí)應(yīng)密切監(jiān)測(cè)INR。Xu R等[38]采用基于生理的藥物動(dòng)力學(xué)模型研究發(fā)現(xiàn),利伐沙班與利托那韋聯(lián)用時(shí),利伐沙班的AUC會(huì)增加2.2倍,因此對(duì)于接受LPV/r治療的患者不推薦使用利伐沙班。利托那韋和氯吡格雷分別是CYP3A4和CYP2C8酶的抑制劑,利托那韋可使氯吡格雷活性代謝產(chǎn)物的AUC0-4 h降低51%,平均血小板抑制率從51%降至31%;但在藥物基因組學(xué)研究中發(fā)現(xiàn),盡管CYP2C19酶的功能喪失降低了氯吡格雷的功效,但其對(duì)快速代謝型患者的功效并未改變[39]。
2.8 鎮(zhèn)痛藥物
由于LPV/r對(duì)CYP3A酶的抑制作用,可使一些鎮(zhèn)痛藥物的血藥濃度升高,從而增加不良反應(yīng)(如呼吸抑制、鎮(zhèn)靜)的發(fā)生。利托那韋和LPV/r能強(qiáng)烈抑制CYP3A酶介導(dǎo)的羥考酮去甲基化,使羥考酮的AUC顯著增加[40]。LPV/r可改變替利定的序貫代謝,從而顯著降低替利定對(duì)去甲替利定的代謝,導(dǎo)致去甲替利定暴露量增加2.0倍[41]。美沙酮主要經(jīng)CYP3A4和CYP2B6酶代謝,CYP誘導(dǎo)劑可通過降低血漿中美沙酮的水平來縮短美沙酮作用時(shí)間,引起戒斷綜合征的發(fā)生[42-43]。Lozano R等[44]研究發(fā)現(xiàn),聯(lián)用利托那韋組患者的平均美沙酮?jiǎng)┝勘任绰?lián)用利托那韋組高50%(P<0.000 1),因此LPV/r和美沙酮等阿片類鎮(zhèn)痛藥物聯(lián)用時(shí)應(yīng)謹(jǐn)慎,以避免發(fā)生戒斷綜合征。
2.9 抗驚厥藥物
從理論上講,苯妥英、苯巴比妥和卡馬西平均為CYP3A4酶的誘導(dǎo)劑,與LPV/r聯(lián)用可使LPV/r在血漿中的濃度降低。有文獻(xiàn)報(bào)道,LPV/r與苯妥英聯(lián)用可通過誘導(dǎo)CYP酶發(fā)生雙向藥物相互作用:苯妥英可通過誘導(dǎo)CYP3A4酶加快洛匹那韋清除,而小劑量的利托那韋對(duì)CYP3A4酶的抑制作用不能抵消苯妥英的誘導(dǎo)作用,故洛匹那韋可誘導(dǎo)CYP2C9酶加快苯妥英清除[45]。LPV/r可通過誘導(dǎo)葡萄糖醛酸化而降低健康受試者血漿中拉莫三嗪的濃度,因此拉莫三嗪需使用初始劑量的200%,才能使健康受試者血漿中拉莫三嗪的濃度達(dá)到其單用時(shí)的血藥濃度水平,而拉莫三嗪并未影響LPV/r的藥動(dòng)學(xué)水平[46]。有文獻(xiàn)報(bào)道,LPV/r與丙戊酸的相互作用加劇了患者雙向情感的障礙,分析原因?yàn)槔心琼f介導(dǎo)的丙戊酸葡萄糖醛酸化,可導(dǎo)致丙戊酸濃度降低[47]。
2.10 抗精神病藥物
喹硫平是一種新型抗精神病藥物。有研究發(fā)現(xiàn),喹硫平與LPV/r聯(lián)用時(shí),患者可出現(xiàn)昏迷等不良反應(yīng),分析原因是利托那韋能增加喹硫平的暴露量;若必須與LPV/r聯(lián)用時(shí),應(yīng)降低喹硫平的劑量至當(dāng)前劑量的1/6,并監(jiān)測(cè)不良反應(yīng)的發(fā)生[48]。有研究發(fā)現(xiàn),短期內(nèi)給予低劑量的利托那韋,可顯著延長曲唑酮的消除半衰期,增加鎮(zhèn)靜、疲勞和功能障礙等不良反應(yīng)的發(fā)生[49]。
2.11 皮質(zhì)激素藥物
有研究發(fā)現(xiàn),吸入用、注射用或鼻腔內(nèi)給藥制劑氟替卡松丙酸酯、布地奈德、曲安奈德和全身性皮質(zhì)類固醇(如地塞米松、潑尼松)等與LPV/r聯(lián)用,可降低患者洛匹那韋的血藥濃度,導(dǎo)致皮質(zhì)激素藥物的血藥濃度上升、皮質(zhì)醇的水平下降,患者可出現(xiàn)庫欣綜合征、腎上腺功能抑制和孤立性心肌炎等不良反應(yīng)[50]。
2.12 免疫抑制藥物
2016年版《歐洲肝病學(xué)會(huì)丙型肝炎治療指南》指出:由于蛋白酶抑制劑潛在的藥物相互作用,對(duì)于肝移植后需要接受免疫抑制治療的患者,在優(yōu)選方案中不包含利托那韋等蛋白酶抑制劑[51]。LPV/r的聯(lián)用,可升高免疫抑制藥物(如環(huán)孢素、他克莫司、西羅莫司)的血藥濃度,但利托那韋對(duì)HIV感染的腎移植患者發(fā)生排斥反應(yīng)的概率更高,故需監(jiān)測(cè)免疫抑制藥物的血藥濃度[52]。
2.13 5型磷酸二酯酶(PDE5)抑制劑
與LPV/r聯(lián)用,可升高PDE5抑制劑(如阿伐那非、西地那非、他達(dá)那非、伐地那非)的血藥濃度。例如利托那韋(200 mg,bid)可使他達(dá)拉非的AUC增加124%,而不改變cmax,因此患者在使用西地那非或他達(dá)拉非聯(lián)用LPV/r時(shí)需謹(jǐn)慎,并加強(qiáng)對(duì)低血壓、昏厥、視覺變化和勃起時(shí)間延長等不良反應(yīng)的監(jiān)測(cè)[53]。
2.14 中藥
一些中藥成分如貫葉金絲桃、人參提取物、山萘酚、水飛薊賓、大蒜素、貓爪草等可影響P-gp和CYP3A4酶的活性,與LPV/r聯(lián)用可導(dǎo)致LPV/r的病毒學(xué)應(yīng)答喪失,并使病毒對(duì)LPV/r或其他蛋白酶抑制藥物產(chǎn)生耐藥性,而且會(huì)導(dǎo)致胃腸道等不良反應(yīng)的增加[54]。利托那韋可抑制大鼠中雷公藤甲素的清除(AUC增加5倍以上),改變雷公藤內(nèi)酯醇和(5R)-5-羥基雷公藤內(nèi)酯在大鼠體內(nèi)的藥動(dòng)學(xué)水平[55]。有研究發(fā)現(xiàn),LPV/r與麥角生物堿聯(lián)用,可產(chǎn)生急性麥角中毒,造成血管痙攣、局部缺血,甚至截肢等不良反應(yīng)[56-57]。孫濤等[58]研究發(fā)現(xiàn),唐草片與LPV/r聯(lián)用時(shí)對(duì) HIV 感染者體內(nèi)洛匹那韋的藥動(dòng)學(xué)水平無影響。
2.15 其他藥物
LPV/r與非洛地平、硝苯地平、尼卡地平等聯(lián)用時(shí),可導(dǎo)致這些藥物的血藥濃度升高,導(dǎo)致急性腎功能不全、低血壓和水腫等嚴(yán)重不良反應(yīng)的發(fā)生[59]。阿夫唑嗪與LPV/r聯(lián)用,可導(dǎo)致其血藥濃度升高和毒性增加,引起患者出現(xiàn)低血壓癥狀。文獻(xiàn)報(bào)道,HIV感染的肺動(dòng)脈高壓患者聯(lián)用利托那韋和波生坦,波生坦的谷濃度和cmax可升高至1 546.53 ng/mL和3 365.99 ng/mL[60];利托那韋可通過提高葡萄糖苷酸轉(zhuǎn)移酶的活性,使炔雌醇的血漿濃度降低,導(dǎo)致婦女避孕失敗,故在與LPV/r聯(lián)用時(shí)推薦使用非激素避孕法[61]。
3 結(jié)語
目前,由于藥物相互作用所致的藥物療效降低或不良反應(yīng)增加,已成為臨床上不容忽視的問題。本文從藥物機(jī)制的研究出發(fā),對(duì)LPV/r的藥物相互作用進(jìn)行綜述,發(fā)現(xiàn)LPV/r與CYP酶代謝的藥物和轉(zhuǎn)運(yùn)體介導(dǎo)的藥物聯(lián)用可產(chǎn)生相互作用,并導(dǎo)致以下結(jié)果:(1)LPV/r暴露量和CYP3A酶底物暴露量的增加,可造成嚴(yán)重不良反應(yīng);(2) LPV/r的療效喪失并可能引起患者耐藥。
但是,由于部分藥物相互作用的研究主要為觀察研究或個(gè)案報(bào)道,尚不能明確影響LPV/r作用的聯(lián)合用藥劑量,故LPV/r的藥物相互作用機(jī)制及其影響還需要更多的研究進(jìn)行佐證。同時(shí),由于藥物相互作用的原理復(fù)雜,而國內(nèi)關(guān)于LPV/r的藥動(dòng)學(xué)和藥效學(xué)的報(bào)道較少,且在不同種族間的作用會(huì)有差異,故相關(guān)藥物的血藥濃度難以預(yù)測(cè)。因此,在臨床用藥時(shí)醫(yī)師應(yīng)綜合考慮藥物性質(zhì)及患者情況,掌握LPV/r與其他藥物聯(lián)用時(shí)的藥物相互作用,為患者的合理用藥提供指導(dǎo),并減少不良反應(yīng)的發(fā)生。
參考文獻(xiàn)
[ 1 ] MANGUM EM,GRAHAM KK. Lopinavir-Ritonavir:a new protease inhibitor[J]. Pharmacotherapy,2001,21(11):1352-1363.
[ 2 ] BARRY M,MULCAHY F,MERRY C,et al. Pharmacokinetics and potential interactions amongst antiretroviral agents used to treat patients with HIV infection[J]. Clin Pharmacokinet,1999,36(4):289-304.
[ 3 ] MORANGUINHO I,BORREGO P,GONCALVES F,et al. Genotypic resistance profiles of HIV-2-infected patients from Cape Verde failing? first-line antiretroviral therapy[J]. AIDS,2020,34(3):483-486.
[ 4 ] 國家衛(wèi)生健康委辦公廳,國家中醫(yī)藥管理局辦公室.關(guān)于印發(fā)新型冠狀病毒肺炎治療方案(試行第六版)的通知[EB/OL]. (2020-02-18)[2020-02-19]. http://www.nhc.gov.cn/yzygj/s7653p/202002/8334a8326dd94d329df351- d7da8aefc2.shtml.
[ 5 ] MOMATTIN H,AL-ALI AY,AL-TAWFIQ JA. A syste- matic review of therapeutic agents for the treatment of the middle east respiratory syndrome coronavirus (MERS- CoV)[J]. Travel Med Infect Dis,2019. DOI:10.1016/j.tmaid.2019.06.012.
[ 6 ] 王添艷,柳亞敏,王玉敏,等.新型P2Y12受體拮抗劑抗血小板活性的影響因素研究進(jìn)展[J].中國藥房,2019,30(21):3018-3024.
[ 7 ] PASIPANODYA B,KUWENGWA R,PRUST ML,et al.Assessing the adoption of lopinavir/ritonavir oral pellets for HIV-positive children in Zimbabwe[J]. J Int AIDS Soc,2018. DOI:10.1002/jia2.25214.
[ 8 ] SATO T,MISHIMA E,MANO N,et al. Potential drug interactions mediated by renal organic anion transporter OATP4C1[J]. J Pharmacol Exp Ther,2017,362(2):271-277.
[ 9 ] HILL A,KHOO S,BACK D,et al. Should the dose of tenofovir be reduced to 200-250 mg/day,when combined with protease inhibitors?[J]. J Int Aids Soc,2014. DOI:10.7448/IAS.17.4.19583.
[10] MIZUSHIMA D,NGUYEN D,NGUYEN DT,et al. Tenofovir disoproxil fumarate co-administered with lopinavir/ritonavir is strongly associated with tubular damage and chronic kidney disease[J]. J Infect Chemother,2018,24(7):549-554.
[11] GREEN B,CRAUWELS H,KAKUDA TN,et al. Evaluation of concomitant antiretrovirals and CYP2C9/CYP2C19 polymorphisms on the pharmacokinetics of etravirine[J]. Clin Pharmacokinet,2017,56(5):525-536.
[12] MOGALIAN E,STAMM LM,OSINUSI A,et al. Drug- drug interaction studies between hepatitis C virus antivirals sofosbuvir/velpatasvir and boosted and unboosted human immunodeficiency virus antiretroviral regimens in healthy volunteers[J]. Clin Infect Dis,2018,67(6):934- 940.
[13] ADELOYE T,SAHGAL O,PURI A,et al. Amenamevir:studies of potential CYP3A-mediated pharmacokinetic interactions with midazolam,cyclosporine,and ritonavir in healthy volunteers[J]. Clin Pharmacol Drug Dev,2018,7(8):844-859.
[14] GANE E,LAWITZ E,PUGATCH D,et al.Glecaprevir and pibrentasvir in patients with HCV and severe renal impairment[J]. N Engl J Med,2017,377(15):1448-1455.
[15] KOSLOSKI MP,OBEROI R,WANG S,et al. Drug-drug interactions of glecaprevir and pibrentasvir coadministered with human immunodeficiency virus antiretrovirals[J]. J Infect Dis,2020,221(2):223-231.
[16] FENG HP,CARO L,F(xiàn)ANDOZZI C,et al. Pharmacokine- tic interactions between the hepatitis C virus inhibitors elbasvir and grazoprevir and HIV protease inhibitors ritonavir,atazanavir,lopinavir,and darunavir in healthy volunteers[J]. Antimicrob Agents Chemother,2019. DOI:10. 1128/AAC.02142-18.
[17] GRANATO MQ,SOUSA IS,ROSA T,et al. Aspartic peptidase of Phialophora verrucosa as target of HIV peptidase inhibitors:blockage of its enzymatic activity and interfe- rence with fungal growth and macrophage interaction[J]. J Enzyme Inhib Med Chem,2020,35(1):629-638.
[18] PRIYANKA P,VARMA DM,IMMADISETTI K,et al. Recognition of possible risk factors for clinically significant drug-drug interactions among Indian people living with HIV receiving highly active antiretroviral therapy and concomitant medications[J]. Int J Risk Saf Med,2017,29(1/2):25-55.
[19] LI TY,LIU W,CHEN K,et al. The influence of combination use of CYP450 inducers on the pharmacokinetics of voriconazole:a systematic review[J]. J Clin Pharm Ther,2017,42(2):135-146.
[20] BOULANGER C,ROLLA V,AL-SHAER MH,et al. Evaluation of super-boosted lopinavir/ritonavir in combination with rifampicin in HIV-1-infected patients with tuberculosis[J]. Int J Antimicrob Agents,2020. DOI:10.1016/j.ijantimicag.2019.10.021.
[21] RABIE H,DENTI P,LEE J,et al. Lopinavir-ritonavir super-boosting in young HIV-infected children on rifampicin-based tuberculosis therapy compared with lopinavir-ritonavir without rifampicin:a pharmacokinetic modelling and clinical study[J]. Lancet HIV,2018. DOI:10. 1016/S2352-3018(18)30293-5.
[22] RAWIZZA HE,DARIN KM,OLADOKUN R,et al. Safety and efficacy of rifabutin among HIV/TB-coinfected children on lopinavir/ritonavir-based ART[J]. J Antimicrob Chemother,2019,74(9):2707-2715.
[23] LIN HC,LU PL,CHANG CH. Uveitis associated with concurrent administration of rifabutin and lopinavir/ritonavir (Kaletra)[J]. Eye:Lond,2007,21(12):1540-1541.
[24] VAN DER LAAN LE,GARCIA-PRATS AJ,SCHAAF HS,et al. Pharmacokinetics and drug-drug interactions of lopinavir-ritonavir administered with first- and second- line antituberculosis drugs in HIV-infected children treated for multidrug-resistant tuberculosis[J]. Antimicrob Agents Chemother,2018.DOI:10.1128/AAC.00420-17.
[25] PANDIE M,WIESNER L,MCILLERON H,et al. Drug- drug interactions between bedaquiline and the antiretrovirals lopinavir/ritonavir and nevirapine in HIV-infected patients with drug-resistant TB[J]. J Antimicrob Chemother,2016,71(4):1037-1040.
[26] RATTANAPUNYA S,CRESSEY TR,RUEANGWEERAYUT R,et al. Pharmacokinetic interactions between artesunate-mefloquine and ritonavir-boosted? lopinavir in healthy Thai adults[J]. Malar J,2015.DOI:10.1186/s12936-015-0916-8.
[27] KREDO T,MAUFF K,WORKMAN L,et al.The interaction between artemether-lumefantrine and lopinavir/ritonavir-based antiretroviral therapy in HIV-1 infected patients[J]. BMC Infect Dis,2016. DOI:10.1186/s12879-016- 1345-1.
[28] RATTANAPUNYA S,CRESSEY TR,RUEANGWEERAYUT R,et al. Pharmacokinetic interactions between quinine and lopinavir/ritonavir in healthy Thai adults[J]. Am J Trop Med Hyg,2015,93(6):1383-1390.
[29] 王雪,董迪,甄健存.硼替佐米所致62例不良反應(yīng)文獻(xiàn)分析[J].中國醫(yī)院藥學(xué)雜志,2017,37(24):2467-2470.
[30] 王延濤,夏玉朝,余孝東,等.洛匹那韋-利托那韋與硼替佐米合用導(dǎo)致肝損傷的回顧性研究[J].中南藥學(xué),2019,17(11):1958-1962.
[31] FREISE KJ,HU B,SALEM AH. Impact of ritonavir dose and schedule on CYP3A inhibition and venetoclax clinical pharmacokinetics[J]. Eur J Clin Pharmacol,2018,74(4):413-421.
[32] YOGANATHAN K,ROBERTS B,HEATLEY MK.Life- threatening digoxin toxicity due to drug-drug interactions in an HIV-positive man[J]. Int J Std Aids,2017,28(3):297-301.
[33] BEDNASZ C,LUQUE AE,ZINGMAN BS,et al. Lipid- lowering therapy in HIV-infected patients:relationship with antiretroviral agents and impact of substance-related disorders[J]. Curr Vasc Pharmacol,2016,14(3):280- 287.
[47] SHEEHAN NL,BROUILLETTE MJ,DELISLE MS,et al.Possible interaction between lopinavir/ritonavir and valproic acid exacerbates bipolar disorder[J]. Ann Pharmacother,2006,40(1):147-150.
[48] SAMPSON MR,CAO KY,GISH PL,et al.Dosing recommendations for quetiapine when coadministered with HIV protease inhibitors[J]. J Clin Pharmacol,2019,59(4):500-509.
[49] GREENBLATT DJ,VON MOLTKE LL,HARMATZ JS,et al. Short-term exposure to low-dose ritonavir impairs clearance and enhances adverse effects of trazodone[J]. J Clin Pharmacol,2003,43(4):414-422.
[50] PEYRO-SAINT-PAUL L,BESNIER P,DEMESSINE L,et al.Cushings syndrome due to interaction between ritonavir or cobicistat and corticosteroids:a case-control study in the French Pharmacovigilance Database[J]. J Antimicrob Chemother,2019,74(1):3291-3294.
[51] 張影,張福奎.《2016年歐洲肝病學(xué)會(huì)丙型肝炎治療指南》推薦意見[J].臨床肝膽病雜志,2016,32(12):2248-2257.
[52] ROLLINS B,F(xiàn)AROUK S,DEBOCCARDO G,et al. Higher rates of rejection in HIV-infected kidney transplant recipients on ritonavir-boosted protease inhibitors:3-year follow-up study[J]. Clin Transplant,2019.DOI:10.1111/ctr.13534.
[53] 李航,張剛,王建,等.西地那非聯(lián)合小劑量他達(dá)拉非治療重度勃起功能障礙的臨床觀察[J].現(xiàn)代泌尿外科雜志,2020,25(5):428-430.
[54] 楊洋,曾卉,李方園,等.藥代動(dòng)力學(xué)過程中的中西藥配伍禁忌[J].中藥與臨床,2018,9(5):45-49.
[55] XU Y,ZHANG YF,CHEN XY,et al. CYP3A4 inducer and inhibitor strongly affect the pharmacokinetics of triptolide and its derivative in rats[J]. Acta Pharmacol Sin,2018,39(8):1386-1392.
[56] CIFUENTES MD,BLANCO LS,RAMIREZ FC. Ergo- tism due to simultaneous use of ergot alkaloids and high activity antiretroviral therapy[J]. Rev Med Chil,2016,144(6):807-812.
[57] FERRY FR,DA SG,MOTTA RN,et al. Use of lopinavir/ritonavir associated with ergotamine resulting in foot amputation:brief communication[J]. Rev Inst Med Trop Sao Paulo,2014,56(3):265-266.
[58] 孫濤,王江蓉,陳軍,等. HIV感染者中唐草片對(duì)洛匹那韋藥動(dòng)學(xué)的影響[J].中國現(xiàn)代應(yīng)用藥學(xué),2016,33(9):1119-1123.
[59] BAEZA MT,MERINO E,BOIX V,et al. Nifedipine-lopinavir/ritonavir severe interaction:a case report[J]. AIDS,2007,21(1):119-120.
[60] CHINELLO P,CICALINI S,PICHINI S,et al. Sildenafil and bosentan plasma concentrations in a human immunodeficiency virus- infected patient with pulmonary arterial hypertension treated with ritonavir-boosted protease inhibitor[J]. Infect Dis Rep,2015.DOI:10.4081/idr.2015.5822.
[61] MCDONALD CR,CONROY AL,GAMBLE JL,et al. Estradiol levels are altered in human immunodeficiency virus-infected pregnant women randomized to efavirenz-versus lopinavir/ritonavir-based antiretroviral therapy[J]. Clin Infect Dis,2018,66(3):428-436.
(收稿日期:2020-04-26 修回時(shí)間:2020-07-22)
(編輯:羅 瑞)

