復方苦參注射液對晚期肺癌患者近期療效、帶瘤生存及T細胞亞群的影響
(北京航天總醫院 腫瘤內科,北京 100071)
肺癌是我國發病率和病死率最高的惡性腫瘤[1],目前臨床治療主要依靠手術、放化療及分子靶向治療等西醫方法,但是對晚期肺癌患者的療效有限[2]。北京航天總醫院腫瘤內科多年來一直致力于中晚期肺癌治療的臨床研究,主張在綜合評估患者多種因素的基礎上,通過中西醫結合治療盡量減少患者病痛,最終實現“人瘤共存”的和諧狀態[3]。“帶瘤生存”的思想最早出現在《黃帝內經》,但是直到上世紀80年代,才由我國著名的中醫學專家周岱翰教授在《腫瘤治驗集要》[4]中明確提出“帶瘤生存”的定義,并逐漸成為中醫學治療腫瘤的主要原則之一。最近有學者[5]提出“穩化生、扶正氣、清瘤毒、調病絡”的治療理念,認為中醫藥是通過穩定腫瘤內環境,增強機體免疫力,達到抑制腫瘤生長、延長患者生存的目的。
復方苦參注射液是最早用于臨床的中成藥制劑之一,富含苦參堿、氧化苦參堿及脫氧苦參堿等生物堿,具有清熱燥濕、解毒止痛等功效[6]。眾多臨床研究和實驗研究均證實,復方苦參注射液對惡性腫瘤的放化療具有理想的增效減毒作用,而且可作為癌痛患者的輔助治療手段之一[7],但是在晚期肺癌患者中的文獻資料尚少。本研究主要是從近期療效、遠期療效及免疫調節機制3 個維度評估復方苦參注射液在肺癌Ⅲb~Ⅳ期患者的應用價值,以探討實現帶瘤生存的可行性。現報道如下。
1 資料與方法
1.1 一般資料
選取2015年1月—2016年10月北京航天總醫院腫瘤內科就診的120 例肺癌Ⅲb~Ⅳ期患者。隨機將患者分為對照組和中藥治療組,每組60 例。其中,男性80 例,女性40 例;年齡42~80 歲,平均(69.50±8.90)歲;臨床分期:Ⅲb 期53 例,Ⅳ期67 例;病理類型:43 例鱗癌,38 例腺癌,19 例大細胞癌,15例未分化癌,5 例小細胞癌。納入標準:①根據典型的臨床癥狀、指征,并經影像學、組織病理學或細胞學診斷確診為肺癌,符合《中國常見惡性腫瘤診治規范》[8]關于原發性肺癌的診斷標準;②臨床分期為Ⅲb~Ⅳ期;③Karnofsky 評分>60,預計生存時間>3 個月;④無法進行手術或不愿接受手術。排除標準:①合并其他惡性腫瘤;②嚴重肝、腎功能不全;③器質性病變者或藥物過敏者或不耐受。本研究遵循《赫爾辛基宣言》及相關倫理法規,并通過醫院倫理學委員會批準,患者及其家屬均知情同意。兩組患者年齡、性別、BMI、Karnofsky 評分、臨床分期及病理類型等基線資料比較,差異無統計學意義(P>0.05),具有可比性。見表1。
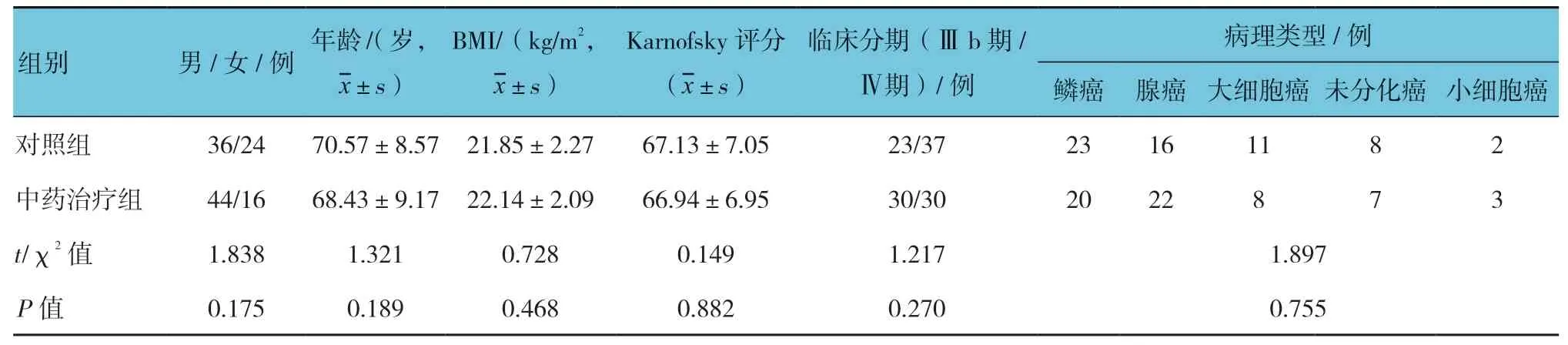
表1 兩組患者基線資料比較 (n=60)
1.2 方法
1.2.1 對照組所有患者接受GP 方案。GP 方案:第1~9 天使用鹽酸甲氧氯普胺(上海禾豐制藥有限公司,批號:Y140403)20 mg+地塞米松注射液(天津藥液集團新鄭股份有限公司,批號:1409202)5 mg 溶于250 ml 0.9% 氯化鈉注射液中;第1~9 天使用鹽酸昂丹司瓊(齊魯制藥有限公司,批號:1440021E2)8 mg 溶于100 ml 0.9%氯化鈉注射液中,1 次/d;第1~8 天使用吉西他濱(江蘇豪森藥業股份有限公司,批號:141005)1 g/m2,第1~5 天使用順鉑(齊魯制藥有限公司,批號:ZWA2A1405034A)30 mg/m2;第1~3 天使用維生素C(武漢健民藥業集團十堰康迪制藥有限公司,批號:20140829)2 g 加入500 ml 5%葡萄糖注射液中,1 次/d,共3 d;每3周為1 療程,連續治療4 個療程。
1.2.2 中藥治療組在化療的同時每天靜脈滴注復方苦參注射液(山西長治振東制藥股份有限公司,批號:20140914)20 ml 溶于250 ml 0.9%氯化鈉注射液中,1 次/d,每21 d 為1 療程,連續治療4 個療程。
1.3 療效評價
1.3.1 近期療效①瘤體評估標準:參照實體腫瘤的療效評價標準1.0 版(response evaluation criteria in solid tumors Version 1.0, RECIST V 1.0)[9]評估療效,根據病灶變化判定完全緩解(complete response, CR)、部分緩解(partial response, PR)、病情穩定(stable disease,SD)及病情進展(progressive disease, PD)。其中,CR和PR 患者病情至少穩定4 周以上。總有效率(%)=(CR+PR+SD)/總病例數×100%。②中醫臨床癥狀評估:根據《中藥新藥臨床研究指導原則》[10]觀察治療前后證候積分變化,包括咳嗽、咳痰、咯血、氣促、胸悶、胸痛、神疲、納呆、乏力及厭食共10 項癥狀,按輕重程度計為0~3 分,根據總積分判斷顯著緩解、緩解、穩定、無效。總緩解率(%)=(顯著緩解+緩解)/總病例數×100%。③Karnofsky 評分:由2 名腫瘤內科副主任醫師根據Karnofsky 評分表在雙盲前提下,為每例患者進行客觀評分。
1.3.2 遠期療效以患者死亡作為主要研究終點,記錄患者總生存期(overall survival, OS)。
1.4 免疫指標觀察
患者治療前和治療結束后次日采集肘靜脈血5 ml,置于抗凝管中,以2 000 r/min 離心15 min,取上清,加入紅細胞裂解液,過篩后采用CytoFLEX 型流式細胞儀器(美國貝克曼-庫爾公司)檢測CD4+、CD8+、CD4+/CD8+T 細胞表達的變化。試劑盒購自北京同生時代生物技術有限公司。
1.5 不良反應
治療期間密切關注患者的血常規、血生物化學、肝腎功能及營養狀態等指標的異常情況,記錄骨髓抑制、胃腸道不良反應、過敏、水腫及肝腎毒性等不良反應發生率。
1.6 統計學方法
數據分析采用SPSS 17.0 統計軟件。計量資料以均數±標準關(±s)表示,比較用t檢驗或重復測量設計的方差分析;計數資料以構成比或率(%)表示,比較用χ2檢驗,Kaplan-Meier 法繪制生存曲線,比較用Log-rank χ2檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 兩組患者臨床近期療效比較
兩組患者治療4 個療程后均未達到CR。兩組患者臨床治療總有效率比較,經χ2檢驗,差異無統計學意義(χ2=3.001,P=0.083)。見表2。
2.2 兩組患者中醫總體療效比較
兩組患者中醫臨床癥狀加重率比較,經χ2檢驗,差異有統計學意義(χ2=13.814,P=0.000),對照組高于中藥治療組。兩組患者中醫癥狀總緩解率比較,經χ2檢驗,差異有統計學意義(χ2=9.657,P=0.002),中醫治療組高于對照組。見表3。
兩組患者治療后咳嗽、咯血、神疲、納呆、乏力、厭食及總積分的下降、不變和升高構成比比較,經χ2檢驗,差異有統計學意義(χ2=6.508、6.420、7.070、4.910、12.079、7.351 和4.483,P=0.011、0.011、0.008、0.027、0.001、0.007 和0.034),中醫治療組患者下降構成比高于對照組。見表4。

表2 兩組患者近期療效比較 (n=60)

表3 兩組患者中醫總體療效比較 (n=60)
2.3 兩組患者Karnofsky 評分變化趨勢比較
中藥治療組與對照組治療前和治療1~4 個療程后的Karnofsky 評分比較,經重復測量設計的方差分析,結果:①不同時間點的Karnofsky 評分有差異(F=9.885,P=0.001);②兩組的Karnofsky 評分有差異(F=14.287,P=0.000),中藥治療組較對照組Karnofsky 評分高,相對功能狀態較好;③兩組的Karnofsky 評分變化趨勢有差異(F=6.781,P=0.001)。見表5。
2.4 兩組患者遠期預后比較
研究隨訪3~42 個月,中位隨訪時間31 個月。隨訪期間失訪13 例患者,包括5 例對照組患者和8 例中藥治療組患者。在完成隨訪的107 例患者中,68 例患者死亡,死亡率為63.55%。其中中藥治療組患者死亡率為50.0%(26/52),對照組患者死亡率為76.36%(42/55)。繪制Kaplan-Meier 生存曲線,中藥治療組和對照組患者中位生存時間分別為38.0 和26.0 個月,經Log-rank χ2檢驗,差異有統計學意義(χ2=6.532,P=0.011)。見圖1。
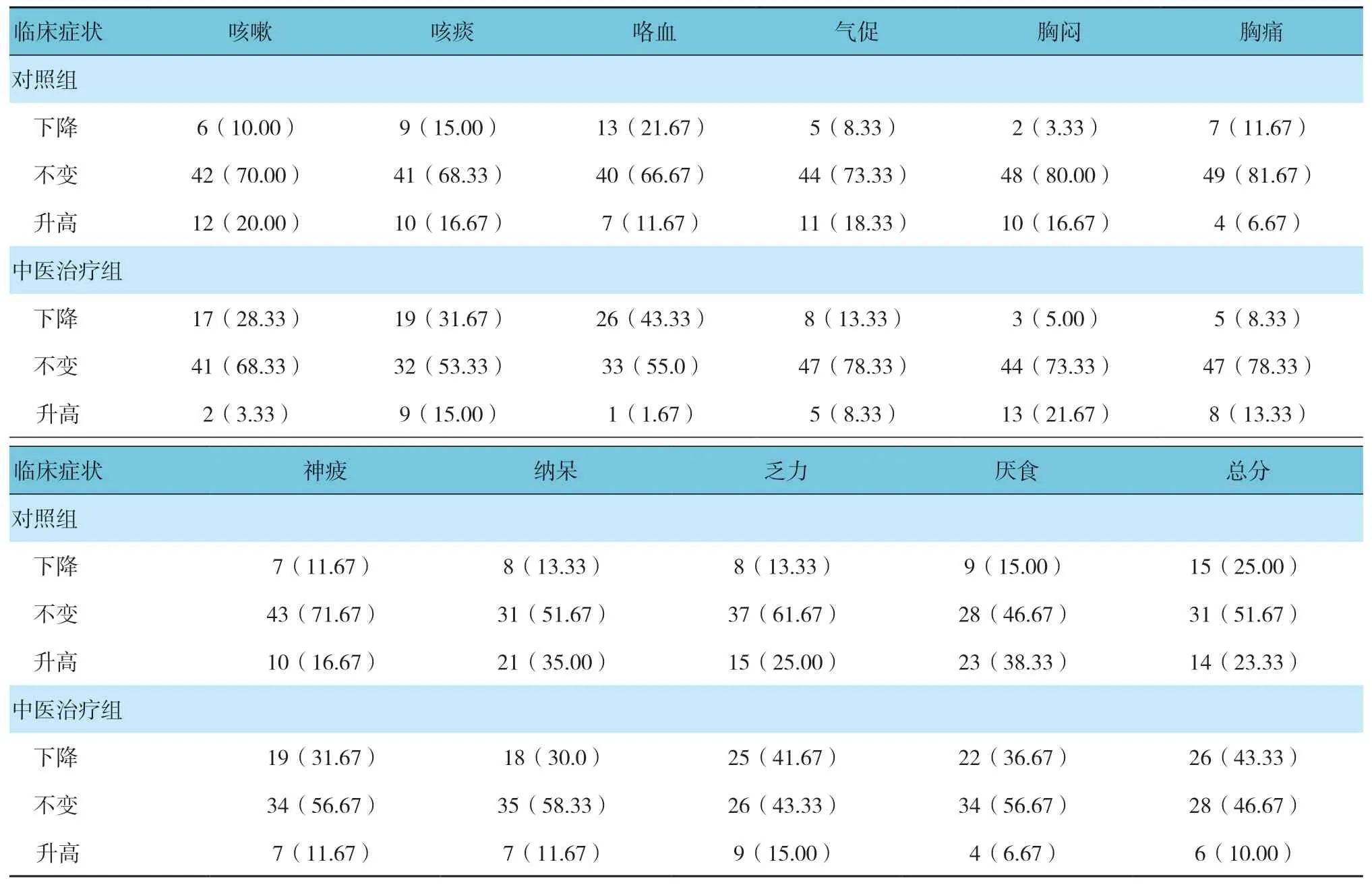
表4 兩組患者治療后中醫臨床癥狀評分比較 [n=60,例(%)]
表5 兩組患者Karnofsky 評分變化情況 (n=60,分,±s)

表5 兩組患者Karnofsky 評分變化情況 (n=60,分,±s)
注:?與治療前比較,P<0.05。
組別 治療前 治療1 個療程 治療2 個療程 治療3 個療程 治療4 個療程對照組 67.13±7.05 68.98±6.14 70.31±6.22 71.69±5.36 72.95±5.42中藥治療組 66.94±6.95 69.26±6.25 72.24±6.89 75.51±6.47? 80.36±5.85?
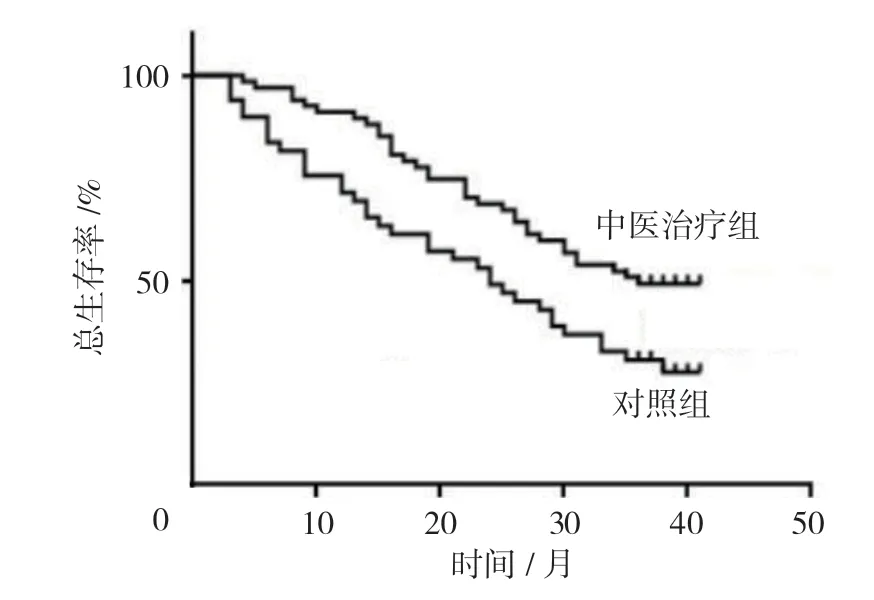
圖1 肺癌患者Kaplan-Meier 生存曲線
2.5 兩組患者治療前后CD4+ T 細胞百分比、CD8+ 細胞百分比和CD4+/CD8+的差值比較
兩組患者治療前后CD4+T 細胞百分比、CD8+細胞百分比和CD4+/CD8+的差值比較,經獨立樣本t檢驗,差異有統計學意義(P<0.05),中藥治療組患者治療后CD4+T 細胞百分比和CD4+/CD8+比例升高趨勢較對照組明顯,同時CD8+T 細胞百分比降低趨勢較對照組明顯。見表6。
2.6 兩組患者不良反應發生情況比較
兩組患者胃腸道反應、水腫和肝腎毒性發生率比較,經χ2檢驗,差異有統計學意義(P<0.05),中藥治療組低于對照組。兩組患者骨髓移植和過敏感應的發生率比較,差異無統計學意義(P>0.05)。見表7。
表6 兩組患者治療前后CD4+ T 細胞百分比、CD8+ 細胞百分比和CD4+/CD8+的差值比較 (n=60,±s)
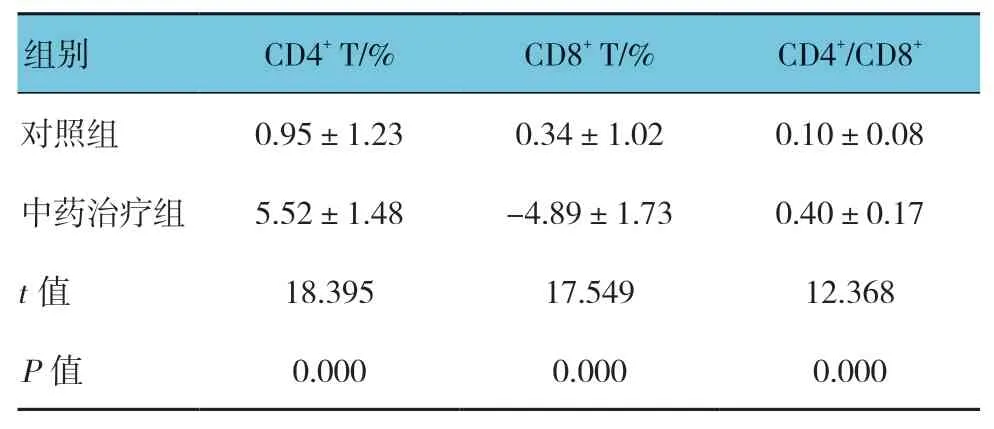
表6 兩組患者治療前后CD4+ T 細胞百分比、CD8+ 細胞百分比和CD4+/CD8+的差值比較 (n=60,±s)
組別 CD4+ T/% CD8+ T/% CD4+/CD8+對照組 0.95±1.23 0.34±1.02 0.10±0.08中藥治療組 5.52±1.48 -4.89±1.73 0.40±0.17 t 值 18.395 17.549 12.368 P 值 0.000 0.000 0.000

表7 兩組患者不良反應發生情況比較 [n=60,例(%)]
3 討論
中西醫結合是我國腫瘤治療的特色,不僅充分發揮西醫的細胞毒作用,也體現了中醫辨證論治、多活性、多靶點的優勢。與西醫“見瘤治瘤”的原則相比,中醫更注重祛邪不傷正,真正落實“以人為本”的理念。因此,隨著對腫瘤發病機制以及治療策略研究的深入,越來越多的專家和患者都意識到單一的治療手段和單一的療效評價標準都不能夠為患者提供最大的臨床獲益。
復方苦參注射液在惡性腫瘤治療方面已經有多年的臨床經驗,旨在發揮細胞毒作用,抑制腫瘤生長;同時又可聯合放化療發揮增效減毒的作用。段哲萍等[11]證實,復方苦參注射液通過阻滯細胞周期,促進細胞凋亡活性,進而有效地抑制Lewis 肺癌細胞的體外增殖,達到抗腫瘤目的。這主要是因為復方苦參注射液的主要成分為苦參堿類生物堿,可通過激活PI3K/Akt 信號通路、自噬相關通路等誘導腫瘤細胞凋亡[12];還可以通過抑制血管內皮生長因子、基質金屬蛋白酶及其他黏附因子的表達和分泌,進而抑制腫瘤細胞的侵襲、遷移及黏附活性。進而發揮抗癌作用。侯陳亮等[13]學者證實,復方苦參注射液可聯合阿帕替尼可提高非小細胞肺癌患者治療總有效率,同時降低不良反應的發生率。隋東江等[14]也認為,復方苦參注射液可有效地減輕原發性肺癌患者放射性肺損傷的發生,可作為理想的放療輔助用藥。北京航天總醫院的復方苦參注射液也是多數惡性腫瘤治療的常規用藥,符合說明書適應癥界定的范疇。但是更多的是作為放化療的輔助用藥,往往忽略了對患者帶瘤生存獲益的影響。
西醫治療理念一直是認為無瘤狀態是延長患者生存期的唯一條件,因此所有的西醫治療方法都是圍繞“見瘤治瘤”的原則進行。但是對晚期惡性腫瘤患者,已經不可能實現無瘤生存,而且最終導致患者死亡的主要原因往往并不是瘤體本身,而是患者生活質量的降低、免疫功能的下降,以及與治療相關的嚴重不良反應等。基于不能實現腫瘤根除的前提下,中醫學專家提出了“帶瘤生存”的概念,讓醫患雙方都接受與腫瘤和平共處的現實,這也是中醫治療中晚期惡性腫瘤的特色和優勢所在。
筆者基于多年的臨床經驗,建議在綜合考慮晚期肺癌患者身體條件、腫瘤分期及經濟狀況等多種因素的基礎上,通過采用復方苦參注射液聯合GP 化療方案實現“帶瘤生存”。因此在本研究中,筆者不僅以瘤灶變化作為近期療效的評價標準,同時也著重考察患者治療后臨床癥狀的改善、Karnofsky 評分的變化及帶瘤生存時間的延長。從多項指標證實,復方苦參注射液聯合GP 化療比單獨使用GP 化療方案可使晚期肺癌患者獲得更大的生存效益。這也間接證實瘤灶體積的縮小并不是唯一判定腫瘤治療療效的標準,需綜合考慮癥狀、生活質量及不良反應等各項指標。
另外,筆者也從免疫調節的角度分析了帶瘤生存的原因。有學者提出“穩化生、扶正氣、清瘤毒、調病絡”是中醫治療的重要理念,“正氣”即機體對毒邪的抵御能力,也就是現代醫學理論中的免疫功能[15]。本研究也證實復方苦參注射液可在一定程度上恢復會抵抗因化療導致的機體免疫功能降低,這也是符合中醫藥“扶正氣、清瘤毒”的治療理念。
綜上所述,復方苦參注射液聯合化療方案可提高晚期肺癌患者的臨床獲益。顯著改善中醫臨床證候,并有效調節患者T 細胞亞群,增強細胞免疫功能,以達到提高患者生活質量,降低化療相關毒副反應發生率的目的,并最終實現帶瘤生存。

