冷圈套器對4~15mm無蒂息肉的治療效果
張黎明 尤鵬 王俐 劉玉蘭
北京大學人民醫院消化內科(北京100044)
冷圈套器息肉切除技術(cold snare polypectomy,CSP)是一項適合于小息肉的比較安全的內鏡下息肉切除治療,歐洲胃腸內鏡學會(ESGE)指南建議冷圈套器(CSP)用于6~9mm無蒂或平坦結直腸息肉,而10~19mm無蒂或平坦息肉或有蒂息肉更適合采用圈套器通電息肉電切技術(hot snare polypectomy,HSP)[1]。多項研究已證實了6~9mm無蒂息肉使用CSP治療的安全性和有效性[2-8]。對于9 mm 以上無蒂息肉的治療,國外有部分研究證實了CSP的有效性[9-12]。我國比較CSP與HSP數據相對較少,文獻多集中于4~9mm無蒂小息肉冷圈套器治療的研究[13-15]。對于指南建議以外的直徑超過9 mm的無蒂息肉是否適合冷圈套器切除少有相關研究。基于既往國內外研究情況,本研究在為我國CSP切除結直腸息肉提供更多數據分析的同時,并重點評估中國人群中>9 mm息肉使用CSP治療安全性和有效性。本研究對355例CSP治療的無蒂息肉(巴黎分型Is型、Isp型、Ⅱa型)及245例HSP治療的無蒂息肉進行了回顧分析,同時還對78例10~15 mm CSP及95例10~15 mm HSP 進行了分析,進一步評估CSP對較大息肉治療的效果。
1 資料與方法
1.1 一般資料2017年1月至2019年7月于北京大學人民醫院接受結直腸息肉CSP及HSP治療患者。患者納入標準:(1)患者年齡>20歲;(2)接受CSP或HSP治療;(3)未服用抗血小板藥物或抗凝藥物,如服用阿司匹林者需停藥7 d,氯吡格雷需停藥5 d,華法林停用7 d,利伐沙班停用2 d。患者排除標準:(1)排除炎癥性腸病、消化道息肉病、息肉可疑癌變等;(2)服用抗血小板藥物或抗凝藥物或未按上述要求停藥者。息肉納入標準:(1)經CSP或HSP治療的4~15 mm結直腸息肉納入研究,(2)息肉形態按巴黎分型為Is型、Isp型、Ⅱa型。納入研究息肉排除標準:(1)息肉>15 mm或<4 mm,2.Ip型息肉。最終355例接受CSP治療息肉及245例接受HSP治療息肉納入研究,其中包括78例10~15 mm CSP及95例10~15 mm HSP。研究方案由北京大學人民醫院倫理委員會批準(倫理號:2018PHB019-01)。
1.2 方法由3位內鏡醫生完成所有治療,每位醫生有至少1 000例息肉切除經驗。所有息肉進行標準高清內鏡檢查,放大內鏡并不強制執行。三種圈套器用于操作內鏡切除,型號為SD-240U-10/15/25(Olympus公司)。當發現目標息肉時,病變大小應用張開的圈套器或活檢鉗測量,病變形態由巴黎分型定義。息肉經HSP或CSP切除,CSP過程為應用圈套器切除息肉及部分周邊黏膜,不使用粘膜下注射及電凝,切除息肉被吸入容器中回收或經五爪形異物鉗抓取出。部分HSP 行黏膜下注射后經高頻電切除,部分HSP 直接經高頻電切除,切除息肉被吸入容器中回收或經五爪形異物鉗抓取出。切除病變后,仔細沖洗和檢查創面邊緣,如果有組織殘留,應用圈套器、熱活檢鉗等技術處理殘留組織。預防性止血定義為電凝創面的血管殘端或應用鈦夾夾閉創面。完整切除評估選取病理可清楚評估切緣的標本,定義為病理標本切緣無腺瘤殘留,部分標本病理無法評估切緣的定義為切緣模糊。切除時間定義為從置入圈套器進入工作通道到息肉切除結束;對于行黏膜下注射的HSP 病例,時間測量從插入注射針入活檢孔道至息肉切除結束。即時出血定義為電切后持續出血>60 s。遲發出血定義為結束治療退鏡后出血并要求內鏡治療。腸道準備應用聚乙二醇電解質溶液。病理標本由2名病理醫生檢測,2名醫生對治療信息不了解。病理標本經蘇木素伊紅染色評價病變性質以及水平切緣。
1.3 觀察指標(1)并發癥發生情況:包括即時出血率,遲發出血率,即時穿孔率,遲發穿孔率;(2)平均治療時間;(3)病變完整切除率;(4)病變回收率;(5)應用熱活檢鉗或圈套器追加處理創面殘留組織情況。
1.4 統計學方法統計學分析使用SPSS 22.0 軟件,應用χ2檢驗進行率的比較,應用t檢驗進行平均值比較,P<0.05 差異有統計學意義。
2 結果
對全部355例CSP治療息肉與245例HSP治療息肉進行比較,CSP組即時出血率為2.8%,HSP組為0.4%,兩者差異有統計學意義,但最終兩組的遲發出血率均為0,最終均不需要內鏡干預止血。兩組均無穿孔發生。CSP組平均治療時間為(56.78±7.08)s,HSP組平均治療時間為(96.08±10.59)s,CSP組顯著低于HSP組。但HSP 無注射組平均治療時間為(57.48±7.31)s,與CSP組平均治療時間相比差異無統計學意義。CSP組完整切除率為93.8%,HSP組完整切除率為95.9%,兩組差異無統計學意義。病變回收率(89.9%vs.90.3%),差異無統計學意義。見表1、3。
在10~15 mm 病變組,對78例CSP與95例HSP 進行比較,CSP組平均治療時間為(59.74±8.69)s,HSP組平均治療時間為(95.78±10.77)s,CSP組顯著低于HSP組。但HSP 無注射組平均治療時間為(60.33±9.05)s,與CSP組平均治療時間相比差異無統計學意義。兩組病變即時出血率(6.4%vs.1.1%)、遲發出血率(0%vs.0%)、穿孔發生率(0%vs.0%),完整切除率(95.7%vs.95.7%)、病變回收率(84.6%vs.86.3%),差異均無統計學意義,見表2。
3 討論
歐洲胃腸內鏡學會(ESGE)指南建議冷圈套器(CSP)用于6~9mm無蒂或平坦結直腸息肉。本研究結果不但證實中國人群中冷圈套器在4~9mm無蒂息肉切除的有效性及安全性,同時還證實了在10~15mm無蒂息肉切除中的有效性及安全性。
POHL 等[16]息肉切除后應用活檢鉗鉗取創面邊緣組織評估CSP切除后息肉的不完整切除率,5~7 mm息肉及8~9 mm息肉CSP切除后不完整切除率分別為5.8%和9.4%。KIM 等[17]報道應用EMR 評估冷圈套器切除息肉的不完整切除率,發現≤7 mm息肉冷圈套器的完整切除率為96.6%。另有多項研究報道CSP的組織學完整切除率在93.2%~99%[17-19]。一項日本多中心隨機對照研究顯示CSP 對于4~9 mm 結直腸息肉的完整切除率并不低于HSP,CSP完整切除率為98.2%,HSP完整切除率為97.4%[20]。本研究結果顯示,在所有納入研究的4~15 mm的病變中,在能夠進行病理完整評估水平切緣的CSP及HSP 標本中進行對比,CSP組完整切除率為93.8%,HSP組完整切除率為95.9%,兩者差異無統計學意義。
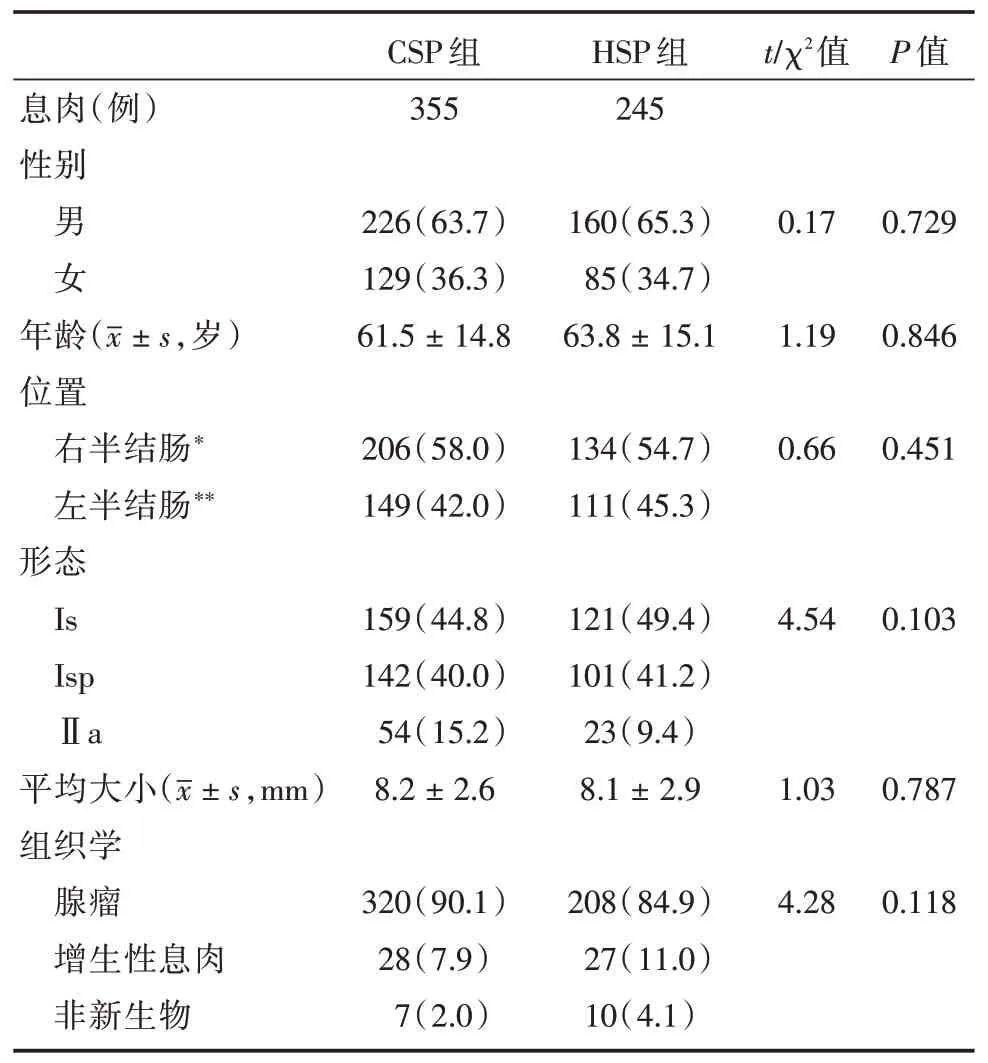
表1 全部CSP組與HSP組患者臨床特征及切除息肉的內鏡及組織學特征Tab.1 Clinical,endoscopic and histological characteritics of CSP group and HSP group with total lesions例(%)
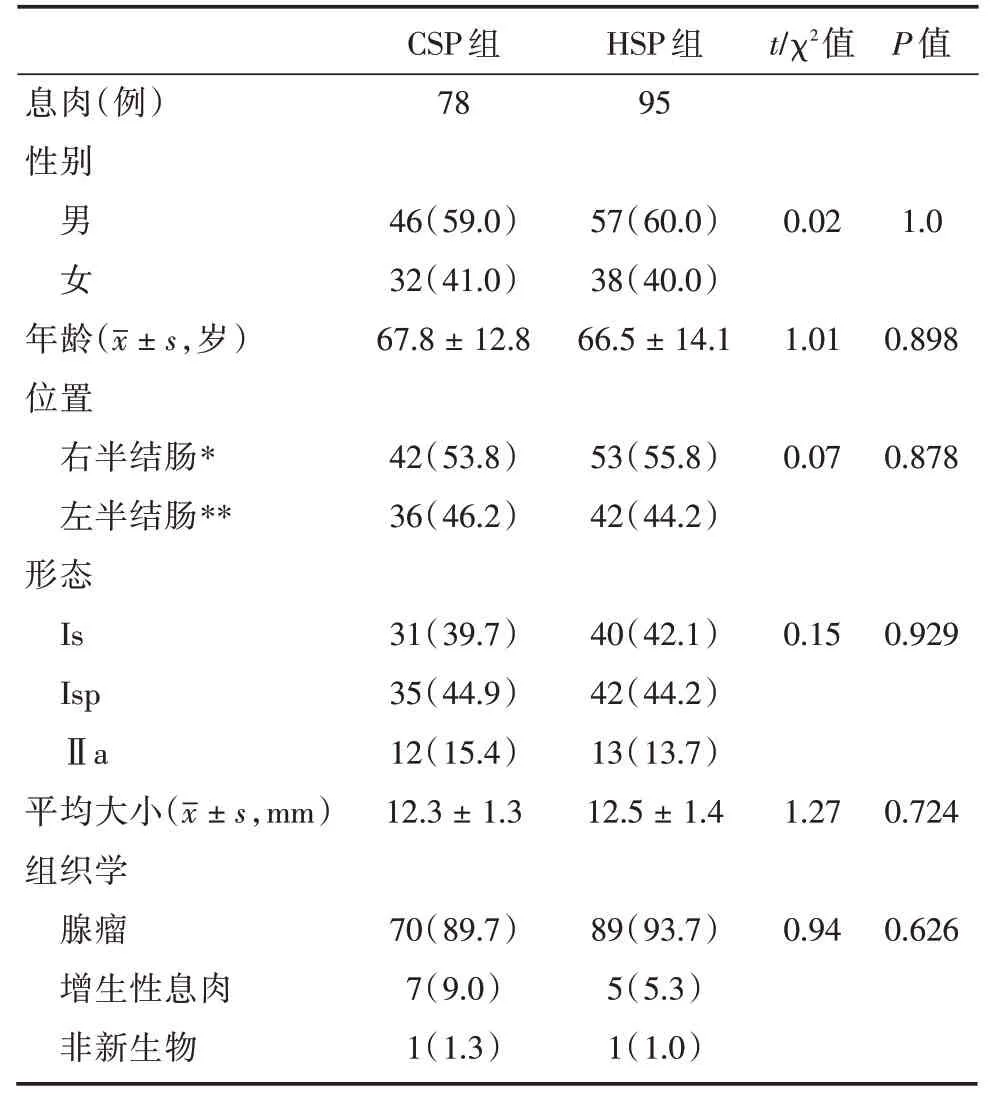
表2 10~15 mm CSP與HSP患者臨床特征及切除息肉的內鏡及組織學特征Tab.2 Clinical,endoscopic and histological characteritics of CSP group and HSP group with polyps sized 10~15 mm例(%)
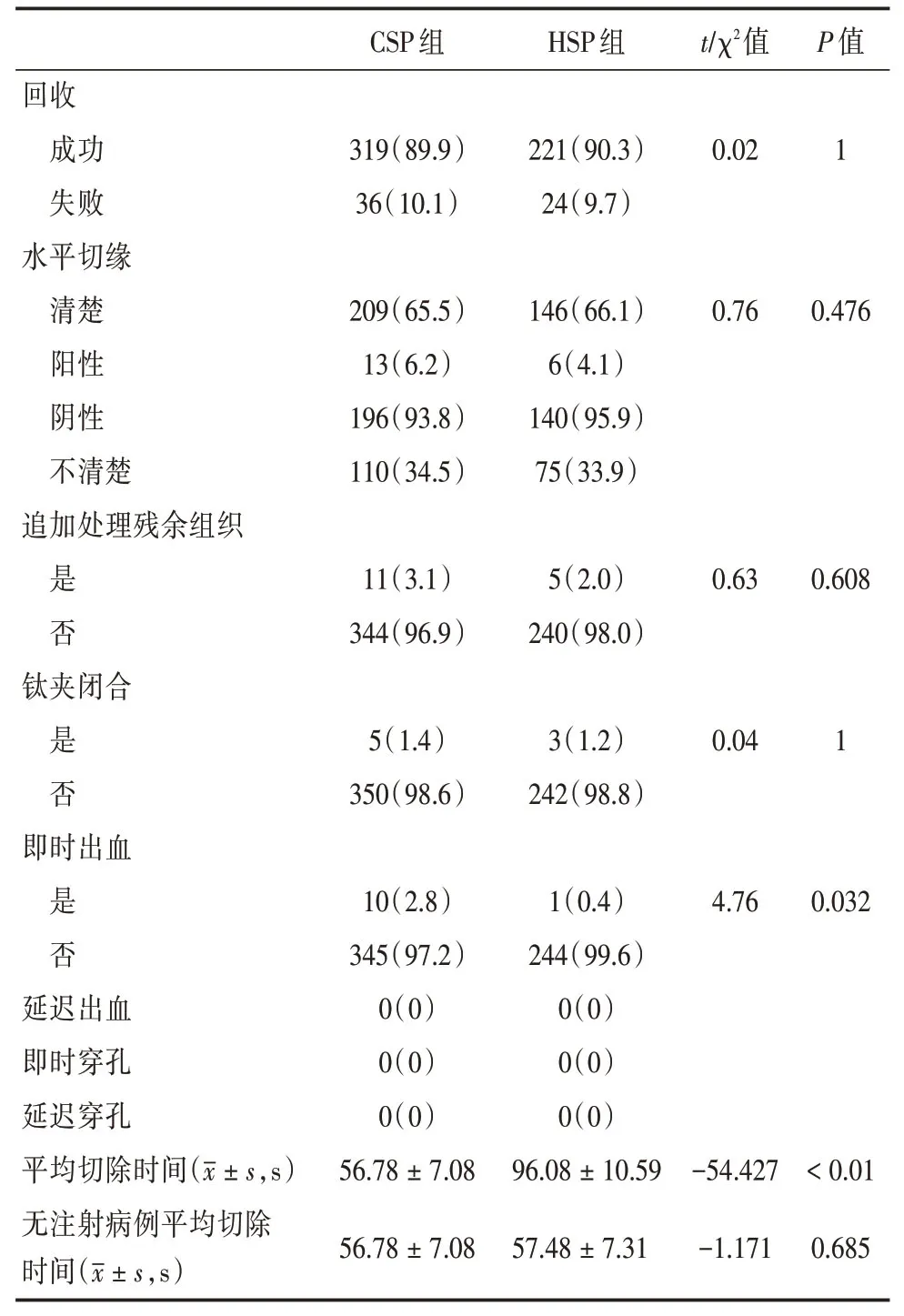
表3 全部CSP息肉與全部HSP息肉治療情況比較Tab.3 Outcomes and adverse events of CSP group and HSP group with total lesions例(%)
SCHETT等[21]報道1 233例CSP中,遲發出血率為0.49%。還有文獻報道對1 015例<10 mm的息肉行CSP術后,未出現遲發出血[22]。前面提到的日本多中心隨機對照研究報道在HSP組(346例息肉)有2例遲發出血,而在CSP組(341例息肉)無遲發出血患者,兩組遲發出血率類似[20]。還有日本研究報道CSP 遲發出血率低于HSP組,兩者差異有統計學意義[23]。另有文獻報道在使用抗凝藥物治療患者中CSP組遲發出血率較低[24]。本研究CSP組與HSP組遲發出血率均為0,說明在目前技術條件下,兩種治療發生遲發出血的幾率均很低。總體來講,CSP與HSP患者遲發出血率均較低,都是安全的治療方式。但是對于有蒂息肉,因為息肉蒂內部往往有較粗大血管,遲發出血風險較大,而冷圈套器使用過程中無電凝止血過程,故使用冷圈套器應謹慎。本研究在所有納入研究的4~15 mm的無蒂病變中,CSP與HSP組在遲發出血率上差異無統計學意義。
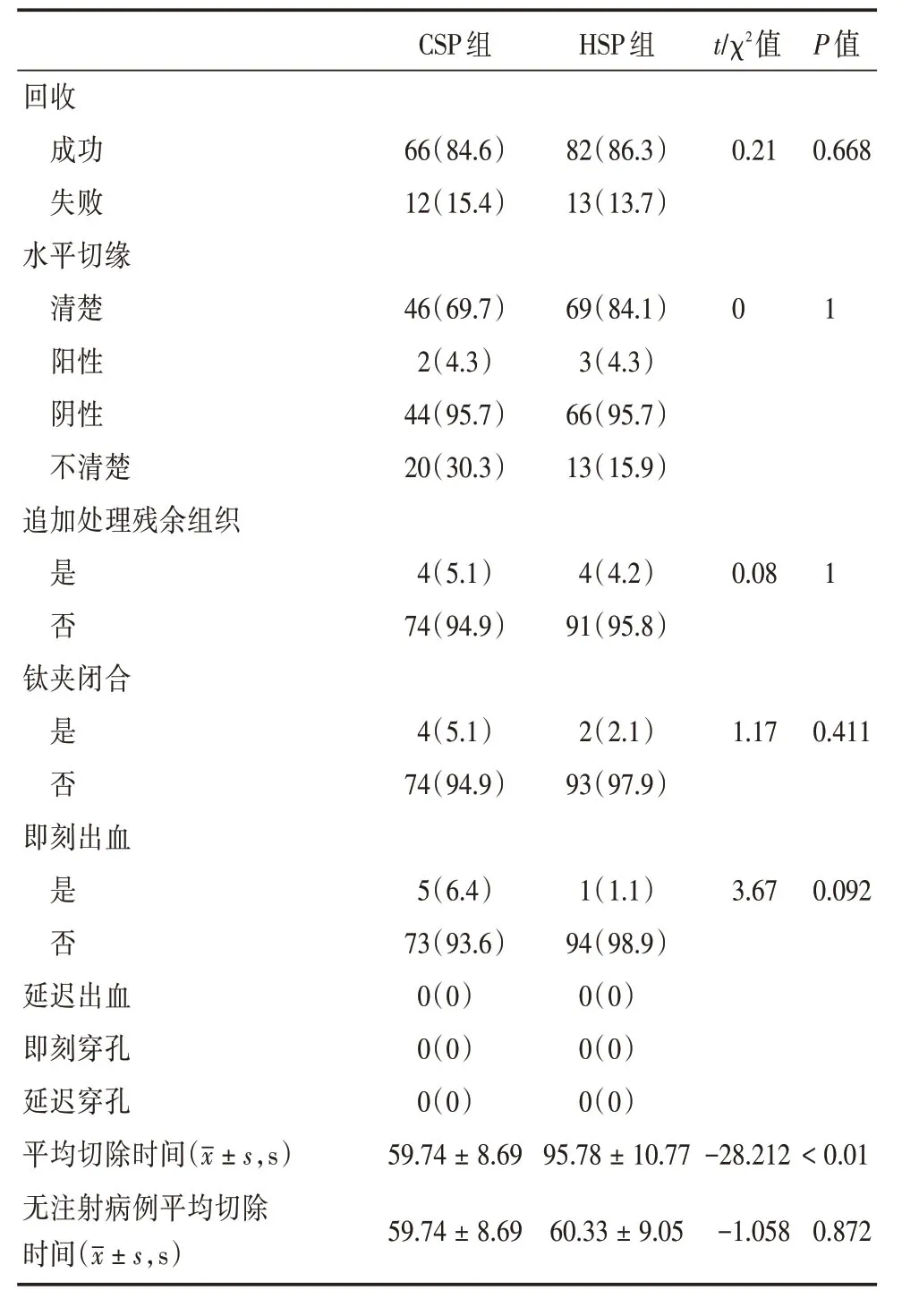
表4 10~15 mm組CSP與HSP息肉治療情況比較Tab.4 Outcomes and adverse events of CSP group and HSP group with polyps sized 10~15 mm例(%)
關于即時出血,日本文獻報道CSP組即時出血率高于HSP組(7.1%vs.3.5%,P=0.022),但所有即時出血均被內鏡下止血手段成功處理,故最終兩組遲發出血率無明顯差別[20]。本研究在所有納入研究的4~15 mm的病變中,CSP組即時出血率為2.8%,需要鈦夾或熱活檢鉗等手段進一步止血,HSP組為0.4%,兩者差異有統計學意義(P=0.032),但最終兩組的遲發出血率均為0。
日本文獻報道CSP組治療時間明顯低于HSP組,但在HSP 無注射組中治療時間與CSP組接近[20,24]。本研究在所有納入研究的4~15 mm的病變中CSP組平均治療時間為(56.78±7.08)s,HSP組平均治療時間為(96.08±10.59)s,CSP組顯著低于HSP組(P<0.01)。但未行黏膜下注射HSP病例平均治療時間與CSP組無顯著差異。為預防遲發穿孔,HSP 常行黏膜下注射,而CSP 不存在高頻電致遲發穿孔風險,故CSP組治療時間總體較HSP組有所縮短。
對于>10 mm 病變,有Meta分析顯示,冷圈套器切除全部并發癥發生率為1.1%,術中及術后出血率分別為0.7%及0.5%,術后腹痛發生率為0.6%。在>20 mm 病變中冷圈套器切除有略高的術中出血率及術后腹痛發生率,分別為1.3%及1.2%,但無遲發出血及遲發穿孔,完整切除率為99.3%[25]。另有研究提示,對于11~20 mm的病變,冷圈套器完整切除率為81.8%,而高頻電切完整切除率為80.9%,病變回收率冷圈套器為100%,而高頻電切為99%,并發癥發生率冷圈套器為0,而高頻電切為1%,差異均無統計學意義[26]。歐洲胃腸內鏡學會(ESGE)指南建議冷圈套器(CSP)用于6~9mm無蒂或平坦結直腸息肉[1],本研究對冷圈套器在指南建議以外的10~15 mm 病變中進行了研究,顯示在排除了Ip型息肉的10~15 mm 病變中,CSP與HSP 在病變回收率、完整切除率上并無差異。CSP與HSP組在即時出血率、遲發出血率、即時和遲發穿孔率上均無顯著差異。在10~15 mm 病變中,CSP組平均治療時間為(59.74±8.69)s,HSP組平均治療時間為(95.78±10.77)s,CSP組顯著低于HSP組(P<0.01)。
本研究的特色和創新點在于對ESGE 指南建議以外的直徑10~15mm無蒂息肉CSP治療效果進行了研究,并與HSP 進行了比較,這一部分國內相關研究很少。本研究在中國人群中證實了CSP在治療ESGE 指南建議以外的10~15 mm 較大無蒂息肉中仍然具有良好的治療效果和安全性。同時本研究也再次證實在中國人群中4~9 mm 小息肉使用冷圈套器治療的安全性和有效性。
本研究的局限性:(1)本研究為回顧性分析,有必要開展前瞻性隨機對照研究對CSP與HSP 做進一步比較。(2)本研究10~15 mm息肉CSP組和HSP組的病例數相對較少,可以進一步擴大病例數。(3)本研究排除了服用抗凝或抗血小板藥物患者,對這部分患者缺乏研究數據,CSP及HSP 對于服用抗凝或抗血小板藥物患者的治療效果比較可以作為進一步研究的方向。
總結本研究結果,在4~15 mm 病變中CSP與HSP 相比在病變回收率、完整切除率上無明顯差異,雖即時出血率略高,但在遲發出血及穿孔并發癥發生率上差異無統計學意義。在10~15 mm病變中在病變回收率、完整切除率及并發癥發生率上差異均無統計學意義。冷圈套器切除在4~15 mm 非Ip型結腸息肉中是一種安全的治療方式,且CSP 操作較HSP 省時,可節省治療時間,有廣泛推廣使用的意義。接下來需要前瞻性隨機對照研究對兩種治療做進一步比較。

