花生肽亞鐵胃腸仿生消化產物對金黃色葡萄球菌的抑菌機理
肖懷秋,李玉珍,林親錄,劉軍,姜明姣,趙謀明
1(湖南化工職業技術學院 制藥與生物工程學院,湖南 株洲,412000)2(中南林業科技大學 食品科學與工程學院,湖南 長沙,410004)3(湖南中威制藥有限公司,湖南 株洲,412000)4(華南理工大學 食品科學與工程學院,廣東 廣州,510000)
Antibacterialmechanismofgastrointestinalbiomimeticdigestantsfrompeanutpeptide-ferrousonStaphylococcusaureus
XIAO Huaiqiu1,4,LI Yuzhen1*,LIN Qinlu2,LIU Jun1,JIANG Mingjiao3,ZHAO Mouming4
1(School of Pharmaceutical and Bioengineering, Hunan Chemical Vocational Technology College, Zhuzhou 412000, China)2(College of Food Science and Engineering, Central South University of Forestry and Technology, Changsha 410004, China)3(Hunan Zonwe Pharmaceutical Co., Ltd., Zhuzhou 412000, China)4(College of Food Science and Engineering, South China University of Technology, Guangzhou 510000, China)
ABSTRACTTo explore the potential of peanut peptide ferrous (PPF) gastrointestinal bionic digestants (GBDs) as an antibacterial agent, antibacterial activity (ABA), surface hydrophobicity (SHP), minimum inhibitory concentration (MIC), cell membrane permeability (CMP), the extracellular leakage of ultraviolet absorption biomacromolecules and K+were studied. The results showed that the ABA of PPF can be enhanced by gastrointestinal biomimetic digestive treatment. The SHP attained its’ peak at 270 min. Simulated intestinal fragment (SIF4) at the concentration of 0.2×10-3g/L (MIC) exerted a significant bacteriostatic effect onStaphylococcusaureus(S.aureus). There were significant differences (P<0.05) for these indices such as CMP, extracellular leakage of ultraviolet absorption biomacromolecule and K+between the experimental group and the control group. After being treated using 1/2 MIC,1/4 MIC and MIC, the extracellular leakage of intracellular K+ofS.aureusincreased with the elongation of incubation time, especially for the MIC group. Research inferred that the cell membrane ofS.aureuscan be damaged after being treated with different concentrations of SIF4, which causes the cell membrane perforation and make the leakage of bioactive biomacromolecules such as protein and nucleic acid, and resulting in bacterial necrosis and exerting a good antibacterial activity. All results indicated that peanut peptide-ferrous gastrointestinal bionic digestants (GBDs) can service as a potential new polypeptide metal antibacterial agent used in food industry.
Keywordspeanut peptide ferrous (PPF); metal peptide; gastrointestinal biomimetic digestants (GBDs); food antibacterial peptide (FABP); antimicrobial mechanism
抗菌肽一般由10~60個氨基酸殘基組成,具有熱穩定性好、抗菌活性高、特異性強、生物毒性低、副作用較少且不易產生耐藥性等優勢,有望成為抗生素理想替代品[1]。近幾年,抗菌肽(或金屬抗菌肽)備受關注,如YE等[2]從花生種子提取液分離得到的抗菌肽Hypogin具有較好抗真菌活性;付云等[3]從螺旋藻渣發酵液分離的抗菌肽SP-AP-1和Iturin A均表現良好的金黃色葡萄球菌抑菌活性;SHIN等[4]合成的具有β-轉角的十二肽對大腸桿菌和枯草芽孢桿菌有良好抑菌活性;鄧尚貴等[5]制備的魚蛋白肽亞鐵(80%乙醇分級沉淀物)對枯草芽孢桿菌和金黃色葡萄球菌有顯著抗菌效果;林慧敏等[6]對舟山海域4種低值魚進行酶解,酶解物均無抑菌活性,但經亞鐵螯合修飾后均表現出對金黃色葡萄球菌、大腸桿菌和枯草芽孢桿菌不同程度抑菌活性;楊玉蓉等[7]制備的桃仁多肽亞鐵螯合物(PKP3-Fe)對大腸桿菌和金黃色葡萄球菌有很好的抑菌作用。金黃色葡萄球菌是自然界廣泛存在的G+球菌[8],易造成乳制品、水產品及肉類加工制品污染并產生腸毒素而造成食物中毒[9],抑制其在食物中增殖,對保障食品安全有重要意義。花生肽亞鐵作為一種金屬肽,可作為一種潛在的抑菌劑進行研究。目前,除本課題組[10-12]外,對花生肽亞鐵研究較少,特別是其抑菌活性研究未見報道。本試驗系統研究了花生肽亞鐵(peanut peptide ferrous,PPF)及其胃腸仿生消化產物(gastrointestinal bionic digestants,GBDS)對金黃色葡萄球菌抑菌活性并對抑菌機理進行了初步研究,以期為花生肽亞鐵抑菌劑開發提供理論與技術支持。
1 材料與方法
1.1 材料與設備
花生肽亞鐵(PPF),由本課題組[12]制備;胃蛋白酶、胰蛋白酶,諾維信(中國)生物技術有限公司;溴酚藍(分析純),國藥集團化學試劑有限公司;牛肉膏、胰蛋白胨(生化級),北京博星生物技術有限公司;金黃色葡萄球菌ATCC25923,本實驗室保存。
牛肉膏蛋白胨培養基(g/L):牛肉膏3.0,蛋白胨10.0,NaCl 5.0,pH 7.0,121 ℃滅菌20 min。添加20 g/L瓊脂即為固體培養基。
DDS-307型電導率儀,上海雷磁儀器廠;UV-2500紫外可見分光光度計,日本島津;HERMLE Z323K冷凍離心機,德國Hermle公司;H1650臺式高速離心機,湘儀離心機儀器有限公司。
1.2 試驗方法
1.2.1 人胃腸仿生消化過程
準確稱取10.0 mg花生肽亞鐵加入至1 000 mL胃仿生消化液中,(37±0.5) ℃、100 r/min仿生消化2 h,每隔30 min取樣,命名為胃仿生消化產物(simulated gastric fragment,SGF1~SGF4);用0.5 mol/L NaOH調pH至7.6終止胃仿生消化,用十二指腸仿生消化液(37±0.5) ℃、50 r/min條件下仿生消化1 h,每間隔30 min取樣,命名為十二指腸仿生消化產物(simulated duodenal fragment,SDF1~SDF2);調節pH至6.8,(37±0.5)℃、50 r/min條件下仿生小腸消化3 h,每間隔30 min取樣檢測,命名為小腸仿生消化產物(simulated intestinal fragment,SIF1~SIF6);不同胃腸仿生階段消化液經冷凍干燥后備用。模擬胃腸仿生消化液配制參考《中國藥典》(2010版)配制。
1.2.2 抑菌活性測定
準確吸取0.1 mL菌懸液(6×108CFU/mL)均勻涂布在培養基表面,將滅菌后的4只牛津杯置于培養皿中并分別加入0.1 mL質量濃度為0.1、0.2、0.4 和0.8×10-3g/L花生肽亞鐵或仿生消化產物。為使試液充分擴散到瓊脂層,將培養皿于4 ℃放置2 h后于37 ℃培養24 h,用游標卡尺測定抑菌圈直徑并用平均直徑(mm)表示抑菌活性[13]。
1.2.3 表面疏水性測定
準確移取1 mL 0.01 g/L花生肽亞鐵或仿生消化產物,加入200 μL 1 g/L溴酚藍,以磷酸鹽緩沖溶液為對照,于6 000×g離心15 min,取上清液稀釋10倍,測定A595nm。表面疏水性用溴酚藍結合量表示[14],如公式(1)所示:
(1)
式中:AC為對照樣品在595 nm的吸光值;AS為測試樣品在595 nm的吸光值。
1.2.4 最小抑菌濃度測定
準確吸取1.0 mL質量濃度為1.0×10-3g/L的花生肽亞鐵或仿生消化產物加入培養皿中,倒入牛肉膏蛋白胨培養基并充分混勻,待凝固后準確吸取0.1 mL金黃色葡萄球菌(6×108CFU/mL)于培養皿中并涂布均勻,37 ℃培養24 h,菌落被完全抑制的最低濃度即為該試樣最小抑菌濃度(minmum inhibitory concentration,MIC)。
1.2.5 抑菌曲線繪制
將培養至對數生長中期(16 h)的金黃色葡萄球菌稀釋至107CFU/mL,添加SIF4使終質量濃度為0.2×10-3g/L(MIC),制備成菌懸液,37 ℃、100 r/min振蕩培養36 h,每間隔2 h取樣5 mL,5 000 r/min離心15 min,棄上清液,加入無菌水制成菌懸液并測定A600nm[15]。
1.2.6 對細胞膜滲透性的影響
將培養至對數生長中期的菌體制備成A600nm=0.5的菌懸液。取5 mL菌懸液于5 000 r/min離心10 min,取上清液2 mL并加入無菌水8 mL,測定電導率(L2);取菌懸液5 mL和濃度為MIC、1/2 MIC和1/4 MIC的SIF45 mL作用24 h,離心后取上清液2 mL加入無菌水8 mL并測定電導率(L3);取5 mL濃度為MIC、1/2 MIC和1/4 MIC的SIF4與5 mL生理鹽水混勻,取2 mL加入無菌水8 mL,測定電導率(L1);將金黃色葡萄球菌煮沸10 min,冷卻至室溫后作為對照并測定電導率(L0)[15]。相對電導率計算如公式(2)所示:
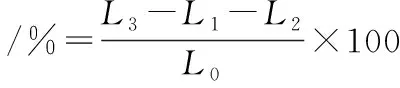
(2)
1.2.7 對紫外吸收物質滲透性的影響
取培養至對數生長中期的培養液10 mL,5 000 r/min離心10 min,收集菌體,用5 mmol/L滅菌磷酸緩沖液(pH 6.5)清洗3次,與終濃度為MIC、1/2 MIC和1/4 MIC的SIF437 ℃溫育18 h,每間隔2 h取樣5 mL于5 000 r/min離心15 min,上清液用0.22 μm的濾膜過濾除菌并分別測定A260nm和A280nm[15]。
1.2.8 對胞內K+泄漏的影響
向培養至對數生長中期的菌懸液(1×108CFU/mL)中加入仿生消化產物SIF4,使終濃度為MIC、1/2 MIC和1/4 MIC,37 ℃共同溫育60 min,每間隔10 min取樣1次,10 000 r/min離心10 min,取上清液用原子吸收光譜法測定K+濃度[3]。
1.2.9 試驗數據處理
2 結果與分析
2.1 花生肽亞鐵及其胃腸仿生消化產物抑菌活性分析
花生肽亞鐵及其仿生消化產物抑菌活性如表1所示。

表1 花生肽亞鐵及仿生化產物抑菌活性 單位:mm
由表1可知,花生肽亞鐵及胃仿生消化90 min內消化產物在0.8×10-3g/L時表現抑菌活性;胃仿生消化120 min和十二指腸仿生消化150 min時,質量濃度為0.4×10-3g/L的消化產物開始表現抑菌活性;十二指腸仿生消化180 min和小腸仿生消化210~270 min段的消化產物在0.2×10-3g/L時也開始表現抑菌活性;小腸仿生消化300 min后產物均具有較好抑菌活性,且抑菌活性與仿生消化產物質量濃度成良好正相關關系;同一質量濃度仿生消化產物(如0.8×10-3g/L),抑菌活性隨仿生消化進行呈遞增趨勢,各階段仿生消化產物抑菌活性有顯著差異(P<0.05),其他幾個濃度的仿生消化產物抑菌活性也呈遞增趨勢,差異顯著(P<0.05)。由此可知,花生肽亞鐵經胃腸仿生消化后抑菌活性可得到顯著增強。
2.2 仿生消化對表面疏水性的影響
仿生消化對花生肽亞鐵表面疏水性的影響如圖1所示。

圖1 花生肽亞鐵及其仿生消化產物表面疏水性Fig.1 The surface hydrophobicity of PPF and GBDs注:圖中不同小寫字母表示差異顯著(P< 0.05)(下同)
由圖1可知,仿生消化產物表面疏水性呈遞增趨勢。胃仿生消化30 min時,消化產物表面疏水性(7.64±0.64) μg與未仿生消化花生肽亞鐵表面疏水性(7.12±0.58) μg差異不顯著;胃仿生消化120 min時表面疏水性顯著增加至(11.46±0.41)μg(P<0.05);十二指腸仿生消化階段120~180 min和小腸仿生消化240 min時,表面疏水性增幅不顯著(P>0.05);消化270 min時,消化產物表面疏水性達到最大(15.84±0.33) μg,隨后消化產物表面疏水性增幅不顯著,說明仿生消化270 min時疏水性基團充分暴露,研究結果與CHEN等[17]一致。AMADOU等[18]認為,多肽表面疏水性與抗菌活性有重要關系,LEE等[19]和YE等[20]研究也發現,多肽疏水基團暴露有利于抗菌活性發揮。
2.3 最小抑菌濃度(MIC)分析
花生肽亞鐵及其仿生消化產物MIC分析結果如表2所示。

表2 花生肽亞鐵及其仿生消化產物最小抑菌濃度Table 2 Minimum inhibitory concentration (MIC) of PPF and GBDs
由表2可知,仿生消化不同程度增強了花生肽亞鐵的抗菌活性。花生肽亞鐵和胃仿生消化30~60 min產物的MIC為0.8×10-3g/L;胃仿生消化90 min產物MIC為0.5×10-3g/L;仿生消化120~150 min產物MIC為0.4×10-3g/L;仿生消化180~270 min的消化產物MIC降至0.3×10-3g/L;小腸仿生消化300 min后,MIC均為0.2×10-3g/L。結合消化產物表面疏水性變化趨勢,花生肽亞鐵抑菌活性變化與表面疏水性變化基本一致,與LEE等[19]和JIANG等[21]報道相似。考慮到小腸仿生消化300 min(SIF4)及隨后消化產物表面疏水性和MIC變化不明顯,后續試驗采用SIF4進行抑菌機理研究,MIC確定為0.2×10-3g/L。
2.4 抑菌曲線
MIC組與對照組生長曲線如圖2所示。

圖2 花生肽亞鐵及其仿生消化產物抑菌曲線Fig.2 Antibacterial curve of PPF and GBDs
由圖2可知,MIC組培養0~6 h時與對照組相比生長差異不顯著(P<0.05),培養8 h后,MIC組與對照組均呈現顯著性差異(P<0.05);對照組在培養16~18 h進入到對數生長中期,24 h和30 h分別進入穩定期和衰亡期,而MIC組菌體生長慢,培養20 h時達到生長高峰(A600nm=0.52),僅為對照組最高值的39.83%,由此可知,MIC濃度的SIF4對菌體生長有明顯抑制。研究還發現,對照組穩定期維持時間相對較長,而MIC組不僅生長相對緩慢,培養20 h后也逐漸進入衰亡期,相比對照組衰亡時間提前,林慧敏[15]在研究帶魚蛋白肽亞鐵螯合物時也得到類似結論。
2.5 對細胞膜滲透性的影響
花生肽亞鐵及其仿生消化產物對細胞膜滲透壓的影響如圖3所示。相對電導率是衡量細胞膜透性的重要指標,數值越大表示胞內電解質滲漏越多,反映細胞膜受損越明顯[22]。由圖3可知,試驗組與對照組有顯著差異(P<0.05),特別是MIC組。MIC組與1/2 MIC和1/4 MIC組也存在顯著差異(P<0.05);細胞膜受損程度隨SIF4處理時間延長而增加,其可能機理是由于花生肽亞鐵的疏水性C端嵌入膜內疏水區引起膜上蛋白質構象改變,使細胞膜裂解并促使膜內離子外逸,或與細胞膜相互作用形成瞬態孔隙和離子通道并使胞內離子外逸[23],現有研究發現,抑菌肽對真核生物正常細胞影響較小[24]。

圖3 花生肽亞鐵及其仿生消化產物對細胞膜滲透性的影響Fig.3 The effect of PPF and GBDs on cell membrane permeability
2.6 對胞內紫外吸收物質泄露的影響
花生肽亞鐵及其仿生消化產物對胞內紫外吸收物質泄露的影響如圖4所示。

a-A280nm測定結果;b-A260nm測定結果圖4 花生肽亞鐵及其仿生消化產物對紫外吸收物質泄露的影響Fig.4 The effect of PPF and GBDs on leakage of ultraviolet absorbing substances
蛋白質與核酸最大吸收波長為280 nm和260 nm,吸收值大小可反映胞內紫外吸收物質含量[25]。由圖4-a可知,隨著加入到樣品中SIF4增多,胞內蛋白質泄露增加,MIC組與1/4 MIC組和1/2 MIC組差異顯著(P< 0.05);由圖4-b可知,胞內核酸物質泄露存在類似現象。試驗表明,金黃色葡萄球菌經SIF4處理后,細胞膜遭到不同程度損傷,造成細胞膜穿孔,胞內蛋白質與核酸等紫外吸光大分子物質泄露,進而引發細胞壞死[3,26],可能是由于Fe2+與菌體細胞接觸后,帶負電荷的細胞壁脂多糖與Fe2+正電荷相吸,使多肽金屬絡合物穿透細胞壁進入菌體,并與膜蛋白質或胞內蛋白質和核酸結構中活性基團(如—NH2、—SH等)發生反應,破壞細胞膜和影響活性生物大分子結構,進而擾亂細胞代謝發揮抑菌活性[27]。
2.7 對胞內K+泄漏的影響
花生肽亞鐵及其仿生消化產物對胞內K+泄露影響如圖5所示。

圖5 花生肽亞鐵及其仿生消化產物對胞內K+泄露的影響Fig.5 The effect of PPF and GBDs on intracellular potassium leakage
細胞內K+泄露與細胞膜完整性有重要關系,泄露程度可反映細胞膜損傷程度[28]。由圖5可知,試驗組與對照組存在顯著差異(P< 0.05);對照組胞內K+檢測濃度極低,試驗組隨SIF4添加量的增加,細胞膜損傷也越趨嚴重,MIC組細胞膜受損程度顯著高于其他組(P<0.05);隨著溫育時間延長,細胞膜受損也越趨嚴重,10~30 min組別間,1/2 MIC組與MIC組差異不顯著(P>0.05),1/4 MIC組與對照組差異仍有顯著差異(P<0.05),隨著溫育時間延長,MIC組細胞內K+泄露顯著高于其他組別(P<0.05),由此可說明,處理濃度與溫育時間對細胞膜損傷有重要影響,呈正相關關系;隨著處理濃度與溫育時間的延長,胞內K+泄露也越來越多,可能是由于仿生消化產物破壞了細胞膜完整性,膜孔徑增大和膜透性增加,破壞了細胞保鉀機制,使胞內K+泄露,從而表現出抑菌活性甚至導致菌體死亡[28]。
3 結論與討論
考察了花生肽亞鐵及其胃腸仿生消化產物對金黃色葡萄球菌的抑菌作用并進行了抑菌機理研究。研究發現,花生肽亞鐵經胃腸仿生消化后抑菌活性得到顯著增強,各階段仿生消化產物抑菌活性有顯著差異,特別是小腸仿生消化300 min后的產物均具有較好抑菌活性,且抑菌活性與產物濃度有良好量效關系;消化產物表面疏水性隨仿生消化時間延長而呈遞增趨勢,消化270 min時表面疏水性達到最大;仿生消化產物MIC為0.2×10-3g/L。MIC組對金黃色葡萄球菌生長有明顯抑制作用且比對照組菌體提前壞死。試驗組與對照組細胞膜透性有顯著差異,特別是MIC組。試驗組與對照組胞內紫外物質泄露和胞內K+泄露也均存在顯著差異。
花生肽亞鐵胃腸仿生消化產物破壞金黃色葡萄球菌細胞膜完整性是否為導致其細胞壞死的主要原因還需進一步確證。課題組通過研究消化產物表面疏水性、細胞膜滲透性、紫外吸收物質泄露和胞內K+泄漏等變化,認為抑制機理可能是由于花生肽亞鐵疏水性C端嵌入膜內疏水區并引起膜上蛋白質構象改變,通過與細胞膜相互作用形成瞬態孔隙,使細胞膜裂解,膜孔徑增大和膜透性增加,破壞細胞膜完整性,使胞內蛋白質與核酸等生物大分子由胞內逸出,同時,形成離子通道促使胞內K+外逸,從而起到抑菌作用甚至導致菌體死亡。同時,Fe2+正電荷也可能與帶負電荷的細胞壁脂多糖相吸,使多肽金屬絡合物穿透細胞壁進入菌體,并與細胞膜蛋白質或胞內蛋白質與核酸等生物大分子中的活性基團發生反應,破壞細胞膜和影響生物大分子結構,擾亂細胞代謝而起到抑菌作用。

