重組人Rab17通過調節STAT3/HIF-α/VEGF信號通路影響非小細胞肺癌增殖和侵襲
姚菲菲 王富霞 李增艷
NSCLC的診斷和治療技術在不斷提高,但肺癌患者的總生存率并未顯著提高,主要由于患者早期就診率低,確診時大多已處于晚期階段[1]。Rab17是近年來的由人染色體2q32-q37或18q2lq22編碼的Rab GTP酶家族的一員,與其他Rab蛋白不同,它主要在富含上皮細胞的器官中表達[2],在調節跨細胞轉運中發揮重要作用[3]。上皮細胞的極性喪失被認為與癌癥的進展息息相關,在乳腺癌從癌前病變逐漸發展至浸潤性癌的過程中,伴隨著上皮極性的逐漸喪失[4]。目前研究顯示Rab25的表達降低可促卵巢癌、乳腺癌和皮膚鱗狀細胞癌的進展,提示Rab25在多種上皮性腫瘤中發揮一定作用[5-7]。Rab17是第一個被鑒定出來的上皮細胞特異性小GTP酶,隨著上皮極性的喪失其表達水平逐漸降低[2],并有研究顯示Rab17水平降低可增加肝細胞癌的侵襲性[8]。目前在NSCLC中的研究較少,本文主要探討Rab17在NSCLC細胞中的表達水平,對細胞增殖和侵襲的影響及可能的作用機制。
資料與方法
一、實驗材料
正常人支氣管上皮細胞Bease-2B和NSCLC細胞系A549、H460、HCC827均購于上海細胞生物學研究所;RPMI1640培養基、青霉素、鏈霉素、胎牛血清、0.25%胰酶-EDTA、MTT粉末、多聚甲醛、結晶紫、顯影劑和Giemsa染料等購于北京鼎國有限公司;總RNA提取試劑盒、反轉錄試劑盒和lipofeetamine 2000購于日本TaKaRa公司;Transwell實驗的小室和遷移試驗中的小室均購于美國Corning公司;anti-VEGF、anti-STAT3、anti-p-STAT3、anti-HIF-1α、anti-β-actin和辣根過氧化物酶標記的二抗均購于Cell Signal公司;Rab17質粒由廣州銳博生物有限公司合成;BCA蛋白定量試劑盒購于江蘇碧云天有限公司。
二、實驗方法
1 qRT-PCR實驗 按照Trizol試劑說明提取細胞中的總RNA,紫外分光光度計檢測樣品純度,合格的樣本反轉錄為cDNA。50μl PCR反應體系,94℃,5min,然后 94℃,1min,退火40s,72℃,50s設置30個循環,72℃,7min。Rab17上游引物序列為5′-GTGGGCAACAAGACGGACCT VAG-3′、下游引物序列為5′-CTCGCGGGCC CCTTGT TCAG-3′, GAPDH上游引物序列為5′-GCACCGTCAAGGCTGA GAAC-3′、下游引物序列為5′-TGGTGAAGACGCCAGTG GA-3′。cDNA采用BIO-RAD CFX96系統進行實時定量PCR檢測 Rab17的表達,以GAPDH作為內參。每個待測基因設6個復孔,數據通過BIO-RAD CFX96系統進行處理,按照公式RQ=2-ΔΔCT計算各組間的倍數關系。
2 細胞培養及轉染實驗 A549細胞在含10%胎牛血清、100U/mL青霉素、100 μg/mL鏈霉素培養基中培養,放置37℃、5%CO2的恒溫箱中,待細胞密增生長到80%左右,用0.25%胰蛋白酶消化、傳代,取對數生長期的細胞進行轉染實驗。A549細胞以104個/孔的密度接種于6孔細胞板,常規培養24h,細胞融合度約為70%,將A549細胞隨機分為Rab17組(轉染Rab17質粒)、NC組(轉染陰性對照質粒)、Crontrol組(未轉染質粒),按照脂質體lipofeetamine 2000說明書步驟操作,轉染6h后,更換新鮮培養基,繼續培養48h,收集各組細胞,qRT-PCR和Western blot 檢測轉染效果。
3 Western blot實驗 收集Rab17組、NC組、對照組細胞加入蛋白裂解液,收集上清,BCA蛋白定量試劑盒檢測提取蛋白濃度,每個樣本定取30 μg蛋白,沸水煮變性。制作10%的分離膠和5%的濃縮膠,加入蛋白樣品進行SDS-聚丙烯酰胺凝膠電泳,將蛋白轉至PVDF膜上。根據maker和目的蛋白分子量大小切取適當大小的膜,用5%脫脂奶粉封閉2 h、滴加anti-Rab17抗體(1 ∶1000)在4℃冰箱中過夜孵育。采用TBST溶液清洗3遍,每次10 min。滴加二抗(1 ∶4000)室溫孵育1h,采用TBST溶液清洗3遍,每次10min。配置一定量的顯影液,均勻滴加在膜上,置于Amersham Imager600凝膠成像系統中拍照。
4 MTT實驗 Rab17組、NC組和Crontrol組細胞以每孔2×103的密度接種于96孔板中,接種后每12h檢測一次,每個檢測時間點設置6個平行孔,20 μL MTT溶液加入檢測孔中,放置恒溫箱中繼續孵育4h。然后去除上清,每孔加入150 μL二甲基亞砜溶液,震蕩5 min使細胞充分裂解,然后用酶標儀檢測570nm處的吸光度值(OD),OD值與活細胞的數量成正比。
5 軟瓊脂集落形成實驗 Rab17組、NC組和Crontrol組細胞以每皿100萬的密度接種于60 mm的培養皿中,置于37 ℃、5% CO2細胞培養箱里培養14 d,用Giemsa液染色15 min;在倒置顯微鏡下觀察并計數所形成的克隆(≥50個細胞計為克隆)。
6 遷移和侵襲實驗 Rab17組、NC組和Crontrol組細胞用無血清培養基懸浮以2×104的密度接種于小室里面(遷移實驗的小室不含有基質膠,侵襲實驗的小室含有基質膠)。在小室下部加入500 μL含有10%血清的培養基,孵育48h。取出小室放入多聚甲醛中固定10 min,然后至于0.1%結晶紫中染色30 min。用棉簽輕輕擦去小室上部未發生遷移或侵襲的細胞,置于顯微鏡下,每個孔從上至下選擇5個視野拍照。
三、 統計分析
結 果
一、 Rab17在正常人支氣管上皮細胞和NSCLC細胞中的表達情況
NSCLC細胞A549、H460和HCC827中Rab17 mRNA的相對表達水平均低于正常人支氣管上皮細胞Bease-2B,P<0.001。Rab17在NSCLC細胞中表達與Bease-2B細胞相比均較弱,A549細胞中的表達水平最低(見圖1)。
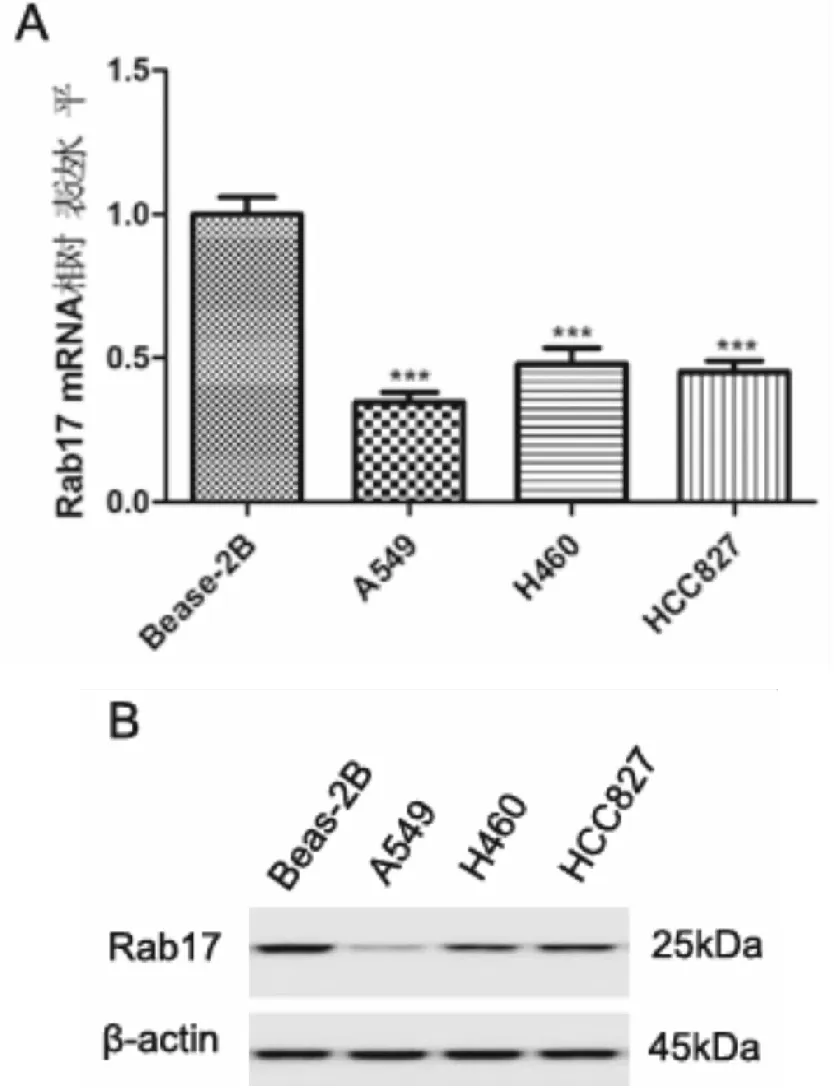
圖1 Rab17在NSCLC細胞中表達減弱
二、 Rab17質粒轉染至A549細胞中使其表達增加
Rab17質粒轉染至A549細胞中,嘌呤霉素篩選出穩定表達的細胞株,NC組細胞Rab17 mRNA的相對表達水平與對照組相比無差異,Rab17組細胞Rab17 mRNA的相對表達水平高于對照組和NC組,P<0.001。對照組和NC組Rab17的蛋白表達水平無明顯差異,Rab17組Rab17的蛋白表達水平明顯高于對照組和NC組,Rab17質粒成功轉染至A549細胞中(見圖2)。
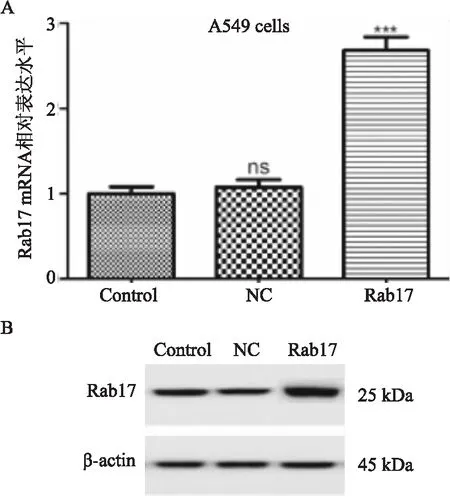
圖2 Rab17質粒轉染至A549細胞
三、 Rab17對細胞增殖的影響
Rab17組細胞在培養72h時的OD值小于Control和NC組,Rab17組細胞培養14d后形成的集落數顯著少于Control和NC組(見圖3)。
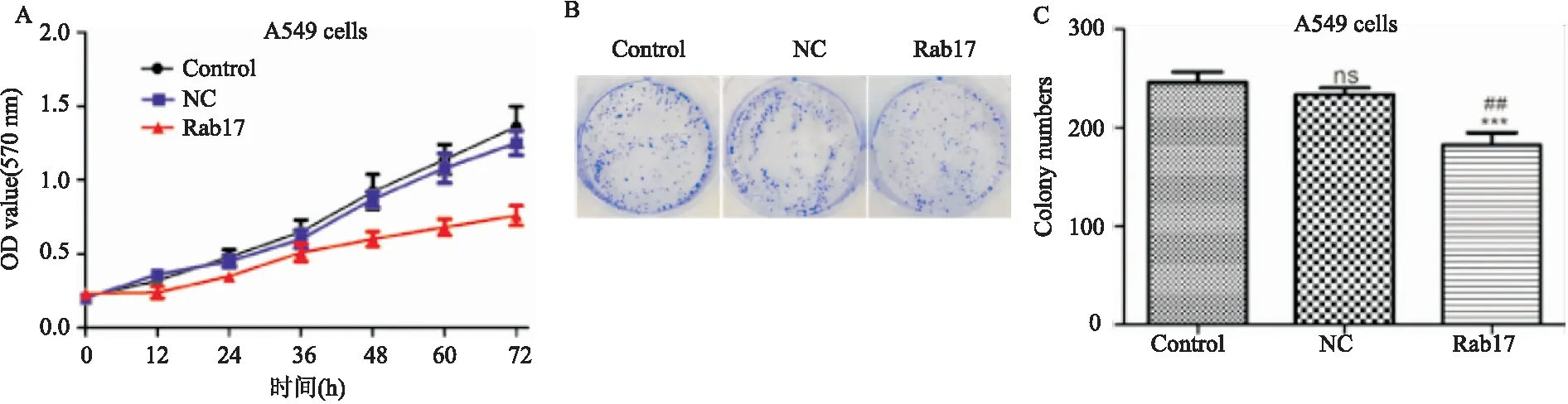
圖3 Rab17抑制A549細胞的增殖
四、 Rab17對細胞遷移和侵襲的影響
Rab17組細胞發生遷移和侵襲的細胞數明顯少于Control和NC組(見圖4)。
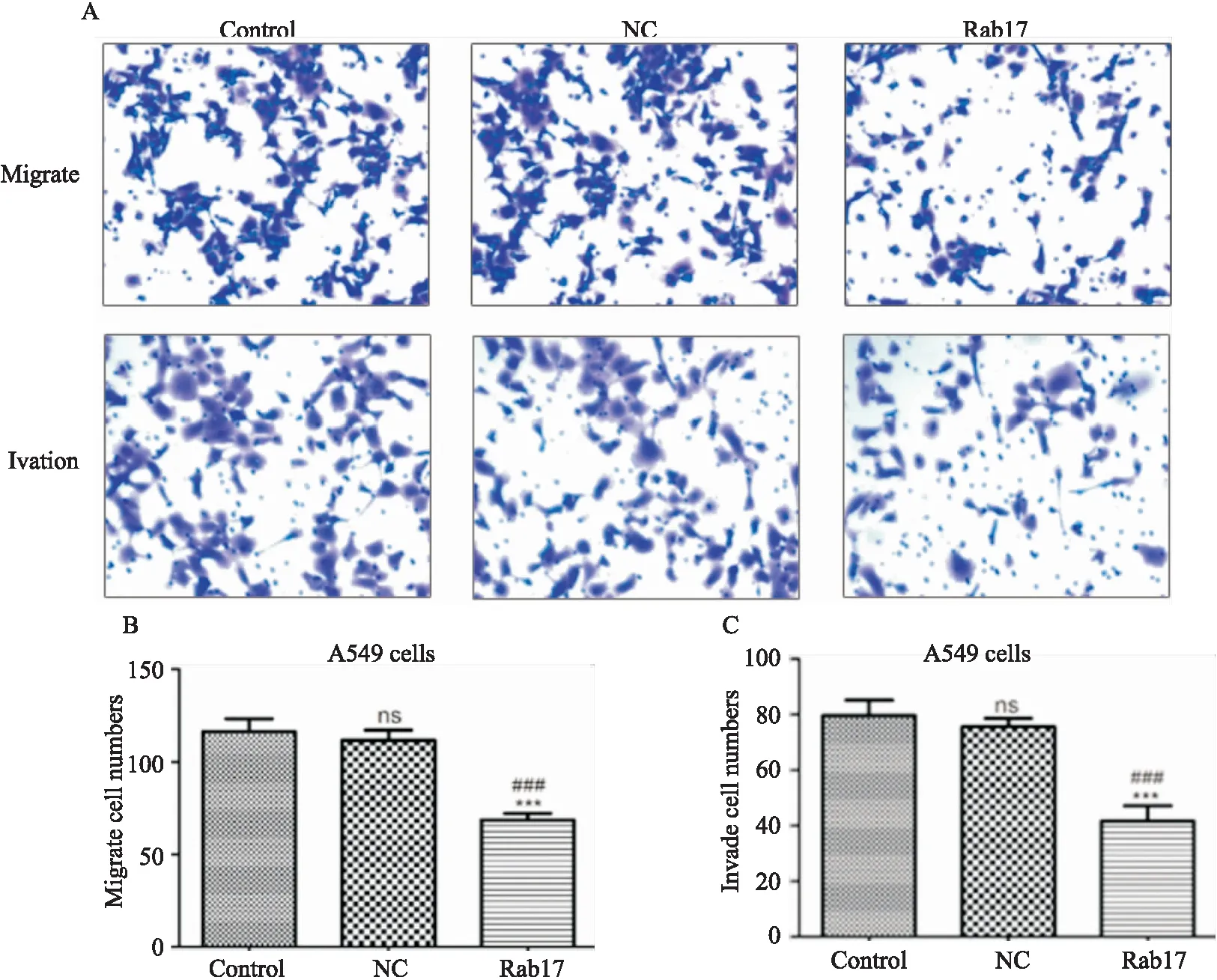
圖4 Rab17減弱細胞遷移和侵襲能力
五、 Rab17抑制STAT3/HIF-1α/VEGF信號通路傳導
Rab17組細胞STAT3蛋白表達水平與Control組和NC組相比無明顯差異,p-STAT3、HIF-α和VEGF蛋白的表達水平與Control組和NC組相比有所減弱(見圖5)。
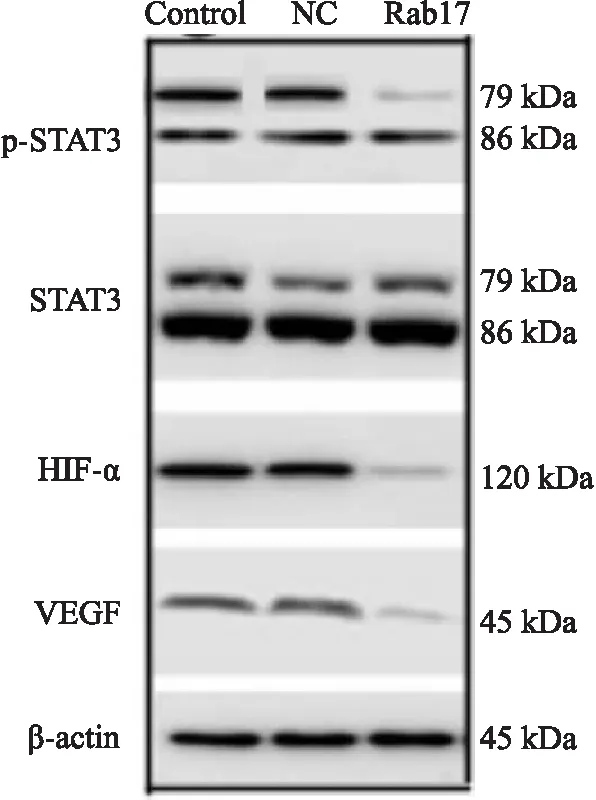
圖5 Rab17抑制STAT3/HIF-1α/VEGF信號通路傳導
討 論
Rab家族的小GTP酶是膜運輸和膜靶向的關鍵調節劑,該家族中有60多個成員已被鑒定出在人類中具有特殊作用,例如Rab5參與早期內吞作用,Rab7參與晚期內吞途徑和蛋白質降解,而Rab11調節蛋白質循環[9]。另外Rab-GTPase家族成員對膜表面離子通道具有調節作用,參與許多細胞生物學行為,其中包括細胞極性消失、細胞侵襲和轉移等[10-11]。本研究結果顯示,Rab17在NSCLC細胞系中表達水平降低,將Rab17質粒轉染至A549細胞后可顯著抑制細胞的增殖、遷移和侵襲。在肝細胞癌中Rab17的下調在體外和體內試驗中均可顯著促進細胞的致癌性,如增強細胞增殖、集落形成、侵襲和遷移和促進移植瘤的增殖及血管生成[12]。
VEGF-A被認為是NSCLC發病機理中的主要旁分泌介質,STAT3和HIF-1α為調節VEGF的主要轉錄因子,在各種癌癥中表達上調,且與患者的臨床預后不良相關[13-15]。STAT3是確定的致癌基因,可通過調節細胞周期蛋白D1和Bcl-2促進細胞增殖和存活,通過調節E-鈣粘蛋白,MMP-9誘導腫瘤侵襲和轉移,通過靶向VEGF和HIF1α表達,促進血管生成等多種生物學作用[16-17]。VEGF和HIF-1α作為STAT3的重要轉錄靶標,是重要的促血管生成因子[18]。本研究結果顯示Rab17過表達可減弱VEGF的蛋白表達水平,這表明Rab17可以通過抑制VEGF信號傳導來抑制血管生成。此外,Rab17可以通過抑制NSCLC細胞中的HIF-1α表達來抑制STAT3信號通路。綜上所述,Rab17在NSCLC細胞中表達水平降低,Rab17的過表達通過抑制STAT3/HIF-1α/VEGF信號通路傳導,進而抑制NSCLC細胞的增殖、遷移和侵襲,Rab17有望成為治療NSCLC的潛在靶點。

