瞬時受體電位通道蛋白5在糖脂代謝中的作用研究
高 俐,祁艷艷,崔藝璇,劉 寬,蔡正達,李干鵬,楊 淬
(1. 云南民族大學民族醫藥學院,民族藥資源化學國家民委教育部重點實驗室,云南 昆明 650500;2. 云南省科學技術院,云南 昆明 650228)
糖尿病是一種常見的內分泌代謝疾病,其機理研究表明糖脂代謝紊亂不僅是糖尿病發生發展的主要因素,也是導致糖尿病患者血管病變的主要原因[1-3]。相關研究表明糖脂代謝過程在糖尿病等代謝綜合征的病理生理過程中扮演重要的角色,找到糖脂代謝過程的相關靶點并對其糖脂代謝進行調節,是突破糖尿病以至代謝綜合征治療的重要方向。
瞬時受體電位(TRP)通道是一個大家族,分為TRPC、TRPV和TRPM通道亞型,在體內分布廣泛,參與調節血液循環、腸蠕動、礦物質吸收、體液平衡、氣道和膀胱的超敏性以及細胞的生長發育等,TRPC離子通道是位于細胞膜上的一類非選擇性陽離子通道,主要介導磷脂酶依賴鈣離子的內流[4-7]。有研究表明[8],TRPC4通道為去極化和鈣流入胰島素分泌細胞的途徑之一,而TRPC5與糖尿病腎病有重要關系,抑制TRPC5基因可以緩解糖尿病腎病癥狀[9]。TRPC4與TRPC5具有高度同源性[10],二者均與糖尿病的發生發展有聯系,但其詳細的病理生理機制并未明確。TRPC5主要在外周表達,目前對其在體內調節作用知之甚少。本研究使用TRPC5基因敲除小鼠,在正常與高糖環境下分別檢測小鼠體內與糖脂代謝過程相關的生化指標,旨在探討TRPC5對糖脂代謝的影響,從而進一步闡明TRPC5在糖尿病病理過程中的作用機制,為糖尿病治療提供思路,同時為相關藥物的研發提供依據。
1 材料與方法
1.1 實驗動物6周齡的 C57BL/6J小鼠10只,♂,體質量(18±2) g,購于湖南斯萊克景達實驗動物有限公司,許可證號:SCXK(湘)2019-0004;6 周齡 TRPC5-/-(TRPC5基因敲除)小鼠,種鼠由中國醫學科學院實驗動物研究所提供,許可證號:SCXK(京)2014-0004,本實驗室進行繁殖,通過基因分型篩選出純合子用于實驗。小鼠均飼養于清潔級動物房內,保持光照/黑暗各12 h,恒定循環。環境溫度25 ℃,濕度0.40~0.60。
1.2 藥物與試劑己糖激酶(HK)測試盒(批號:A077-1)、果糖磷酸激酶(PFK)活性測定試劑盒(批號:A129-1-1)、丙酮酸激酶(PK)測試盒(批號:A076-1)、丙酮酸(PA)測試盒(批號:A081)、總膽固醇(TC)測試盒(批號:A111-1-1)、甘油三酯(TG)測試盒(批號:A110-1)、低密度脂蛋白膽固醇(LDL-C)測試盒(批號:A113-1)、高密度脂蛋白膽固醇(HDL-C)測試盒(批號:A112-1)、檸檬酸合成酶(CS)測試盒(批號:A108)、小鼠乙酰輔酶A羧化酶(ACC)酶聯免疫檢測試劑盒(批號:H232)、小鼠脂肪酸合成酶(FAS)酶聯免疫檢測試劑盒(批號:H231)、游離脂肪酸(NEFA)測試盒(批號:A042)、糖原測試盒(批號:A043-1-1),以上試劑盒均購自南京建成生物工程研究所;小鼠insulin ELISA試劑盒(批號:Cat No.EM017)購自依科賽生物科技(太倉)有限公司。
1.3 儀器高速離心機(5417R, Eppendorf),酶標儀(MultiskanGo,Thermo),微量加樣器(Eppendorf),HW-1000 超級恒溫水浴(成都泰盟科技有限公司)。
1.4 實驗分組C57BL/6J小鼠與TRPC5-/-小鼠各10只,均隨機分為對照組(n=5)和高糖組(n=5),對照組給予正常飲水,高糖組給予質量濃度為100 g·L-1的糖水各8周。
1.5 小鼠體重及空腹血糖測定稱重,剪尾,從尾靜脈采集空腹全血,檢測空腹血糖(FBG)。此后,連續8周,每周固定時間進行稱重,同時檢測空腹血糖。
1.6 生化指標檢測小鼠喂養8周,最后一次檢測體重及空腹血糖后,眼球摘除取血,分離血清,并檢測血清中Insulin、HK、PFK、PK、PA、TC、TG、LDL-C和HDL-C的含量;同時取小鼠肝臟組織,稱重,液氮速凍后于-80 ℃保存,用于檢測肝臟中上述生化指標以及CS、ACC、FAS、NEFA、肝糖原含量。同時取小鼠皮下脂肪組織,用于檢測FAS和NEFA含量。
1.7 RNA-sequence
1.7.1樣品收集與測序 8周后,取小鼠肝臟組織,提取RNA,并檢測其純度及完整性。達到建庫要求后進行文庫構建,稀釋文庫至105 mg·L-1,并使用 Agilent 2100 bioanalyzer對文庫的 insert size 進行檢測。insert size 達到預期后,通過Q-PCR 對文庫有效濃度進行準確定量(文庫有效濃度高于 2 nmol·L-1),以保證文庫質量。庫檢合格后,把不同文庫按照有效濃度及目標下機數據量的需求pooling,而后進行 Illumina 測序,得到待測片段序列(該過程委托北京諾禾致源科技股份有限公司進行)。
1.7.2數據分析 將轉錄組測序數據進行數據質控,序列比對到參考基因。對基因表達水平定量,數據整理后使用R語言軟件中edge R 包進行差異基因分析,以校正后的P值<0.01以及 |log2foldchange|>2作為顯著差異表達的閾值進行過濾,篩選得到各組間的差異基因。然后利用clusterProfiler進行GO功能分析,注釋其參與的生物學過程(biological process,BP)、細胞組成(cellular component,CC)和分子功能(molecular function,MF),使用Omicshare進行KEGG信號通路富集,然后使用Cytoscape中的CytoHubba進行差異基因核心分析。

2 結果
2.1 小鼠體重與空腹血糖各組小鼠體重隨著時間增加逐漸增重,且TRPC5-/-組小鼠的體重一直高于C57BL/6J小鼠,且兩組間體重差異具有顯著性(P<0.05); TRPC5-/-小鼠空腹血糖一直低于C57BL/6J小鼠,兩組間血糖差異具有顯著性(P<0.05),提示TRPC5基因與體重、血糖的變化相關。
高糖組在給予糖水1周后,兩組體重無明顯差異;2周后,C57BL/6J小鼠組體重高于TRPC5-/-小鼠組(P<0.05);且給予糖水1月后,TRPC5-/-小鼠與C57BL/6J小鼠的空腹血糖差異無顯著性,見Fig 1,實驗結果提示TRPC5基因影響糖代謝過程。
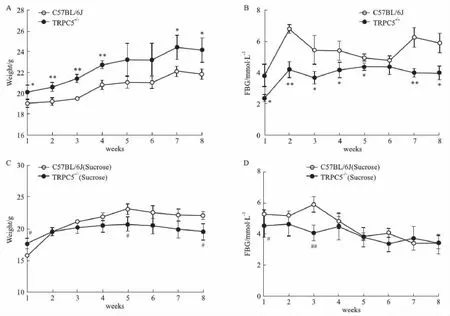
Fig 1 Changes of weight and fasting blood sucrose in *P<0.05 vs C57BL/6J;#P<0.05 vs C57BL/6J (Sucrose).
2.2 生化指標測定結果
2.2.1小鼠血清中胰島素含量 各組小鼠飼養8周后,分別取血清,測定血清中胰島素含量。結果顯示對照組C57BL/6J小鼠血清中胰島素含量高于TRPC5-/-小鼠(P<0.05);而給予糖水8周之后,C57BL/6J小鼠血清中胰島素含量低于TRPC5-/-小鼠(P<0.05)。這提示正常情況下,敲除TRPC5基因,胰島素分泌減少;但在高糖刺激下,敲除TRPC5基因反而促進胰島素分泌。見Fig 2。
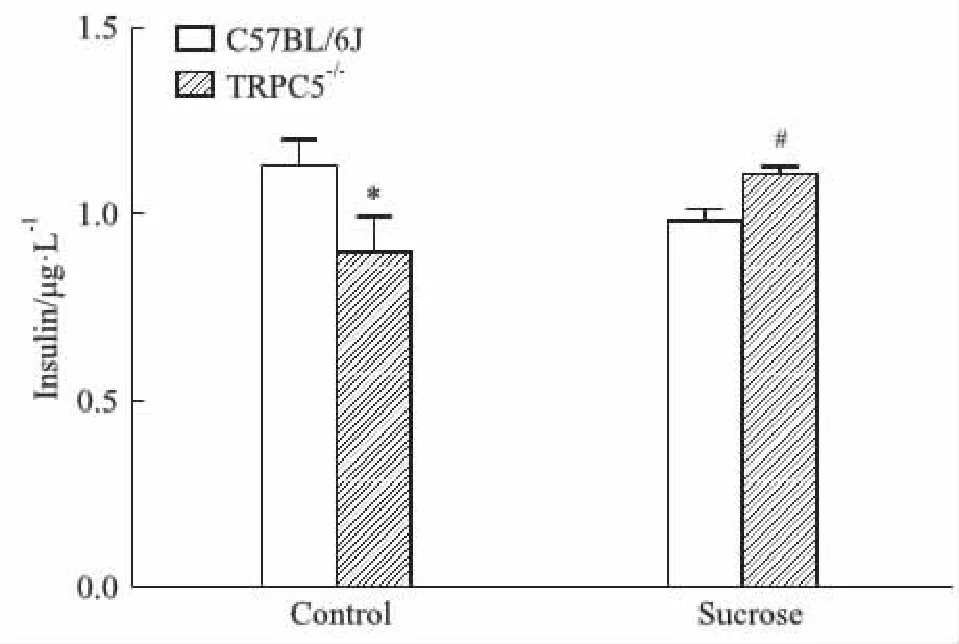
Fig 2 Insulin content in serum of *P<0.05 vs C57BL/6J;#P<0.05 vs C57BL/6J (Sucrose).
2.2.2小鼠血清中糖脂相關指標 檢測結果顯示,各組血清中,C57BL/6J小鼠PK和HDL-C含量均高于TRPC5-/-小鼠(P<0.05);而PA、TG、TC含量均低于TRPC5-/-小鼠(P<0.05);兩種小鼠間PFK、HK和LDL-C含量差異無顯著性(P>0.05)。見Fig 3。提示TRPC5基因影響糖代謝過程及血脂水平。
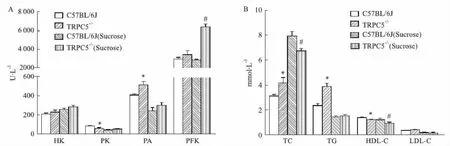
Fig 3 Determination results of (A) HK, PK, PA, FPK; (B) TC,TG, HDL-C, LDL-Cin mouse serum *P<0.05 vs C57BL/6J;#P<0.05 vs C57BL/6J (Sucrose).
給予高糖刺激后,兩種小鼠的PK、PA、TG以及LDL-C含量均有所下降,且兩種小鼠間以上各指標含量趨于差異無顯著性(P>0.05);此外,兩種小鼠在高糖刺激下,TC含量均明顯升高,且C57BL/6J小鼠升高快于TRPC5-/-小鼠,直至8周后C57BL/6J小鼠TC含量明顯高于TRPC5-/-小鼠(P<0.05);值得注意的是,TRPC5-/-小鼠的PFK含量增高,且明顯高于C57BL/6J組(P<0.05),提示TRPC5基因能抑制糖酵解;兩種小鼠在高糖刺激下HK含量無明顯變化(P>0.05),見Fig 3。以上結果提示,給予高糖刺激后,一部分糖進入糖酵解過程,一部分糖轉化為了脂類中的膽固醇,該過程中TRPC5基因可以在一定程度上抑制糖酵解,促進膽固醇的合成。
2.2.3小鼠肝臟中糖脂相關指標 對照組中,C57BL/6J小鼠的臟器指數高于TRPC5-/-小鼠,其肝臟中PK、PA、NEFA含量均低于TRPC5-/-小鼠(P<0.05);二者間TC、LDL-C和HDL-C含量差異無顯著性(P>0.05);C57BL/6J小鼠TG與肝糖原含量高于TRPC5-/-小鼠(P<0.05)。
高糖刺激后,二者HDL-C和肝糖原含量增高,且C57BL/6J小鼠明顯高于TRPC5-/-小鼠(P<0.05,P<0.01);但TRPC5-/-小鼠ACC含量明顯高于C57BL/6J小鼠(P<0.05)。見Fig 4。
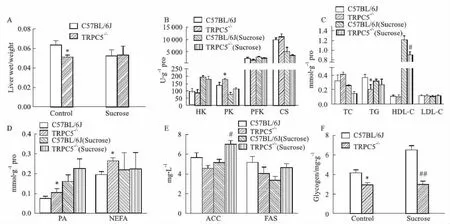
Fig 4 Determination results of (A) liver wet / weight(B) HK, PK, PFK, CS; (C) TC, TG,HDL-C, LDL-C;(D) PA, NEFA; (E) ACC, FAS; (F) Glycogen in *P<0.05 vs C57BL/6J;#P<0.05,##P<0.01 vs C57BL/6J(Sucrose).
2.2.4小鼠皮下脂肪中相關指標 結果顯示,對照組TRPC5-/-小鼠FAS與NEFA含量均高于C57BL/6J小鼠(P<0.05),見Fig 5。
高糖刺激后,兩組小鼠的FAS含量有所增高,但C57BL/6J小鼠組增高大于TRPC5-/-小鼠,直至8周后兩組小鼠間FAS含量差異無顯著性(P>0.05);同時,C57BL/6J小鼠NEFA含量有所上升,8周后兩組小鼠之間差異無顯著性(P>0.05),見Fig 5,提示高糖刺激下TRPC5基因促進該部位脂肪酸合成,進而促進皮下脂肪合成。
2.3 小鼠肝臟組織RNA-sequence
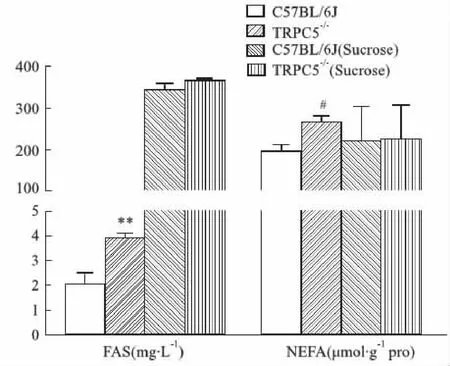
Fig 5 Determination of FAS and NEFA in subcutaneous *P<0.05 #P<0.05 vs C57BL/6J (Sucrose).
2.3.1轉錄組測序與 De nove 組裝 對各組小鼠肝臟組織中提取的總RNA分別測序得到原始圖像數據,經base calling轉化為原始序列數據(raw reads),而后組裝并去冗余,得到過濾后序列數據 clean reads,見Tab 1。
Tab 1 Summary of sequences analysis
2.3.2差異表達分析 對照組中,與C57BL/6J組相比較,TRPC5-/-組共檢測到674個差異表達基因,上調差異基因(紅色) 347個,下調差異基因(綠色)327個。高糖組中,與C57BL/6J組比,TRPC5-/-組共檢測到差異基因1 022個,其中上調基因663個,下調基因359個。高糖組上調基因數明顯多于對照組(P<0.05),提示在高糖刺激下,TRPC5基因會影響其它相關基因,進而調節機體代謝平衡,差異基因火山圖見Fig 6。
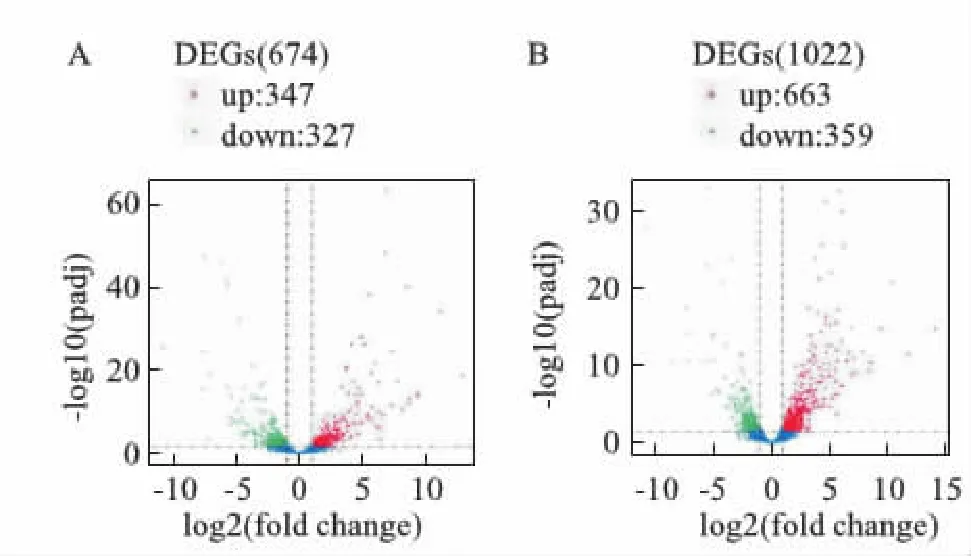
Fig 6 Volcano map of differentially expressed genes
2.3.3差異表達基因GO功能分析 選取差異基因富集數目占前10的內容(P<0.05),發現:對照組在生物學過程中,較多的差異基因歸類為細胞趨化性、有機酸生物合成及脂質定位;在細胞組成中,歸類為膜筏、膜區以及血漿脂蛋白顆粒;在分子功能中,參與氧化還原酶、氧氣及血紅素結合的差異基因較多,見Fig 7。

Fig 7 Go function analysis of normal miceA:BP;B:CC;C:MF
高糖組在生物學過程中,較多的差異基因歸類為嘌呤核苷酸代謝過程、氧化應反應及脂肪酸代謝過程;在細胞組成中,歸類為線粒體內膜的差異基因最多;在分子功能中,較多的差異基因歸類為核苷結合、小GTPase結合(P<0.05),見Fig 8。
本結果證明,敲除TRPC5基因之后,對免疫及脂質轉換過程有影響;高糖刺激下,影響則主要集中在核苷酸代謝及脂肪酸的代謝過程,提示TRPC5基因在糖脂代謝中扮演重要角色。
2.3.4差異表達基因KEGG功能分析 我們選取了差異基因富集數目較多的前10條通路(P<0.05),發現:對照組中,差異表達基因較多的富集在吞噬體、視黃醇代謝通路;給予高糖刺激后,則較多的富集在代謝通路、產熱、內分泌抵抗過程中,見Fig 9。提示TRPC5基因在糖代謝及產熱過程中有重要作用。
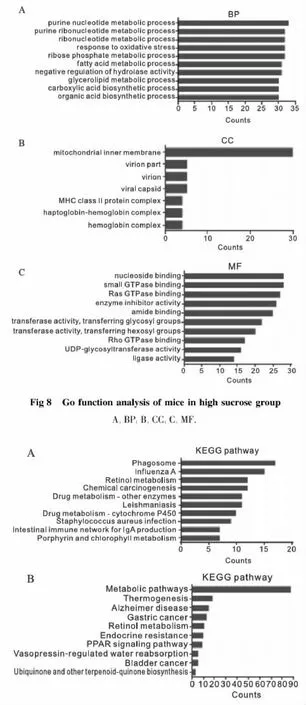
Fig 9 Result of KEGG signaling pathwayA:Control;B:Sucrose
2.3.5差異表達基因關鍵基因篩選 通過使用Cytoscape中的CytoHuba插件可視化分析并計算出前100的關鍵基因,發現高糖刺激后,TRPC5基因核心排序從48位變為了16位,再次證明TRPC5基因影響糖脂轉換,是潛在的糖尿病治療靶標。
3 討論
研究表明,代謝綜合征(metabolic syndrome,MS)和胰島素抵抗在T2DM和心血管疾病的發病機制中起主導作用[11]。代謝綜合征是人體的蛋白質、脂肪、碳水化合物等物質代謝發生紊亂的病理狀態,是一組復雜的代謝紊亂癥候群,同時也是導致糖尿病心腦血管疾病的危險因素。有研究證實非選擇性的陽離子通道-瞬時受體電位通道(TRPCs)與代謝綜合征的病理生理機制相關[12],TRPC1、TRPC3、TRPC6三種亞型被敲除或者抑制后均可顯著降低血糖[13];且TRPC5與糖酵解有關,在化療耐藥治療中扮演重要角色[14]。本研究中,在高糖刺激后,TRPC5基因可以一定程度抑制糖酵解,這一結果進一步證明了TRPC5基因與糖酵解的相關性,也為耐藥機制的研究提供了思路。
本研究前期結果中,敲除TRPC5基因,對小鼠體重及血糖均有影響,推測TRPC5基因與肥胖及糖尿病可能有聯系。我們通過給予小鼠高糖刺激,進一步對這一推測進行驗證。結果表明,在高糖刺激下,與C57BL/6J小鼠相比,TRPC5-/-小鼠胰島素分泌增加,TC含量減少,提示對于1型糖尿病患者,抑制其TRPC5基因可能會對其癥狀有所緩解;且高糖刺激下抑制TRPC5基因可使PFK含量增加,促進糖酵解,同時肝臟中ACC含量增加,促進脂肪酸合成,影響脂代謝過程,進而調控糖脂代謝過程。有研究報道,血脂代謝調節與脂質代謝調節在糖尿病發生發展過程中有影響[3,15],本研究為了再次明確TRPC5在糖脂代謝中的重要作用,使用RNA轉錄組測序技術對肝臟組織進行分析。結果發現敲除TRPC5基因后,在高糖刺激下會影響體內其它基因上調,從而在糖脂代謝中起到作用。治療糖尿病的藥物二甲雙胍也是通過調節多種代謝通路來達到降血糖效果的[15],若能明確TRPC5的作用,則有助于研發新的通過調節代謝通路來治療糖尿病的藥物。
本文針對TRPC5在糖脂代謝中的影響進行了研究,為TRPC5成為治療糖尿病及其他代謝類疾病的潛在靶標提供了實驗依據。有關其發揮作用的詳細分子機制及信號通路尚需進一步研究探討。

