電針對骨骼肌萎縮模型大鼠的干預效果及作用機制研究
劉祥華,羅湘筠,李文倩
(湖南中醫藥高等專科學校附屬第一醫院 湖南省直中醫醫院,湖南 株洲 412000)
骨骼肌萎縮患者主要的臨床表現是肌纖維發生進行性縮小或者消失,患者肌肉質量、容積縮小,其骨骼肌運動以及內分泌功能發生受損。臨床發現,骨骼肌萎縮主要包括失神經性肌萎縮、衰老性肌萎縮和藥源性肌萎縮等,引起患者肢體運動功能障礙,對正常生活產生嚴重影響[1]。目前骨骼肌萎縮的原因較為復雜,其發病機制尚不明確,通過研究其發生機制,能控制患者骨骼肌萎縮[2]。電針可有效延緩失神經性骨骼肌萎縮,已經有大量的研究證實,其能改善周圍神經損傷的癥狀,促進神經損傷修復,對靶器官骨骼肌有延緩萎縮作用[3],目前臨床中關于電針治療骨骼肌萎縮作用機制尚不明確。本研究旨在研究電針對骨骼肌萎縮模型大鼠的干預效果及作用機制,為臨床治療骨骼肌萎縮提供理論參考。
1 材料與方法
1.1 材料
1.1.1 研究動物 選取健康雄性清潔級Sprague-Dawley大鼠30只(由重慶醫科大學動物實驗中心提供,醫學動物合格證號:SCXK渝2012-0002),體質量190~220 g,鼠齡8~10周。本研究符合我院研究倫理委員會標準。
1.1.2 主要試劑 Akt、mTOR、p-Akt、p-mTOR一抗(美國CST公司提供);PBS緩沖液(波爾實驗室提供);MURF1、PGC-1α、FNDC5 ELISA試劑盒(美國Bio-Rad公司提供)。
1.2 方法
1.2.1 骨骼肌萎縮模型建立 30只大鼠隨機分為模型組、假手術組和電針組,各10只。參考高睿琦[4]文獻,所有大鼠給予10%的水合氯醛(0.3 mL/100 g)麻醉后,在無菌手術臺上進行建模。具體操作:固定,將麻醉后的大鼠固定在干凈的手術臺中;備皮,將大鼠右后肢充分暴露后,做好消毒的準備工作;將手術器械高溫消毒后,沿大鼠大肌間隙進行鈍性分離,坐骨神經暴露;神經缺口建立,將坐骨神經剝離,使用手術剪將電針組和模型組兩組大鼠坐骨神經中段切斷后,將兩段進行游離段反折,制作2.0 mm的神經缺口,假手術組大鼠只需要將坐骨神經暴露,不需要將坐骨神經切斷。
1.2.2 電針干預 大鼠建模2 d后,早9:00將電針組大鼠在柔軟型固定器上進行固定,進針采用毫針,取穴參照《大鼠穴位圖譜的研制》和《實驗電針學》進行:側足三里、承山。進針5~7 mm后,將側足三里、承山兩穴與電針儀連接,電針參數設置:采用連續波,頻率為5 Hz,強度1.5 mA。1次/d,每次維持10 min,需要連續干預3周。假手術組和模型組大鼠每天進行固定,時間與電針組保持一致。
1.2.3 腓腸肌濕重、干重測定 大鼠建模成功后,采用10%的水合氯醛(0.3 mL/100 g)對大鼠進行麻醉,將大鼠腓腸肌快速分離,采用電子天平進行稱重,主要包括濕重、干重、干重/體重比值。
1.2.4 骨骼肌肌纖維直徑、面積測定 HE染色:快速提取大鼠骨骼肌,使用40 mL/L的多聚甲醛進行固定,常溫下使用15%的EDTA脫鈣6周,脫水后進行石蠟包埋,制作3 μm的組織切片,HE染色,觀察。骨骼肌經過HE染色后,采用LeicaQwin圖像分析系統,分析骨骼肌肌纖維直徑、面積,標本做4個切面,選擇4個髙倍鏡視野,觀察骨骼肌肌纖維直徑、面積,記錄實驗數據。
1.2.5 骨骼肌相關蛋白檢測 采用ELISA檢測,將采集到的標本,取50 mM碳酸鹽(pH9.5, 0.05 mol/L CB)適當稀釋的抗MURF1、PGC-1α、FNDC5 0.1 mL,添加至聚苯乙烯反應板孔中,加蓋后溫度4 ℃ 24 h,次日使用洗滌劑洗滌3次后,甩干。在各孔中加入稀釋液(pH7.4, 0.02 mol/L Tris-HCl緩沖液)稀釋的待測標本0.1 mL,同時加入陽性和陰性的對照標本,在43 ℃置60 min,將液體移除洗滌3次后,甩干。在各孔中加入MURF1、PGC-1α、FNDC5的酶標抗體0.1 mL,43 ℃置60 min。液體移去后洗滌3次,甩干。在各個孔中加入底物液四甲基聯苯胺(TMS),空白孔不加,0.05 mol/L枸櫞酸(10.5 g/L)4.86 mL混勻,加入鄰苯二胺(OPD)4 mg,置棕色小瓶中,臨用時加30% H2O24.0 μL,混勻]0.1 mL,置黑20 min,在各孔中加入2 mol/L H2SO40.05 mL,終止反應。在酶標儀上讀取A405吸收值。分析MURF1、PGC-1α、FNDC5蛋白表達。
1.2.6 Akt/mTOR通路相關蛋白檢測 采用Western Blot檢測,將采集到的標本10 000×g離心處理10 min,取出上清液,采用BCA蛋白濃度測定試劑盒檢測蛋白定量,將50 μg蛋白加入到2×SDS凝膠加樣緩沖液中,100 ℃加熱處理5 min促使蛋白變性。SDS聚丙烯酰胺凝膠電泳完成后進行轉膜,結束后取下硝酸纖維素膜,在5%脫脂牛奶中4 ℃下封閉1 h,封閉結束后,加一抗(Akt、mTOR、p-Akt、p-mTOR)使用0.05%~0.1% TBST給予稀釋(1∶1 000),4 ℃孵育過夜保存,之后使用0.05%~0.1% TBST洗膜,3次,每次5 min,加二抗使用0.05%~0.1% TBST給予稀釋(1∶10 000),室溫搖動孵育1 h,最后使用0.05%~0.1% TBST洗膜,3次,每次5 min。采用DAB染色試劑盒顯色,光密度掃描后進行定量分析。以GAPDH為內參。
1.3 統計學處理
2 結果
2.1 電針對骨骼肌萎縮模型大鼠腓腸肌濕重、干重的影響
如表1所示,電針組骨前肌濕重、干重、干重/體重高于模型組,低于假手術組,差異具有統計學意義(P<0.05)。模型組骨前肌濕重、干重、干重/體重低于假手術組,差異具有統計學意義(P<0.05)。
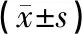
表1 各組大鼠腓腸肌濕重、干重比較
2.2 電針對骨骼肌萎縮模型大鼠骨骼肌肌纖維直徑、面積的影響
如表2所示,電針組骨骼肌肌纖維直徑、面積高于模型組,低于假手術組,差異具有統計學意義(P<0.05)。模型組骨骼肌肌纖維直徑、面積低于假手術組,差異具有統計學意義(P<0.05)。
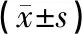
表2 各組大鼠骨骼肌肌纖維直徑、面積比較
如圖1所示,假手術組大鼠骨骼肌肌纖維分布均勻,排列整齊,纖維之間的間隙保持一致,細胞核主要在肌細胞周圍散布。模型組大鼠骨骼肌肌纖維結構不規則,排列混亂,肌纖維發生萎縮,纖維之間的間隙增大,細胞核大小不一致,分布不規律。電針組大鼠骨骼肌肌纖維萎縮程度低于模型組,細胞核增加呈聚集分布。
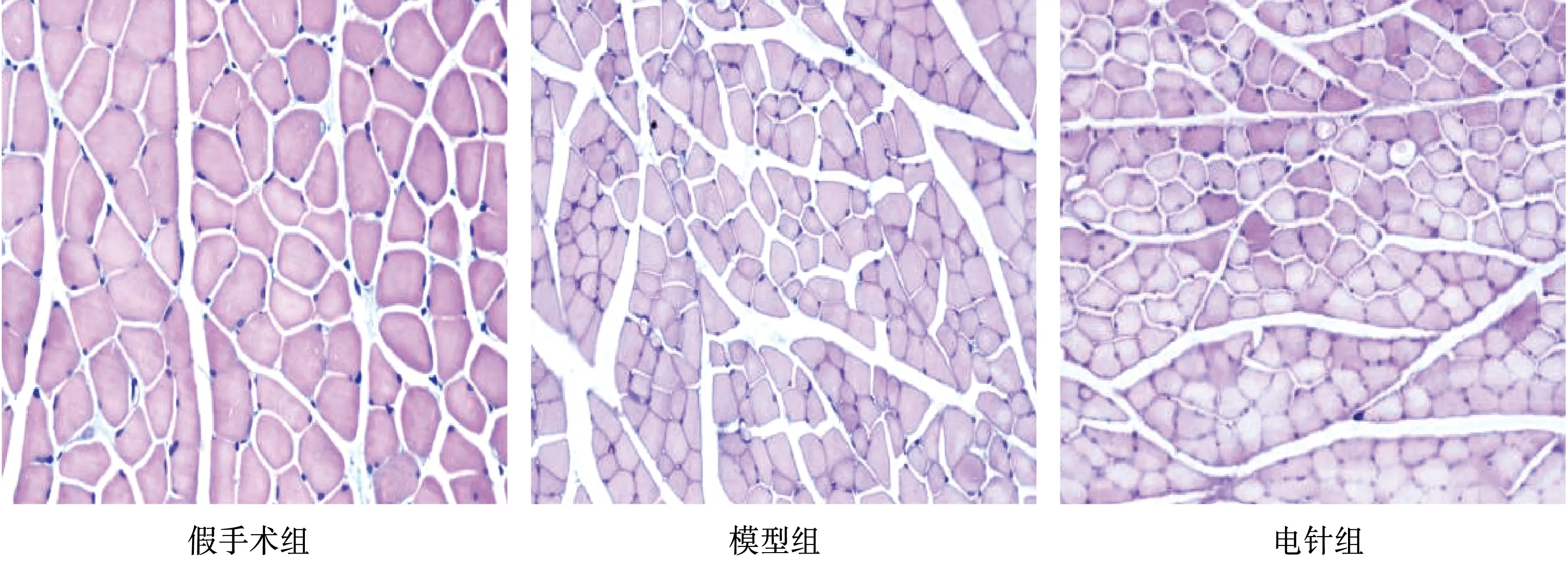
圖1 3組大鼠骨骼肌病理學觀察(HE染色,200×)
2.3 電針對骨骼肌萎縮模型大鼠骨骼肌相關蛋白的影響
如表3所示,電針組骨骼肌相關蛋白MURF1表達低于模型組,PGC-1α、FNDC5表達高于模型組,差異具有統計學意義(P<0.05)。電針組骨骼肌相關蛋白MURF1表達高于假手術組,PGC-1α、FNDC5表達低于假手術組,差異具有統計學意義(P<0.05)。模型組骨骼肌相關蛋白MURF1表達高于假手術組,PGC-1α、FNDC5表達低于假手術組,差異具有統計學意義(P<0.05)。

表3 各組大鼠骨骼肌相關蛋白表達比較
2.4 電針對骨骼肌萎縮模型大鼠Akt/mTOR通路的影響
如表4所示,電針組Akt、mTOR、p-Akt及p-mTOR表達高于假手術組和模型組,差異具有統計學意義(P<0.05)。模型組Akt、mTOR、p-Akt及p-mTOR表達低于假手術組,差異具有統計學意義(P<0.05)。見圖2。
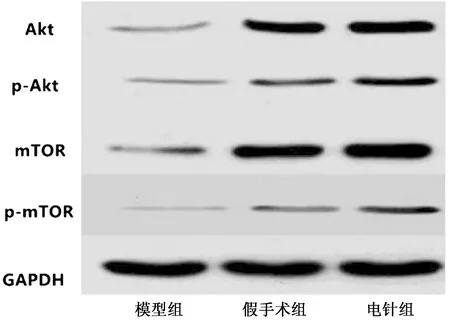
圖2 3組大鼠Akt/mTOR通路相關蛋白(WB圖)
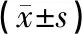
表4 各組大鼠Akt/mTOR通路相關蛋白比較
3 討論
骨骼肌萎縮發生的主要原因是因為機體中肌蛋白合成顯著減少,分解過多,許壽生[5]研究指出,骨骼肌萎縮中蛋白質的分解速度顯著大于其合成速度。本研究建立骨骼肌萎縮模型,采用電針進行干預,通過調控Akt/mTOR通路,研究其對骨骼肌萎縮作用機制,為臨床治療骨骼肌萎縮提供理論支持。
本研究結果顯示,電針組骨前肌濕重、干重、干重/體重高于模型組,低于假手術組,說明通過電針治療后,能改善大鼠骨前肌濕重、干重以及干重/體重。肌肉重新獲得神經支配,肌肉萎縮速度變快,導致靶肌肉發生了不可逆的萎縮,肌細胞發生纖維化,其神經不能進行再支配[6-7]。電針組骨骼肌肌纖維直徑、面積高于模型組,低于假手術組,說明電針能延緩大鼠骨骼肌萎縮的程度,促進其恢復。相關研究指出,電針對增齡性骨骼肌萎縮模型大鼠進行干預,大鼠腓腸肌濕重/體重增加,肌纖維平均橫截面積也隨之增加[8-9]。蘇艷紅等[10]研究也指出,采用后肢懸垂法建立骨骼肌萎縮模型,對其腓腸肌上端末梢進行針刺,發現大鼠比目魚肌濕重/體重比值增加,其橫截面積擴大。
骨骼肌是機體中重要的運動器官,也是重要的內分泌器官,機體中多種活性多肽以及細胞因子均通過骨骼肌分泌和合成,對骨骼肌糖、脂肪、蛋白質代謝發揮調控作用[11-12]。MuRF1屬于一種泛素蛋白連接酶,在骨骼肌和心肌中表達,泛素蛋白酶有多個調節點,影響因素較多,在骨骼肌萎縮過程中發揮著重要作用[13]。在骨骼肌萎縮模型研究中,MuRF1 mRNA表達水平較高,在代謝發生之前,是診斷早期骨骼肌萎縮的重要指標[14]。本研究顯示,模型組大鼠MuRF1蛋白表達較高,本研究與其保持一致。MuRF1具有泛素連接酶活性作用,其表達上調會導致粗絲連接蛋白發生斷裂甚至水解,通過降解肌纖維蛋白,導致骨骼肌萎縮,發生病變[15]。本研究結果顯示,電針組骨骼肌相關蛋白MURF1表達低于模型組,說明電針干預能下調MURF1表達。FNDC5屬于一種肽類激素蛋白主要通過肌肉分泌。PGC-1α屬于一種過氧化物酶體增殖物激活受體γ輔激活因子,FNDC5是其主要的依賴性肌肉因子[16]。PGC-1α參與線粒體生成、能量代謝以及肌纖維類型轉化過程。相關研究指出,PGC-1α對骨骼肌中的FNDC5有促進作用,通過外部的應激刺激對骨骼肌中的PGC-1α、FNDC5表達有誘導作用,通過斷裂能促進肌肉因子Irisin形成[17-18]。本研究顯示,電針組PGC-1α、FNDC5表達高于模型組,說明電針能上調PGC-1α、FNDC5表達,從而調控大鼠骨骼肌萎縮情況。
mTOR屬于雷帕霉素靶蛋白,Akt可以直接作用于mTOR,因此mTOR是Akt下游的一種底物,發揮著重要作用。研究指出,mTOR是Akt下游的重要靶點,可以被磷酸化Akt激活,調控肌衛星細胞生長主要是通過下游靶物來完成,促進其增殖,有助于相關蛋白質合成,起到延緩骨骼肌萎縮的作用[19-20]。本研究結果證實,電針組Akt、mTOR、p-Akt及p-mTOR表達升高,說明電針能將Akt/mTOR信號通路激活。通過本研究進行分析,電針能有效控制失神經性骨骼肌萎縮的速度,通過調控Akt/mTOR通路相關蛋白表達,促進肌蛋白分解和合成,抑制肌細胞凋亡,促進肌衛星細胞增殖分化,參與神經肌接頭傳導,促進其肌細胞能量代謝轉換,因此電針可治療骨骼肌萎縮。
綜上所述,電針對骨骼肌萎縮模型大鼠干預效果顯著,能改善大鼠骨骼肌萎縮狀況,通過激活Akt/mTOR通路,調控骨骼肌相關蛋白MURF1、PGC-1α和FNDC5表達,從而抑制骨骼肌萎縮。

