CNP對急性心肌缺血大鼠室性心律失常的影響
何 燕 劉 育 周明敏 謝 軻
致死性室性心律失常誘發的心源性猝死是缺血性心臟疾病的主要死因[1]。研究表明,急性心肌缺血后交感神經系統過度激活,釋放去甲腎上腺素等神經遞質,導致心電活動不穩定,是引發室性心律失常的重要機制[2]。許多抑制交感神經活性的方法已被證明可以減少室性心律失常和心源性猝死,但仍存在一些不可避免的不良反應[3,4]。C型利鈉肽(C-type natriuretic peptide,CNP)主要與利鈉肽B型受體(natriuretic peptide receptor B,NPR-B)和利鈉肽C型受體(natriuretic peptide receptor C,NPR-C)結合,通過抗纖維化、抗過度肥大和抗炎癥等生物學效應在心血管疾病中發揮作用[5,6]。近期研究表明,CNP可通過抑制交感神經末梢遞質的釋放,降低交感神經活性[7]。為探究CNP能否通過抑制交感神經激活發揮對急性心肌缺血的保護作用,本實驗通過建立大鼠急性心肌缺血模型,觀察CNP對急性心肌缺血后室性心律失常的影響。
材料與方法
1.實驗動物及分組:雄性SD大鼠40只,體質量220~280g,SPF級,購自湖南斯萊克景達實驗動物有限公司,實驗動物許可證號:SCXK(湘)2016-0002,于武漢大學動物實驗中心適應性喂養1周。大鼠隨機分為假手術組(n=10)、急性心肌缺血組(模型組,n=15)和CNP干預組(CNP組,n=15)。CNP(500微克/支,美國R&D Systems公司)溶于生理鹽水,于造模前30min由股靜脈泵入[初始劑量20μg/kg;維持劑量2μg/(kg·min),容量為10ml/kg],持續1.5h,模型組和假手術組給予等量0.9%氯化鈉注射液。
2.急性心肌缺血模型的建立:腹腔注射3%戊巴比妥鈉(30mg/kg)麻醉大鼠。連接PowerLab電生理記錄儀(澳大利亞埃德儀器有限公司)記錄Ⅱ導聯心電圖。在第3~4氣管軟骨環間氣管插管,連接小動物呼吸機(安徽正華生物儀器設備有限公司)。右側頸總動脈插管記錄動脈血壓。胸骨左緣第3~4肋間開胸,在左心耳和肺動脈圓錐間用6-0縫線結扎冠狀動脈左前降支。心電圖ST段明顯抬高并持續,左心室結扎處以下心肌蒼白、收縮運動減弱,表明結扎成功。假手術組只穿線不結扎。
3.去甲腎上腺素(norepinephrine,NE)測定:缺血后15min于頸靜脈采血,室溫3000r/min離心15min,取上層清液于-80℃冰箱中保存。按NE ELISA試劑盒(ELK7885,武漢科鹿生物科技有限公司)說明檢測NE水平。
4.記錄室性心律失常發生情況:記錄缺血后1h室性心律失常發生情況,包括室性期前收縮個數(單聯和二聯)、室性心動過速的次數及時長(三聯及以上)和每組心室顫動發生率。
5.心率變異性分析:于基礎狀態和缺血后15min選擇5min平穩心電圖分析心率變異性,應用LabChart8軟件分析以下變量:低頻成分(low-frequency component,LF,0.20~0.75Hz),高頻成分(high-frequency component,HF,0.75~2.50Hz),LF/HF值。
6.電生理檢測:(1)有效不應期(effective refractory period,ERP):自制Ag-AgCl電極于左心室基底部記錄單向動作電位,刺激電極置于心室缺血區和非缺血區。采用PowerLab系統S1S2刺激程序(8個連續S1刺激后發放單個S2刺激),初始S1S1=150ms、S1S2=120ms,以10ms遞減至S2不能起搏奪獲心室,再以1ms遞減,S2脫落前最大S1S2為ERP。(2)動作電位時程(action potential duration,APD)電交替:刺激電極于左心耳給予S1S1刺激(強度為2倍舒張期起搏閾值,脈寬2ms),單向動作電位電極置于心室缺血區,初始S1S1=300ms,以10ms遞減至出現電交替。應用LabChart8軟件計算單向動作電位復級至90%的時程(APD90),10個連續APD90間差異均>5%并伴APD幅值交替性變化,即為APD電交替[8]。(3)心室顫動閾值:刺激電極于右心室施加刺激(頻率50Hz,脈寬4ms),單次刺激5s,間隔2s,初始電壓4V,1V遞增,誘發心室顫動的最低電壓為心室顫動閾值。
7.環磷酸鳥苷(cyclic guanosine monophosphate,cGMP)測定:實驗結束后取缺血區心肌和左側星狀神經節,保存于-80℃冰箱中,按大鼠cGMP ELISA試劑盒(H163,南京建成生物工程研究所)說明檢測cGMP水平。

結 果
1.大鼠基本情況:模型組大鼠于術中死亡1只,假手術組和CNP組大鼠均無死亡。
2.心率和血壓的變化:與假手術組比較,模型組急性心肌缺血15min后心率有增加趨勢,收縮壓有下降趨勢,差異無統計學意義,舒張壓明顯下降。與模型組比較,CNP組大鼠心率和舒張壓均顯著降低(表1)。

表1 3組大鼠的心率和血壓
3.室性心律失常發生情況:與假手術組比較,模型組室性心律失常事件明顯增多,室性期前收縮,主要發生在缺血前30min內。與模型組比較,CNP組室性期前收縮發生次數明顯降低,而缺血30min后兩組室性期前收縮發生率均較低。同時,與模型組比較,CNP組室性心動過速的總時長和發生次數均明顯降低,心室顫動發生率顯著下降(表2)。
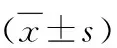
表2 3組大鼠的室性心律失常發生情況
4.心率變異性:與假手術組比較,缺血15min時模型組LF和LF/HF均明顯升高,HF降低。與模型組比較,CNP組LF和LF/HF顯著降低,HF輕度升高,但差異無統計學意義(表3)。
5.血漿中NE水平:與假手術組比較,模型組缺血后血清中NE水平明顯升高。與模型組比較,CNP組顯著降低血清NE水平(表3)。
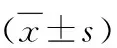
表3 3組大鼠的心率變異性和血漿去甲腎上腺素(NE)水平
6.電生理結果:與假手術組比較,模型組急性心肌缺血大鼠缺血區ERP明顯縮短,而非缺血區ERP無明顯變化。與模型組比較,CNP延長缺血區ERP,對非缺血區ERP無明顯影響。與假手術組比較,模型組APD電交替的起搏周長明顯升高,心室顫動閾值顯著降低。與模型組相比,CNP組APD電交替的起搏周長下降,心室顫動閾值顯著升高(表4)。
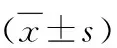
表4 3組大鼠的電生理情況
7.cGMP的水平:與假手術組比較,模型組心肌缺血區和左側星狀神經節中cGMP水平均明顯降低。與模型組比較,CNP組cGMP水平明顯升高(表5)。
討 論
交感神經系統過度激活是急性心肌缺血后室性心律失常的重要發生機制。兒茶酚胺與心臟β腎上腺素能受體結合,通過G蛋白偶聯并激活腺苷酸環化酶,使cGMP合成增加,激活鈉、鈣、鉀等離子通道,導致心臟電活動紊亂,如心肌細胞興奮性異常,復極異常及心室顫動閾值下降,進而增加室性心律失常的易感性[9,10]。

表5 心肌缺血區和左側星狀神經節(LSG)中cGMP濃度
CNP是利鈉肽家族中的一員,與NPR-B或NPR-C結合后激活鳥苷酸環化酶,升高下游第二信使cGMP的濃度,參與各種生理過程調控[11,12]。心肌缺血后心肌組織中cGMP水平降低,可能與缺血后心肌組織中一氧化氮顯著減少有關[13]。近年來研究發現,CNP還可通過抑制交感神經末梢遞質的釋放,降低交感神經活性,進而發揮其在心血管疾病中的保護作用[7]。本實驗結果顯示,CNP干預可以明顯提高心肌組織和星狀神經節組織中cGMP水平,并減少急性心肌缺血后大鼠室性心律失常的發生。急性心肌缺血后室性心律失常多由心室折返引起,表現為缺血區心肌激動延遲誘發的折返[14]。
心肌缺血時,由于心臟各部位缺血程度不一致,ERP呈現不同程度縮短,本研究顯示,CNP可延長心室缺血區ERP[15]。APD電交替是指快頻率刺激下相鄰2個APD復極時間呈現長短交替的現象,與細胞內Ca2+信號紊亂有關,被認為是預測惡性心律失常發生的指標[16]。急性心肌缺血后,APD電交替閾值增大,心律失常發生率增加,而CNP可降低APD電交替閾值,同時減少室性心律失常的發生[17]。心室顫動閾值是反映心肌電穩定性及心室易顫性的重要指標,心肌缺血后心肌電穩定性降低,心室顫動閾值明顯降低,CNP可提高心室顫動閾值,降低心室顫動的發生率[18,19]。本實驗結果提示,激活 CNP-NPR-B-cGMP通路可能通過抑制交感神經活性減少急性心肌缺血后室性心律失常的發生。
心率變異性反映心臟交感神經和迷走神經的活性及平衡關系[20]。本實驗采用頻域分析法分析指標包括LF、HF及LF/HF[21]。LF反映交感神經和迷走神經的雙重影響,主要以交感神經為主;HF反映迷走神經的張力;LF/HF反映交感神經和迷走神經的平衡關系[22]。心肌缺血15min時,模型組NE釋放增加,LF和LF/HF明顯增大,HF減小,表明心肌缺血使心臟交感神經張力增強,迷走神經張力減弱,心臟自主神經調控系統失衡。CNP干預顯著降低血清NE水平、LF和LF/HF,而HF無明顯變化,推測CNP可能主要作用于心臟交感神經,降低交感神經張力,緩解交感神經和迷走神經的不平衡。
本研究為預防急性心肌缺血引起的惡性室性心律失常和心源性猝死提供了新思路,但仍存在局限性:實驗僅觀察CNP對急性心肌缺血大鼠的影響,未評估CNP對心臟電生理和自主神經平衡的慢性影響;此外,本研究未評估CNP發揮作用的最佳劑量。
總之,本研究結果顯示靜脈應用CNP可顯著抑制心臟交感神經系統激活,從而對心肌缺血后室性心律失常發揮保護作用。

