表達IL-15的溶瘤病毒在胃癌中的抗腫瘤活性研究
董雅璐 張 軍
AntitumorActivityofOncolyticVirusesExpressingIL-15inGastricCancer.DongYalu,ZhangJun.DepartmentofOncology,GeneralHospitalofXinjiangMilitaryRegion,Xinjiang830000,China
AbstractObjectiveTo explore the antitumor activity of VSV Δ 51 oncolytic virus expressing IL-15 in gastric cancer.MethodsThe sequence of mouse IL-15 gene was obtained and integrated into the skeleton of VSV Δ 51 oncolytic virus to obtain VSV Δ 51/IL-15 oncolytic virus. The oncolytic activity of tumor cells was verified by infecting tumor cells in vitro. At the same time, VSV Δ 51/IL-15 was given to the tumor xenograft model in vivo. The anti-tumor activity of VSV Δ 51/IL-15 was reflected by the tumor inhibition ability test, immunohistochemical analysis of T cell infiltration and flow analysis of anti-tumor immune activation of infiltrating T cells.ResultsVSV Δ 51/IL-15 oncolytic virus was constructed and obtained. In vitro experiments showed that it could effectively infect tumor cells and express IL-15(P<0.01), it could also lyse tumor cells in a dose-dependent manner. The anti-tumor experiment of the tumor xenograft model showed that VSV Δ 51/IL-15 could significantly inhibit tumor growth(P<0.01) and reduce the mitotic ability of tumor cells. Immunohistochemical results showed that VSV Δ 51/IL-15 could significantly enhance T cell infiltration(P=0.000), while flow cytometry showed that tumor infiltrating T cells treated with VSV Δ 51/IL-15 had stronger anti-tumor activity(P=0.000).ConclusionVSV Δ 51/IL-15 can significantly inhibit the growth of gastric cancer cells and enhance anti-tumor immune response, which may provide a new strategy for the treatment of gastric cancer.
KeywordsGastric cancer; Oncolytic virus; IL-15; Immunotherapy
胃癌是一種起源于胃黏膜的惡性腫瘤。2013年約有98.4萬新胃癌病例和84.1萬人死亡。由于早期缺乏明顯和特異的癥狀,大多數胃癌患者被診斷為疾病晚期,預后較差[1~3]。溶瘤病毒療法近年來被證明是一種有希望的癌癥免疫療法[4,5]。FDA已經批準T-VEC (talimogene laherparepvec,一種溶瘤皰疹病毒)治療轉移性黑色素瘤,使得使用其他溶瘤病毒作為癌癥的標準治療成為可能[6]。水泡性口炎病毒(VSV)是來自Rhabdoviridae家族的一種包膜負義鏈RNA病毒,是一種典型的溶瘤病毒,在臨床前模型中已經證明具有強大的溶瘤活性,正在進行臨床試驗評估其抗腫瘤活性[7,8]。通過對VSV定點突變可以使其在不損害健康細胞的情況下優先靶向腫瘤。例如,VSVΔ51通過缺失51位甲硫氨酸,提高了其腫瘤特異性,破壞了其在正常細胞中的復制[9]。既往的研究也表明,溶瘤病毒聯合系統性增強抗腫瘤免疫活性的療法會產生更好的抗腫瘤效果[10]。人白細胞介素-15(IL-15)是免疫細胞,如T細胞及NK細胞激活、擴增、分化和發揮免疫功能所必需的[11]。這些細胞因子在腫瘤微環境中含量往往較低,使得免疫細胞促生存信號被阻斷,導致免疫活性降低[12]。
本研究通過基因工程的手段,使得VSVΔ51可以表達IL-15,獲得了增強型的VSVΔ51/IL-15工程化溶瘤病毒。通過體外感染胃癌細胞,檢測其腫瘤細胞毒性。同時通過體內抗腫瘤實驗證明,VSVΔ51/IL-15可以顯著抑制胃癌生長,增強抗腫瘤免疫活性,為胃癌的治療提供了新的策略。
材料與方法
1.細胞系及主要試劑:人胃癌細胞MGC803及AGS由中國科學院上海細胞庫提供,鼠胃癌細胞MFC細胞及Vero細胞由美國模式菌種保藏庫提供。以上細胞均培養在添加10% FBS的DMEM培養基中,在37℃、5% CO2條件下生長。MTT及二甲亞砜購自美國Sigma公司,anti-CD8、anti-IFN-γ及anti-TNF-α流式抗體購自美國Biolegend公司,anti-CD8、anti-CD4及anti-mIL-15抗體購自英國Abcam公司。Fix/Perm溶液及Perm/Wash 溶液購自美國BD Biosciences公司。
2.病毒的生產:鼠IL-15的序列獲取自GenBank,并由蘇州金唯智公司進行全基因合成。VSVΔ51病毒由John Bell博士和David Stojdl博士(渥太華健康研究所)提供。mIL-15通過XhoⅠ和XbaⅠ 酶切位點從載體上切割下來,克隆進VSVΔ51病毒G蛋白的3′端獲得VSVΔ51/IL-15。VSVΔ51/IL-15在Vero細胞中增殖,并且通過先前描述的Vero細胞上的標準空斑分析方法定量病毒效價[13]。
3.靶細胞存活實驗:MFC、MGC803、AGS細胞分別接種在96孔板中,每孔3000個細胞,加入0.1ml培養基中。分別按照MOI值為0.05、0.1、0.5、1、5加入VSVΔ51/IL-15處理后,向細胞中加入噻唑藍[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium](1mg/ml終濃度),在37℃繼續培養3h。去除含MTT的培養基,將MTT沉淀物溶解于100μl二甲基亞砜中。使用微板酶標儀(iMark,美國Bio-Rad公司)在570nm處測定吸光度。細胞存活率(%)=[A570(實驗組)/A570(對照組)]×100%。
4.Western blot法檢測實驗:在含有蛋白酶抑制劑的RIPA緩沖液中裂解細胞。通過12% SDS-PAGE凝膠分離等量的蛋白質。電泳后將蛋白質轉移至PVDF膜,在5%脫脂乳中封閉,并在4℃下與一抗(1∶1000)孵育過夜。用TBST洗滌3次后,將膜與HRP綴合的山羊抗兔或抗小鼠二抗(1∶10000)在室溫下孵育2h。再用TBST再次3次洗滌后,根據制造商的方案,用增強型化學發光分析試劑盒對PVDF膜進行處理。用ChemiDocTMXRS+成像系統進行曝光。通過使用Image J對條帶的強度進行量化。GAPDH用作加載對照。
5.HE染色:腫瘤組織切片后浸泡在10%甲醛溶液中,石蠟包埋后進行蘇木精-伊紅染色。在倒置顯微鏡下的明場下觀察并拍照。比較各組的組織結構和有絲分裂細胞。
6.免疫組織化學染色:腫瘤組織的石蠟切片在二甲苯中脫蠟,在降低濃度的乙醇中水合,在0.3% H2O2-甲醇溶液中浸泡30min,用磷酸鹽緩沖鹽水洗滌,在4℃用CD4和CD8單克隆抗體孵育過夜。洗滌后,將切片與生物素標記的山羊抗兔或抗鼠IgG在室溫下孵育2h。免疫染色用鏈霉親和素/過氧化物酶復合物和二氨基聯苯胺顯色,切片用蘇木精復染。在倒置顯微鏡下的明場下觀察并拍照。
7.流式細胞術檢測腫瘤浸潤T細胞:細胞表面染色使用anti-CD8抗體, 細胞用PBS溶液洗滌后與抗體避光孵育20min,使用PBS洗滌3次后進行細胞內抗原染色,用于檢測干擾素-γ(IFN-γ)、腫瘤壞死因子-α(TNF-α)的表達水平。細胞在Fix/Perm溶液中(美國BD Biosciences公司)固定后,用Perm/Wash Buffer(美國BD Biosciences公司)洗滌,然后使用抗體細胞內染色30min,Perm/Wash Buffer洗滌后進行流式分析。所有樣本在LSR Ⅱ細胞儀(BD)上進行操作,并用FACS DIVA軟件v8.0(美國BD Biosciences公司)進行分析。
8.體內實驗: 6周齡左右的雌性C57BL/6小鼠購自卡文斯醫學動物有限公司。對于胃癌皮下異種移植模型,將MFC(2×106個/鼠)細胞接種于6周齡雌性C57BL/6小鼠的后側皮下。3天后,可觸及的腫瘤已經形成(約50mm3),小鼠隨機分為兩組。6天后,143B細胞腫瘤的平均體積達到約150mm3。在6~8天和12~14天將VSVΔ51/IL-15溶瘤病毒[2.5×107pfu/(kg·d)]瘤周注射。每7天測量腫瘤長度和寬度,按公式(長×寬2)/2計算體積。接瘤后第28天處死小鼠將腫瘤剝離,稱量瘤重并拍照。本研究由筆者醫院動物倫理與福利委員會批準。
結 果
1.VSVΔ51/IL-15對腫瘤細胞的感染:熒光顯微鏡觀察結果表明(圖1),VSVΔ51/IL-15可以有效感染腫瘤細胞,并在腫瘤細胞中表達綠色熒光蛋白。將感染后的細胞裂解,Western blot法檢測結果表明,VSVΔ51/IL-15感染的腫瘤細胞IL-15的表達量顯著增加(t=6.885,P<0.01)。

圖1 VSVΔ51/IL-15感染腫瘤細胞A.MOI值為5時VSVΔ51/IL-15感染細胞后的熒光顯微鏡結果(×10);B、C.細胞感染VSVΔ51/IL-15后的Western blot法檢測結果
2.VSVΔ51/IL-15對腫瘤細胞的細胞毒性:使用不同MOI的VSVΔ51/IL-15分別感染多種胃癌細胞,MTT實驗結果表明(圖2),隨著MOI值的增加,VSVΔ51/IL-15對小鼠胃癌細胞MFC細胞的靶細胞毒性逐漸增強。同樣的,感染人胃癌細胞MGC803及AGS的MTT結果也顯示,隨著VSVΔ51/IL-15濃度增加,對靶細胞的裂解能力增強。

圖2 VSVΔ51/IL-15對靶細胞的細胞毒性A.胃癌細胞MFC;B.胃癌細胞MGC803;C.胃癌細胞AGS
3.VSVΔ51/IL-15在體內抑制小鼠胃癌腫瘤的生長:在小鼠胃癌移植瘤模型中,腫瘤的瘤體積生長曲線結果表明(圖3),VSVΔ51/IL-15較對照組而言,可以有效抑制腫瘤的生長(t=12.36,P<0.01)。處死小鼠剝離腫瘤后,瘤重結果也表明VSVΔ51/IL-15治療后的小鼠,腫瘤質量顯著降低(t=10.75,P=0.000)。此外,來自腫瘤的組織學檢查發現,對照組的腫瘤有很高比例濃縮的深紫色細胞核的存在,表明癌細胞有絲分裂旺盛,然而,與對照組比較,用VSVΔ51/IL-15治療的小鼠的腫瘤中有絲分裂細胞的數量顯著減少。
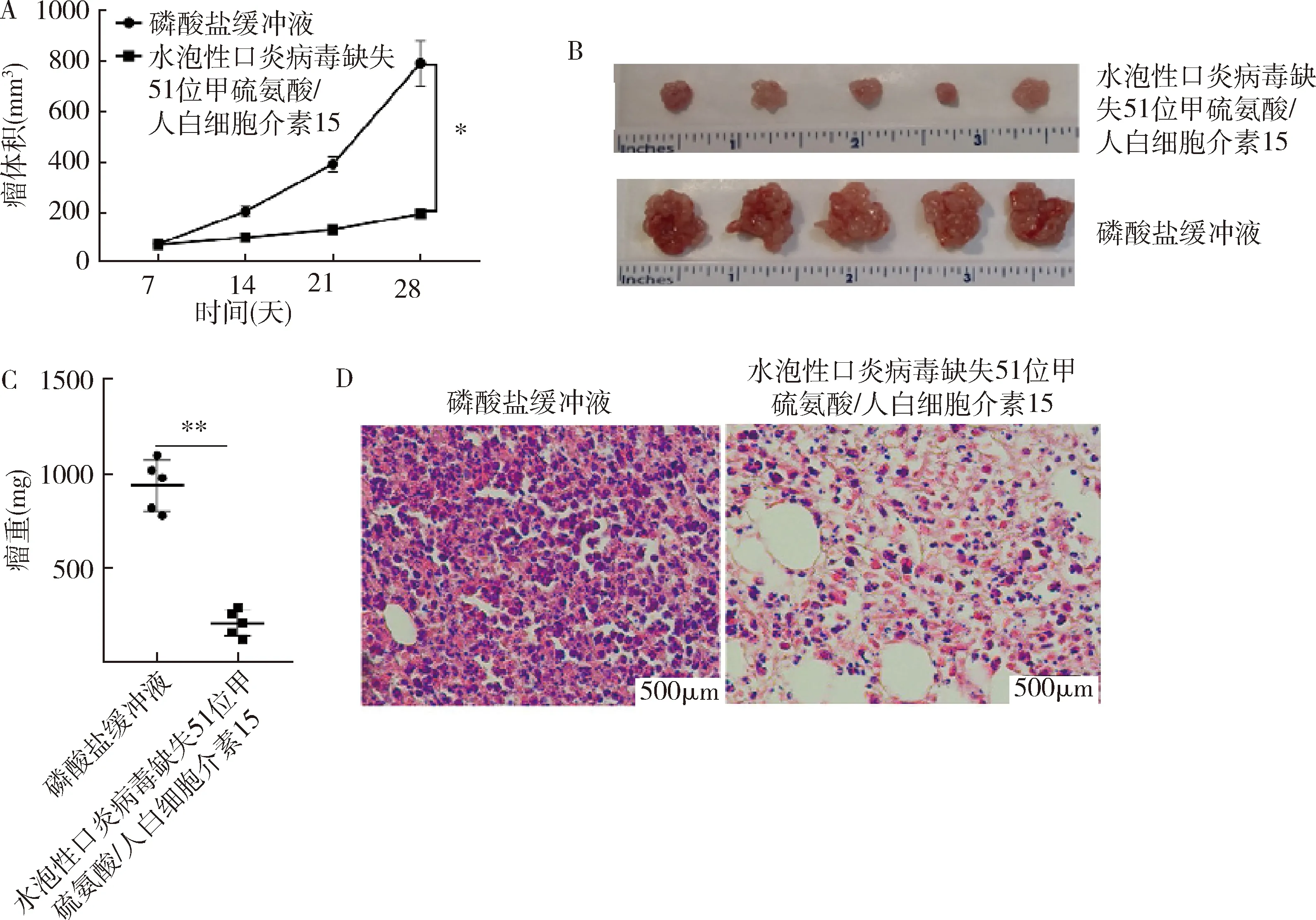
圖3 VSVΔ51/IL-15的體內抑瘤活性A.接受VSVΔ51/IL-15治療后監測腫瘤體積;B.兩個治療組的腫瘤照片;C.腫瘤重量結果; D. HE染色結果;兩組比較,*P<0.01,**P=0.000
4.VSVΔ51/IL-15感染對T細胞浸潤的影響:對瘤組織進行免疫組織化學染色(圖4),在VSVΔ51/IL-15治療的小鼠中,腫瘤組織中有更多的CD4(t=49.16,P=0.000)及CD8(t=30.84,P=0.000)T細胞浸潤,而在對照組小鼠中,腫瘤中未見T細胞浸潤。

圖4 腫瘤浸潤淋巴細胞的免疫組化分析A.腫瘤浸潤淋巴細胞的免疫組化照片(×10);B.CD4+T細胞數;C.CD8+T細胞數
5.VSVΔ51/IL-15感染對CD8+T細胞功能的影響:取小鼠腫瘤組織,對其中浸潤的CD8+T細胞進行流式分析(圖5),結果表明,VSVΔ51/IL-15治療后的小鼠腫瘤中,CD8+T細胞具有高的IFN-γ+(t=19.24,P=0.000)及TNF-α+(t=31.18,P=0.000)的T細胞占比,而對照組小鼠腫瘤中,IFN-γ+及TNF-α+T細胞的占比很低。以上結果表明,VSVΔ51/IL-15治療后可以顯著增強腫瘤浸潤T細胞的效應功能,從而發揮更好的抗腫瘤活性。

圖5 流式分析腫瘤浸潤淋巴細胞的免疫活性A.流式分析腫瘤浸潤淋巴細胞的的代表性圖片;B. IFN-γ+T細胞數目;C. TNF-α+T細胞數目
討 論
胃癌是世界第4大常見惡性腫瘤,也是全球癌癥相關死亡的第3大原因。盡管早期胃癌患者可受益于化療及靶向治療藥物,但原發性耐藥或獲得性耐藥最終導致胃癌患者治療失敗和預后不良[14,15]。因此需要新的治療策略來應對這一挑戰。
VSV具有選擇性感染腫瘤細胞的能力,而對正常細胞的感染能力有限[16]。由于VSV的腫瘤治療潛力,已經有越來越多的臨床前研究探索其在實體瘤中的應用,使其成為一種很有前途的溶瘤病毒[17]。VSV現在已被證明對惡性膠質瘤、黑色素瘤、肝細胞癌、乳腺癌有效[18]。通過對VSV定點突變可以使其在不損害健康細胞的情況下優先靶向腫瘤。例如,VSVΔ51通過缺失51位甲硫氨酸,提高了其腫瘤特異性,破壞了其在正常細胞中的復制[9]。由于該病毒已被證明對癌細胞具有高度選擇性,先前的一項研究證實,VSV是一種在腫瘤部位表達和傳遞外源基因的有效載體[8]。越來越多的人正在研究使用重組VSV攜帶各種不同類型基因的腫瘤治療潛力。本研究構建了攜帶IL-15基因的VSVΔ51/IL-15工程化溶瘤病毒。體外證明其可以有效感染并裂解腫瘤細胞。體內實驗也證明,這種工程化溶瘤病毒可以顯著抑制胃癌細胞的生長,同時增強小鼠自身抗腫瘤免疫反應。
IL-15是一種很有前途的治療實體腫瘤的細胞因子。IL-15優先刺激NK和CD8+T細胞的激活、增殖、存活和細胞毒性,包括調節記憶CD8+T細胞的穩態增殖和存活[19]。IL-15具有與IL-2相似的受體結合、生物學活性。然而,與IL-2比較,IL-15不會誘導T細胞活化誘導細胞死亡(AICD),也不會促進免疫抑制的CD4+T調節細胞(Treg)的增殖或分化。因此,考慮到IL-15激活效應免疫細胞的能力,IL-15有可能成為優于IL-2的癌癥治療藥物[20]。
近期開展的其他研究也評估了將細胞因子與溶瘤病毒療法結合使用,試圖提高腫瘤殺傷率。這些研究表明,將兩種不同的治療策略結合起來治療小鼠腫瘤具有協同效應。溶瘤病毒對癌細胞有直接的細胞毒性作用,而細胞因子則產生免疫刺激的抗癌作用。這也使得有研究人員改造溶瘤病毒,使其表達細胞因子,從而更好的抑制腫瘤[21]。這種新的治療方法可以單獨使用或聯合其他療法,如化療或放療,對復發性非手術的癌癥治療可能有效。病毒溶瘤和免疫治療之間的這種協同關系在癌癥的治療中很有希望,值得進一步研究,以闡明增強抗腫瘤效果的潛在免疫機制。未來的研究可以將VSVΔ51與其他免疫刺激細胞因子(GM-CSF、IL-12等)聯合使用,驗證在胃癌中的抗腫瘤能力。總之,VSVΔ51/IL-15可能成為胃癌治療新的手段之一。

