胚胎玻璃化冷凍后儲存時間對復蘇周期胚胎移植臨床結局的影響
韓樂,蔡令波,孟慧,李婷,劉嘉茵
(生殖醫學國家重點實驗室,南京醫科大學第一附屬醫院生殖醫學中心,南京 210029)
在輔助生殖技術(ART)中,胚胎的低溫保存使得周期治療中多余的胚胎可以得到較好的使用。在胚胎冷凍保存的步驟中,存在各種類型的損傷風險,主要包括冰晶形成的機械性損傷、冷凍保護劑的滲透性損傷和降溫導致的冷休克損傷等。1985年,Rall等[1]應用了“玻璃化”的創新方法,通過使用非常高濃度的冷凍保護劑和快速溫度變化來最小化與冰晶形成有關的損傷。玻璃化冷凍的定義是通過使用高冷卻速率增加粘度,在低溫下固溶而不形成冰晶從而起到保護的作用[2]。近幾年隨著冷凍液配方的改進和冷凍技術的優化,玻璃化冷凍保存技術已經替代慢速冷凍技術成為最適合冷凍保存細胞和組織的方法。與慢速冷凍相比,玻璃化冷凍減少了冰晶的形成[3-4],提高了胚胎冷凍存活率、臨床妊娠率和活產率[5-7]。
凍融胚胎移植(FET)在臨床上主要用于以下方面:預防卵巢過度刺激綜合征(OHSS);生育二孩的夫婦;不適宜新鮮周期胚胎移植的夫婦;行胚胎植入前遺傳學診斷的夫婦;需要生育力保存的女性。FET周期的生理性子宮環境可能更有利于胚胎植入和胎盤形成[8-9]。有研究表明,與新鮮胚胎移植相比,FET周期提高了臨床妊娠率和活產率,且凍融胚胎新生兒的出生缺陷和健康風險并無增加[10-11]。
研究表明短期玻璃化冷凍保存胚胎,復蘇后不影響胚胎著床潛力或圍產期結局[12]。但隨著胚胎凍存時間的延長,是否會影響胚胎后續發育潛力及其圍產期結局和遠期嬰兒健康狀況如何尚不清楚。而且對于長期冷凍保存胚胎的安全性和有效性,目前的文獻報道并沒有得到一致的結論,值得進一步探討。本文回顧性分析了本中心玻璃化冷凍胚胎復蘇后的相關實驗室指標和臨床結局,以期對該技術的安全性和有效性做一初步探討,以確保常規胚胎玻璃化冷凍保存和復蘇的安全性,為進一步研究玻璃化冷凍胚胎長期低溫保存對嬰兒健康狀況的影響奠定基礎。
資料與方法
一、研究對象
回顧性分析2014年1月至2017年12月我中心行玻璃化冷凍胚胎復蘇移植的周期共計19 574個。通過臨床生殖醫學管理系統(CCRM)獲取相關臨床數據。
按照解凍時胚胎在液氮中的凍存時間分為6組:1~6個月組(15 443個周期),7~12個月組(2 321個周期);13~24個月組(903個周期),25~36個月組(327個周期),37~48個月組(224個周期)和≥49個月組(356個周期)。收集患者的基本資料、治療方案、胚胎發育情況以及治療結局。收集的信息包括:女方年齡、體重指數(BMI)、不孕年限、周期數、決定移植日內膜厚度、移植胚胎數、移植胚胎天數以及妊娠隨訪情況。新生兒分娩結局包括平均出生體重、出生性別比、低出生體重比例、死胎死產比例和畸形例數比例。胚胎復蘇后各組比較胚胎復蘇率、種植率、HCG陽性率、臨床妊娠率、流產率、單卵雙胎率等數據。
二、研究方法
1.試劑和耗材:采用COOK公司玻璃化冷凍(COOK K-SIBV-5000,COOK,美國)、解凍試劑盒(COOK K-SIBW-5000,COOK,美國),根據說明書使用。
2.胚胎冷凍步驟:(1)使用前平衡至37℃;(2)各個冷凍液滴準確放置,每滴150 μl左右,一管胚胎一個冷凍滴;(3)將冷凍胚胎放入平衡液中,最多放3個胚胎;(4)胚胎移至平衡液(ES),卵裂期胚胎放置4 min,囊胚放置3 min,卵子6 min。在此過程中觀察胚胎的恢復狀態,若胚胎未恢復可適當延長時間;(5)將胚胎移至冷凍液(VS),吹打2~3下即吸取1.5 μl含胚胎的VS,避免產生氣泡。此步在20~30 s內完成。將含胚胎的微滴放入載桿,投入液氮。
3.胚胎復蘇及序貫囊胚培養:(1)準備使用前,將4種解凍溶液平衡至37℃,囊胚培養滴提前準備;(2)準備解凍滴:在3652皿底部標記好解凍滴號碼;(3)將裝有胚胎或卵子的載桿從液氮盒中取出并立即放入1 mol/L蔗糖,觀察胚胎或囊胚的形態變化,放置約1 min;(4)將胚胎移至稀釋液(DS)中,放置5 min至胚胎或囊胚完全萎縮塌陷;(5)將胚胎或卵子移至Wash 2中放置5 min,充分洗滌胚胎;(6)將胚胎或卵子移至Wash 3中放置5 min,充分洗滌胚胎;(7)將胚胎或囊胚移至之前平衡好的囊胚培養液中孵育。
4.卵裂期胚胎和囊胚評分標準:(1)卵裂期胚胎評分:400倍鏡下觀察分為4級。Ⅰ級:胚胎發育速度正常,卵裂球均勻、數目均等,細胞質均一、無空泡,碎片不超過5%;Ⅱ級:胚胎發育速度正常,卵裂球均勻或大致均勻、數目均等或大致均等,細胞質均一、無空泡,碎片5%~10%之間;Ⅲ級:胚胎發育速度大致正常,卵裂球不均勻/均勻、數目不均等/均等,細胞質中有少量空泡,少于15%碎片;Ⅳ級:胚胎發育速度異常,卵裂球不均勻、數目不均等,細胞質不均一、有大量空泡,10%~50%碎片。Ⅰ級和Ⅱ級為優質胚胎;I~Ⅲ級為可移植胚胎。(2)囊胚期胚胎評分:本中心囊胚評分采用 Gardner評分系統,評分級別高于CC(不含CC)的囊胚可以移植或冷凍,評分等于或低于CC的囊胚,其胚胎發育潛能低下,根據情況決定是否移植或者冷凍。
5.子宮內膜準備:采用自然周期、促排卵周期或人工周期方案準備子宮內膜,優先選擇高評分胚胎行移植術[13]。
6.妊娠及分娩后情況的判斷:胚胎移植14 d后測血清β-HCG。胚胎移植4~6周后陰道超聲檢查,觀察到宮內孕囊和胎心搏動為臨床妊娠。活產定義為孕周滿28周,至少有1個存活新生兒分娩[13]。新生兒體重<2 500 g定義為低出生體重,新生兒體重<1 500 g 定義為極低出生體重。先天異常是指排除染色體疾病導致的其他異常[14]。
三、統計學分析
利用SPSS 20.0 統計軟件中的單因素方差分析對試驗結果進行差異顯著性檢驗。計量資料使用(均值±標準差)表示,對于正態或非正態分布資料分別采用兩獨立樣本t檢驗;計數資料用率(%)表示,采用χ2檢驗。P<0.05為差異有統計學意義。
結 果
一、患者一般情況
本研究共納入19 574個FET周期,根據胚胎凍存時長分為6組。女方取卵時平均年齡為(30.83±4.75)歲,移植時平均年齡為(31.06±4.75)歲。胚胎凍存時間為1~116個月。
各組的基礎參數分布包括取卵年齡、移植年齡、BMI、決定移植日內膜厚度、不孕年限、平均移植胚胎數、解凍囊胚移植比例均有統計學差異(P<0.01)。其中≥49個月組取卵年齡最小、移植年齡最大(P<0.01);37~48個月組和≥49個月組BMI顯著低于其它組(P<0.01),其他各組之間BMI無統計學差異(P>0.05);7~12個月組平均移植胚胎數最多(P<0.05);7~12個月組和13~24個月組決定移植日內膜厚度最低(P<0.01),其他各組之間內膜厚度無統計學差異(P>0.05);≥49個月組不孕年限最長(P<0.05);解凍囊胚移植比例隨著凍存時間的增加而降低,≥49個月組解凍囊胚移植比例最低(P<0.01)(表1)。
二、胚胎解凍后移植結局
1.FET周期妊娠結局:不同凍存時間組胚胎解凍后的胚胎復蘇率、種植率、HCG陽性率、臨床妊娠率、流產率均有顯著差異(P<0.01)。1~6個月組胚胎復蘇率、HCG陽性率和臨床妊娠率均最高,而流產率最低(P<0.01)(表2)。
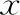
表1 不同凍存時長各組一般資料比較[(-±s),n(%)]

表2 不同凍存時長胚胎的FET妊娠結局(%)
2.FET周期新生兒結局:不同凍存時長胚胎解凍移植后單卵雙胎率、新生兒出生體重、出生性別比、畸形比例均無統計學差異(P>0.05);25~36個月組低出生體重比例最高為12.50%(P=0.011),7~12個月組極低出生體重比例最高為2.29%(P=0.011)(表3)。

表3 不同凍存時長胚胎的FET周期新生兒結局(%)
3.囊胚亞組FET周期妊娠結局:不同凍存時長囊胚解凍后復蘇率、單卵雙胎率均無統計學差異(P>0.05)。1~6個月組囊胚解凍后的種植率、HCG陽性率、臨床妊娠率最高,而≥49個月組囊胚解凍后的種植率、HCG陽性率、臨床妊娠率和流產率最低(表4)。

表4 不同凍存時長囊胚的FET妊娠結局(%)
討 論
本文研究結果表明隨著冷凍時間的延長,胚胎存活率顯著降低。早期研究認為,慢速冷凍保存6~15個月后胚胎存活率下降,長期存儲后妊娠率有降低的趨勢[15]。但也有研究發現,低溫保存時間對復蘇后胚胎的質量、存活情況、植入能力和活產潛力的影響差異并不顯著[16-17]。2016年針對786個卵裂期胚胎FET周期的研究發現,低溫儲存時間不影響復蘇周期的臨床妊娠率和活產率[18]。現在胚胎冷凍保存技術已經從慢速冷凍發展到常規使用玻璃化冷凍,仔細評估其對IVF和胚胎的潛在影響以及圍產期結局具有重要意義。液氮低溫貯存時間是否會影響胚胎復蘇及其相關臨床結局尚需要評估。隨著胚胎存放在液氮中時間的增加,人們越來越擔心胚胎長期低溫儲存的安全性。
本研究對在我中心行FET的19 574個周期進行研究,比較胚胎經歷不同凍存時間后胚胎復蘇率、臨床妊娠率和新生兒情況。結果顯示,1~6個月組胚胎復蘇率最高,其他各組胚胎復蘇率依次降低(P<0.01)。由于本研究納入的周期包含卵裂期胚胎解凍移植和囊胚解凍移植。因此,本研究又進一步統計分析了不同凍存時間組囊胚解凍后胚胎復蘇的情況,發現37~48個月組和≥49個月組解凍囊胚復蘇率最高,但各組之間并無統計學差異(P>0.05),并不會隨凍存時間增加而影響胚胎復蘇率,與肖亞玲等[19]觀點一致。
本研究中各組臨床妊娠率和流產率在不同凍存時間組均有差異。由于患者一般情況中取卵年齡、BMI和決定移植日內膜厚度均都有差異,所以并不能直接判斷是否是玻璃化冷凍保存時長的差異導致了各組妊娠率和流產率的差異。本文中取卵年齡雖有差異,≥49個月組取卵年齡最小,冷凍保存時間最長,復蘇率、種植率、臨床妊娠率都不是最高;1~6個月組冷凍保存時間最短,復蘇率、HCG陽性率、臨床妊娠率都是最高的,取卵年齡卻不是最小的,從側面表明與取卵年齡無關。2020年文獻結果顯示取卵年齡、移植年齡和冷凍保存時長對妊娠率沒有顯著影響[19]。
本研究各組BMI有統計學差異,平均BMI為(22.37±2.91)kg/m2。Schliep等[20]報道肥胖對于IVF/ICSI治療結局無顯著負面影響,且沒有降低患者妊娠率和活產率。Insogna等[21]研究發現超重和肥胖并不降低凍融囊胚移植周期患者的妊娠率、種植率以及活產率。本研究各組的平均BMI均在正常范圍內,不會干擾凍存時間對妊娠率等結果的影響。FET所有患者采用自然周期、促排卵周期或人工周期方案準備子宮內膜,以創造最佳的子宮環境,并使用統一的標準化移植方法。雖然子宮內膜厚度有差異,但均在移植的容受窗內,最大限度地減少了可能的混淆因素。我中心2010年的一篇回顧性分析比較了1 372個FET周期的臨床治療結局,認為子宮內膜厚度并非評價子宮內膜容受性的可靠指標,不會影響妊娠結果[22]。2017年的研究報道認為內膜厚度≥6 mm即可達到較好的種植率和臨床妊娠率,同時不增加流產率[23]。本文數據顯示子宮內膜厚度平均為(9.66±1.70)mm,根據相關文獻報道,并不會影響凍存時間對妊娠結果的影響。
本研究認為移植囊胚的臨床妊娠率更高。有研究對解凍囊胚與卵裂期胚胎的移植進行比較,發現囊胚的妊娠率顯著高于卵裂期胚胎[24-25]。自然生理狀態下早期卵裂期胚胎應在輸卵管中發育,到近囊胚期才進入子宮腔,復蘇周期囊胚移植更符合生殖生理,并且降低了異位妊娠率[26]。本研究表明不同凍存時間組的單卵雙胎率、新生兒出生體重、出生性別比、畸形胎兒比例等新生兒結局均無統計學差異。但新生兒低出生體重比例和極低出生體重比例,均在7~12個月時長組比重較大,有統計學差異(P<0.05),這與2016年發表的一篇報道不一致[27]。由于影響新生兒結局的因素很多,需要進一步挖掘數據分析。在玻璃化過程中,胚胎暴露于冷凍保護劑并且在開放式玻璃化系統中直接與液氮接觸,其中一個或多個環節暴露可能會改變早期胚胎發育并影響其植入和生長潛力。
據推測,玻璃化冷凍過程可能會對滋養層細胞產生損傷而影響隨后胎盤的發育[28]。也可能是玻璃化冷凍和復蘇過程中的環境變化和實驗室處理導致表觀遺傳變化過于微妙,所以無法獲得明確的證據來證實玻璃化冷凍過程對IVF和胚胎移植或圍產期結局以及后代的發育和健康的明確影響。隨著胚胎冷凍技術及其復蘇技術的更新,也許會有更新的技術和方法出現。因此在臨床工作中,對患者進行綜合評估,掌握適當的移植時機,對提高患者的臨床結局至關重要。
綜上所述,本研究認為隨著冷凍保存時間的延長,胚胎復蘇率會下降。短期的保存(不大于6個月)可以獲得較高的臨床妊娠率。因此,如果條件允許,冷凍保存的胚胎應盡早進行胚胎復蘇。但長期冷凍保存的胚胎,其出生嬰兒的健康狀況并未發現顯著異常。本文數據提示冷凍保存時間對單卵雙胎、初生兒體重、男女比例并無顯著影響。但考慮胚胎冷凍保存過程中可能受到保存條件細微變化的影響,導致胚胎的遺傳物質發生改變而致出生嬰兒遠期腫瘤等疾病發病率增高,為確保胚胎玻璃化冷凍保存和復蘇的安全性,未來的研究應該評估嬰兒的長期健康狀況與玻璃化冷凍和長期低溫保存的相關性。

