金屬Ce氫化-氮化反應動力學
王長水,張 凱,宋 鵬,胡小飛,何 輝,陳 輝,孟照凱
中國原子能科學研究院 放射化學研究所,北京 102413
鈰(Ce)是元素周期表的第58號元素,也是第一個具有f電子的元素,因其獨特的電子結構而表現(xiàn)出許多特殊的性質,如反鐵磁性、超導性和單質的 Kondo效應等[1-4]。Ce及其化合物廣泛應用于催化、冶金、醫(yī)藥和紡織等領域[5-8]。金屬Ce化學性質活潑,極易與 O、N、S和H 等元素形成化合物,Ce的氫化和氮化特性是其實際應用中備受關注的問題之一[9-10]。
金屬Ce與核工程金屬材料具有相似的價電子結構,它們的物理化學性質極為相似,如低熔點、多種同素異形體共存等,同時具有相似的相變體積變化率、表面氧化過程、氧化層結構和氫化行為等。因此,Ce被認為是一種較為理想的核工程金屬模擬材料[11-13]。核燃料中金屬的回收與純化具有重要的戰(zhàn)略意義。與傳統(tǒng)的濕法回收相比,氣-固相反應體系不會產生大量的放射性廢水,具有更好的應用前景。在此過程中,通常會根據(jù)回收路線的需求,將金屬與不同氣氛反應得到氧化物、氟化物、氫化物和氮化物等[14],其中,氫化和氮化反應是兩個重要的氣-固反應過程,金屬材料及其合金性能的理論模擬和實驗的系統(tǒng)研究均十分困難。為減少研究工作的危險性及降低研究成本, 發(fā)展模擬材料顯得尤其重要。金屬Ce的氫化-氮化反應動力學研究可以為金屬材料的相關研究提供有益參考。
本工作擬從金屬Ce出發(fā),研究Ce氫化-氮化反應的動力學特性,揭示反應溫度、反應初始壓力和金屬Ce片厚度對反應速率的影響規(guī)律,并利用X射線衍射(XRD)和掃描電鏡(SEM)對氮化產物進行定性研究。
1 實驗部分
1.1 材料與儀器
金屬Ce錠,純度99%,上海阿拉丁生化科技股份有限公司;氫氣、氮氣,純度≥99.999%,山東白燕化工有限公司;SK-GO8123K管式氣氛爐,天津中環(huán);VD85氣體壓力計,德國THYRCONT公司;GC-2010 plus氣相色譜分析儀,日本島津;D8 Advance X射線衍射儀(XRD),德國Bruker公司;Sirion 200型掃描電子顯微鏡(SEM)和能量色散X射線光譜儀(EDS),美國FEI公司。
1.2 金屬Ce的氫化反應
利用電火花線切割將金屬Ce錠切成一定厚度的金屬片。去除Ce片表面氧化層直至顯銀白色,準確稱量后放入預加熱到設定溫度的管式氣氛爐中。持續(xù)抽真空10 min后,向氣氛爐中充入H2至預定壓力,利用壓力計實時記錄反應體系壓力的變化,并直至反應壓力不再變化,則表明金屬Ce完全氫化生成氫化鈰。本工作中反應溫度為20~200 ℃,反應初始壓力為20~100 kPa,金屬Ce片厚度為1、3、9 mm。
1.3 氫化鈰的氮化反應
在金屬Ce完全氫化后,開啟真空泵,抽走未反應的H2,并以10 ℃/min的速率升至預定溫度。通入N2至設定壓力,記錄反應體系的壓力變化。同時,在固定反應時間點采集反應體系中的混合氣體,利用氣相色譜分析氣體組成。當氣體壓力不再變化時,視為反應結束。在Ar吹掃下冷卻至室溫,將所得產物浸于石蠟油中保存。分別考察不同反應溫度和反應初始壓力對反應速率的影響。
1.4 材料表征
使用XRD分析材料的物相結構,衍射靶為Cu,管電壓為 40 kV,管電流為40 mA,掃描范圍為10°~80°,掃描速率為5°/min。采用SEM觀察材料的微觀形貌,同時,利用EDS分析材料的元素組成和分布。
1.5 動力學模擬
金屬Ce的氫化反應是一個典型的相界面反應過程[15-16],如圖1所示,反應首先在某一點開始,然后以該點為中心往周圍擴散,產物氫化鈰呈蓬松的多孔結構,其存在有利于H2的吸附解離。本工作采用相界面反應模型對氫化-氮化反應動力學進行模擬,具體公式如下[15]:

圖1 相界面反應模型示意圖
1-(1-α)1/3=kt
其中:α為反應進度,α=某時間已消耗的H2量/H2的總消耗量;k為反應速率常數(shù);t為反應時間。
2 結果與討論
2.1 氫化反應
2.1.1氫化反應過程 圖2為初始反應溫度(θ0)20 ℃、H2初始壓力為100 kPa的條件下氫化反應過程體系壓力(p)變化及金屬Ce形貌變化圖。如圖2所示,金屬Ce的氫化過程可分為4個階段:誘導階段、成核階段、快速反應和減速終止。在誘導階段,H2分子在金屬Ce表面的吸附解離較慢,H2壓力基本恒定。在成核階段中,H2壓力發(fā)生了緩慢的下降,同時從圖2可以看出,在該條件下金屬Ce表面具有明顯的成核生長現(xiàn)象,銀白色的Ce片上有黑色的氫化腐蝕點出現(xiàn);隨時間增長,氫化點逐漸生長,并且黑色點狀逐漸增大至樣品全黑。經歷成核之后,H2壓力大幅下降,反應速率大幅提高。這是由于經過誘導成核過程后形成的氫化鈰有利于H2的活化,同時Ce片被撐開并發(fā)生粉化,從而大大提高了加氫的速率。最后,H2壓力保持不變,證明反應已經完成。

θ0=20 ℃,p0(H2)=100 kPa
2.1.2初始反應溫度對氫化反應的影響 圖3為H2初始壓力(p0(H2))100 kPa下不同初始反應溫度(20~200 ℃)下的氫化動力學曲線。圖3(a)顯示不同初始反應溫度下的氫化反應均存在誘導期,但誘導時間隨初始反應溫度升高逐漸縮短(圖3(b))。當初始反應溫度高于140 ℃時,誘導過程基本消失。從圖3(a)還可以看出,當反應進入快速反應階段后,不同初始反應溫度下的壓力變化曲線幾乎是平行的,這說明初始反應溫度可能對反應速率影響不大。如圖3(c)所示,當初始反應溫度從20 ℃升高到100 ℃時,反應速率變化不大。金屬Ce氫化反應過程劇烈放熱,因此金屬Ce氫化的實際反應溫度遠高于初始反應溫度,從而導致不同初始反應溫度下的氫化反應速率非常接近。通過計算氫化反應的速率常數(shù)對反應動力學進行進一步研究,結果示于圖4。如圖4所示,隨初始反應溫度升高,反應速率常數(shù)基本不變,約為8.5×10-4s-1,說明初始反應溫度對氫化反應動力學影響不大,主要影響氫化反應誘導期。這可能與氫化反應本身劇烈放熱的特性有關。

p0(H2)=100 kPa
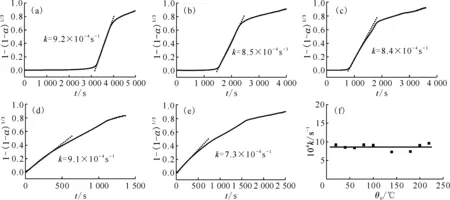
p0(H2)=100 kPa
2.1.3H2初始壓力對氫化反應的影響 圖5為初始反應溫度為100 ℃及不同H2初始壓力下(20、40、60、80、100 kPa)的氫化動力學曲線。圖5(a,b)顯示誘導期隨H2初始壓力增大而逐漸縮短,說明提高H2初始壓力有助于H2分子突破表面層,進而縮短反應誘導期。如圖5(c,d)所示,隨H2初始壓力增加,氫化反應速率及反應速率常數(shù)逐漸增加,增加H2初始壓力有利于提高反應速率,說明氫氣的擴散是速控步驟。圖6為初始反應溫度為200 ℃、不同H2初始壓力下的氫化過程曲線,隨H2初始壓力增加,反應速率常數(shù)與H2初始壓力呈良好的線性關系(k=0.071p0(H2)+0.328,r2=0.996),說明速率方程表達式中,氫氣濃度相的指數(shù)為1。綜合圖5和圖6實驗結果,證明H2初始壓力對氫化動力學有較大的影響。

(a)——反應過程體系壓力-時間關系,(b)——誘導時間-H2初始壓力關系,(c)——反應速率-H2初始壓力關系,(d)——反應速率常數(shù)-H2初始壓力關系
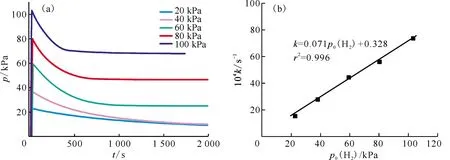
(a)——反應過程體系壓力-時間關系,(b)——反應速率常數(shù)-H2初始壓力關系
2.1.4金屬Ce片厚度對氫化反應的影響 在保持Ce片總質量約為12 g、初始反應溫度為200 ℃和H2初始壓力為100 kPa的條件下,分別考察厚度為1 mm、3 mm和9 mm金屬Ce片的氫化反應,結果示于圖7。如圖7所示,Ce片層厚度對加氫速率有明顯的影響,隨Ce片層厚度增加,氫化反應速率常數(shù)明顯降低。這可能是由于隨Ce片厚度增加,H2擴散路程增加,擴散阻力增加,反應速率降低。
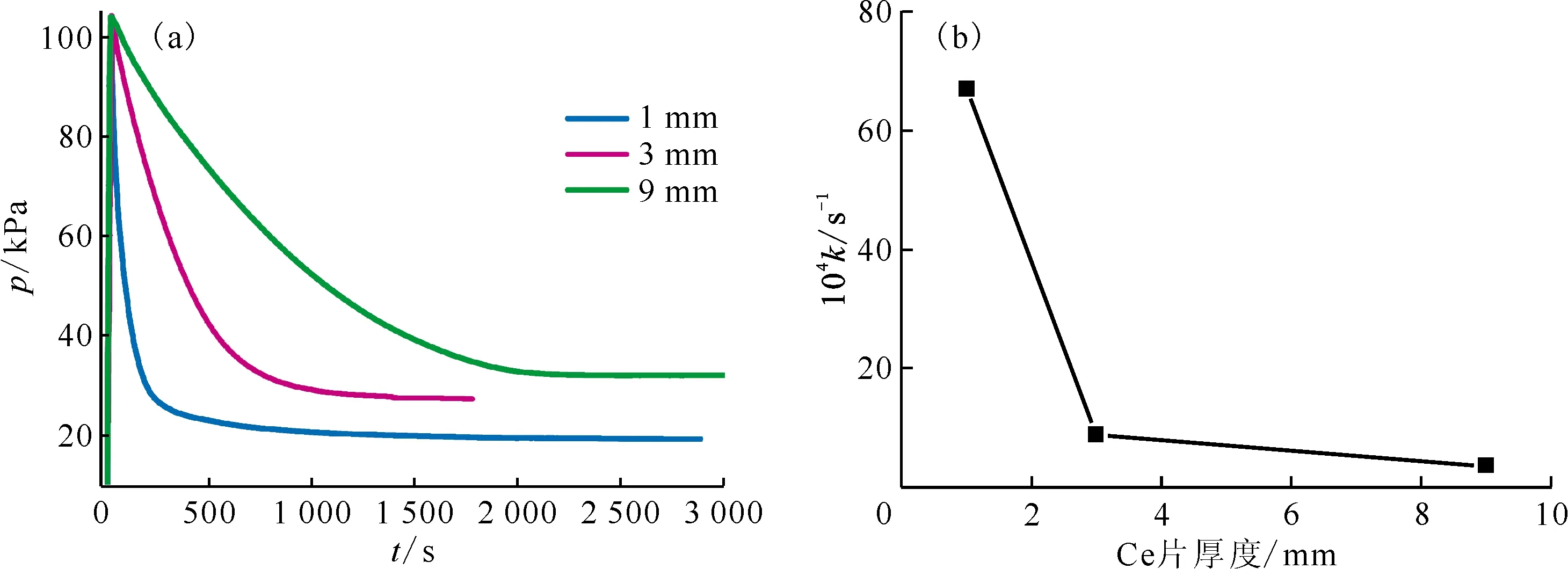
mtotal(Ce)≈12 g,θ0=200 ℃,p0(H2)=100 kPa
2.2 氮化反應
2.2.1氮化反應過程 圖8為初始反應溫度為350 ℃及N2初始壓力約為90 kPa條件下的氮化反應過程。通入N2后,反應壓力迅速從87.16 kPa升至106.1 kPa(圖8(b)),說明氫化鈰與N2發(fā)生了反應2CeHx+N2→2CeN+xH2,導致反應體系壓力增加。隨反應進行,壓力增加的趨勢逐漸變緩,最后壓力基本保持不變。在反應壓力變緩后對反應體系進行采樣分析。通過氣相色譜分析發(fā)現(xiàn)反應體系中只有N2和H2存在,并且N2體積分數(shù)為69.4%,H2體積分數(shù)為30.6%。據(jù)此計算,參加反應的N2/H2摩爾比約為1/3,說明氫化鈰與N2反應生成了CeN和H2。通過對比樣品照片可以發(fā)現(xiàn),在通入N2后,黑色的氫化鈰固體逐漸變?yōu)楣陪~色固體。反應結束后,所得固體內部幾乎全部為古銅色,進一步說明生成了CeN。
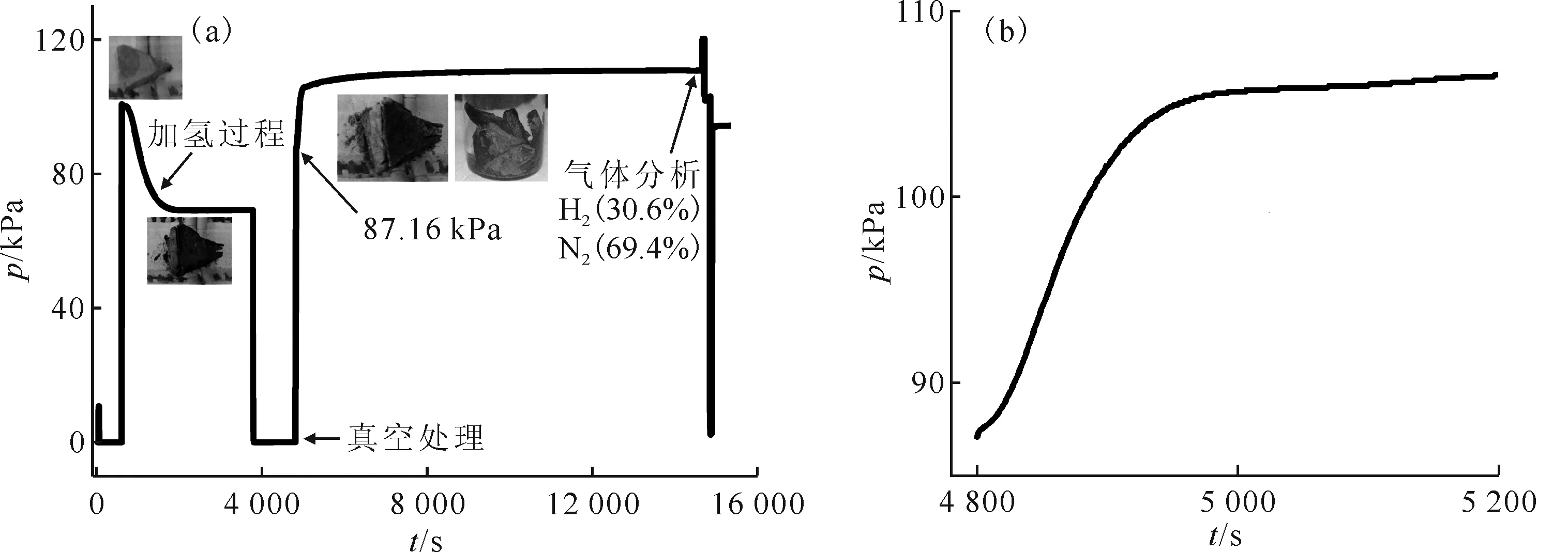
θ0=350 ℃,p0(N2)≈90 kPa
2.2.2氮化產物表征 圖9是氮化反應產物的XRD譜圖。如圖9所示,反應產物在2θ= 31.0°、35.8°、51.6°、61.6°、64.4°、84.1°和97.5°等處均出現(xiàn)了明顯的衍射峰,并且與CeN的標準譜圖(JCPDF No.15-0882)中的(111)、(200)、(220)、(311)、(222)、(331)和(442)等晶面完全對應,充分證明所得古銅色產物為CeN。同時,在28.6°、33.0°和47.6°處的弱衍射峰表明樣品中含有少量的CeO2(JCPDF No.43-1002),這可能是因為在樣品轉移過程中部分CeN被氧化為CeO2。同時,SEM和EDS測試結果表明(圖10),古銅色產物為表面致密結構,并且材料中存在Ce和N元素,進一步證明氫化鈰氮化產物為CeN。

圖9 氮化反應后樣品XRD譜圖

圖10 氮化反應后樣品SEM(a)和EDS(b)表征
2.2.3初始反應溫度對氮化反應的影響 圖11是不同初始反應溫度(250、350、450、550 ℃)下的氮化反應。如圖11(a)所示,初始反應溫度為250 ℃時,通入氮氣后反應體系的壓力增加非常緩慢,說明該初始反應溫度下氮化反應進行得比較緩慢,這可能是由于該反應的脫氫過程需要較高的活化能[17]所致。在350、450、550 ℃條件下,反應體系壓力快速增大,說明升高初始反應溫度有利于氮化反應進行。圖11(b)給出了反應速率常數(shù)與初始反應溫度的關系,可見隨初始反應溫度的升高,反應速率常數(shù)增大,當初始反應溫度高于350 ℃時,反應速率常數(shù)變化不明顯,計算得到反應的活化能為157 kJ。在實際工藝中,350 ℃可作為適宜的初始反應溫度。

p0(N2)≈90 kPa
2.2.4N2初始壓力對氮化反應的影響 在初始反應溫度為350 ℃下,分別考察N2初始壓力約為30、60、90 kPa下的氮化反應,結果示于圖12。如圖12所示,通入不同初始壓力的N2后,反應體系的壓力均明顯升高,說明在不同初始壓力下N2與氫化鈰均可發(fā)生反應。通過對比反應速率常數(shù)與N2初始壓力的關系,發(fā)現(xiàn)N2初始壓力約為30 kPa時,反應緩慢;增加N2初始壓力至約60 kPa,反應速率常數(shù)明顯增加,繼續(xù)增加到約90 kPa,反應速率常數(shù)變化不大。
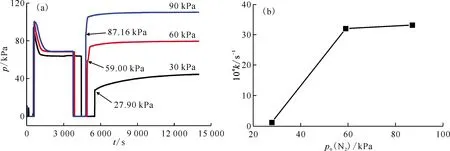
(a)——反應過程體系壓力-時間關系,(b)——反應速率常數(shù)-N2初始壓力關系
3 結 論
以金屬Ce為起始原料,對Ce氫化-氮化動力學參數(shù)進行了研究,分別考察了初始反應溫度、反應初始壓力和Ce片厚度等對金屬氫化-氮化反應的影響規(guī)律。研究結果表明:
(1)Ce氫化反應可劃分為誘導、成核、快速反應和減速終止等4個階段,升高初始反應溫度能縮短誘導時間,但對反應速率無明顯影響;提高H2初始壓力和降低片層厚度有利于加快反應速率;
(2)氫化鈰可以與N2反應產生CeN和H2,提高初始反應溫度和N2初始壓力對于提高反應速率非常有利;初始反應溫度為350 ℃、N2初始壓力約為60 kPa是氫化鈰氮化的較優(yōu)條件。

