不同甲硝比對模擬高放廢液脫硝的影響
王長福,朱冬冬,李玉松,汪潤慈,譚盛恒,劉麗君,張生棟
中國原子能科學研究院 放射化學研究所,北京 102413
對于乏燃料后處理產生的高放廢液(HLLW),玻璃固化是目前唯一已實現工業化的處理方法。高放廢液的玻璃固化是將高放廢液與玻璃基料按一定的比例混合,在固化設備中蒸發、煅燒、高溫熔融、澆筑,成為包容廢物的固化體。玻璃固化有兩種進料方式,一是一步法,將高放廢液直接加入熔爐和玻璃基料熔制;二是兩步法,首先將HLLW進行煅燒,使HLLW由液體轉化為固體,之后再和玻璃基料進行玻璃熔制。后處理產生的HLLW酸度一般為3 mol/L左右,在煅燒過程中,高溫下揮發的硝酸對尾氣設備有很強的腐蝕,HLLW中的裂變產物Ru、Tc在高酸度的溶液中也易揮發,此外高酸度的HLLW煅燒需要很高的煅燒溫度,因此在HLLW煅燒前需要減低其酸度,以降低煅燒溫度,減輕揮發物對尾氣設備的腐蝕,同時減少易揮發組分(Ru、Tc)在煅燒過程中的揮發[1-3]。雖然可通過稀釋或中和降低高放廢液的酸度,但稀釋會使廢液的體積增大,而中和會增加溶液中的鹽含量,這都會增大廢物的處理量和處置費用。降低溶液酸度的另外一種方法是脫硝,可將溶液中的硝酸除去。目前研究用于脫硝的方法有生物法、電化學法、煅燒法、水熱法、化學法、微波脫硝法[4]。生物法是細菌在有機還原物存在下將硝酸根還原為N2、N2O、NO。生物法脫硝慢,不可控,且細菌對重金屬離子敏感,易失去活性。電化學法脫硝容易控制、安全,且不需要加其他試劑,但能耗高和電極壽命有限,限制了其大規模的應用。化學法脫硝用甲酸、甲醛、蔗糖等還原劑在加熱條件下與硝酸反應,生成氮氧化物、二氧化碳等易揮發的氣體,來達到減少硝酸含量的目的。化學法脫硝也是目前得到工業化應用的方法。
使用甲酸脫硝降低高放廢液的酸度,不會增加溶液中的其他金屬陽離子,脫硝后廢液的體積也不增加[5]。王建晨等[6]研究了模擬高放廢液的脫硝過程、機理及α核素在脫硝過程中的行為。Hwang等[7]用甲酸對硝酸濃度為2.0 mol/L的模擬廢液進行脫硝,甲硝比為1.5(甲酸和硝酸的摩爾比),脫硝2.5 h,溶液酸度可降低至0.44 mol/L。Li等[8]研究了模擬PUREX產生的高放廢液的甲酸脫硝,n(HCOOH)/n(HNO3)=1.0,脫硝4 h,溶液的酸度由3 mol/L降至0.86 mol/L,可滿足TRPO流程的要求。
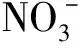
1 實驗部分
1.1 模擬高放廢液的組成
選用燃耗為45 000 MWd/t壓水堆乏燃料產生的高放廢液(冷卻6年,每噸乏燃料產生0.4 m3濃縮高放廢液),配制的模擬高放廢液組成列入表1。
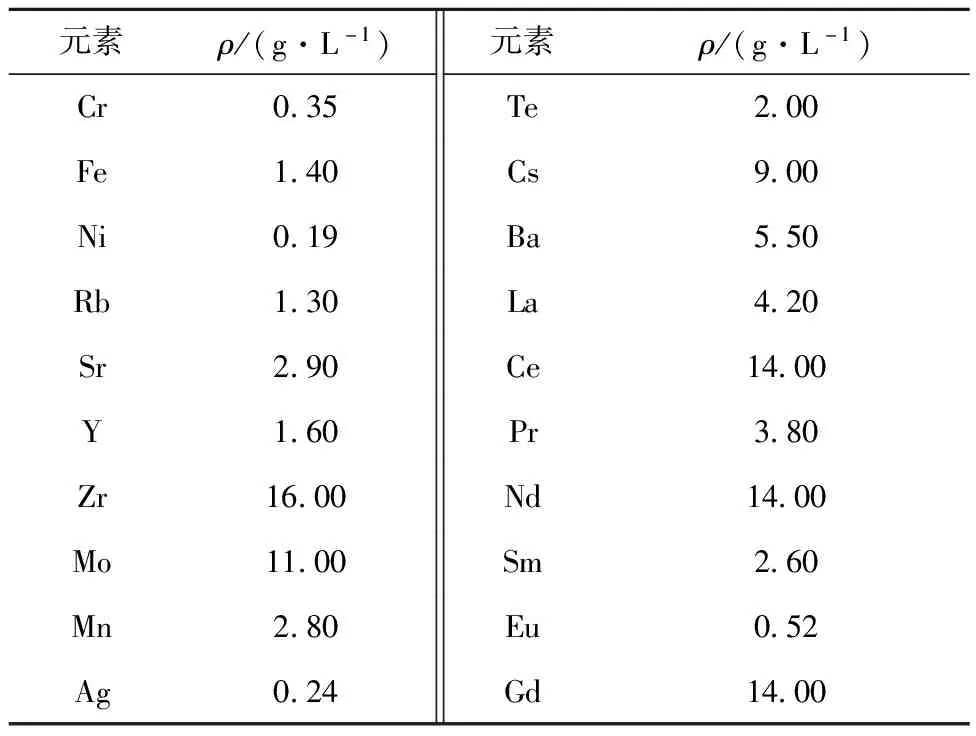
表1 模擬高放廢液的組成
1.2 試劑及儀器
本實驗所用的試劑均為市售分析純。
GT10-1型高速臺式離心機,北京時代北利離心機有限公司;S210型pH計,梅特勒-托利多儀器有限公司;HWCL-1型集熱式恒溫磁力攪拌浴,鄭州長城科工貿有限公司;YZ1515X型蠕動泵,保定蘭格恒流泵有限公司;ARL ADVANT-XP X射線熒光光譜儀(XRF)、ICS 5000離子色譜,美國熱電公司;inVia 顯微拉曼光譜儀,英國雷尼紹公司;449F3同步熱分析儀,德國耐馳儀器制造有限公司。
1.3 實驗方法
模擬脫硝裝置為連接有冷凝管、蠕動泵和溫度計的三口燒瓶。往三口燒瓶中加入一定量的模擬高放廢液,加熱至90 ℃開始滴加甲酸,以產生棕色氣體為反應零點,在反應的第一個小時內加完甲酸,恒溫90 ℃。
模擬高放廢液和脫硝后溶液的硝酸根含量用離子色譜測量。用pH=6.5的8%(質量分數)草酸鉀作為掩蔽劑,滴定體系為0.1 mL樣品+30 mL掩蔽劑,用pH計監測溶液的酸度變化,用標準NaOH滴定至pH=6.5時為滴定終點。反應結束后,離心取上清液測其pH。脫硝后離心,沉淀干燥,XRF測沉淀的元素組成;模擬高放廢液脫硝后完全干燥。測試條件:加熱溫度為50~1 200 ℃,升溫速率為10 ℃/min,測量氣氛為Ar氣;脫硝后離心取上清液,測試條件:激光波長532 nm,功率50 W,曝光10 s,掃描一次,掃描范圍100~4 000 cm-1。
由以下公式可得到甲硝比(r)和脫硝率(r′)。
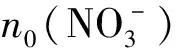
2 結果與討論
2.1 脫硝后溶液的pH變化
甲酸脫硝過程中甲酸與硝酸發生的反應和兩者的濃度有關,不同濃度發生的反應[9]如下:



甲酸滴入模擬高放廢液一段時間后開始反應,反應初期,反應劇烈產生的氣體為紅棕色(NO2),可認為發生的反應為式(1)或(2),但產生紅棕色氣體的持續時間很短,之后反應產生的氣體顏色變淡(NO、N2O、N2);隨著硝酸濃度的減小,硝酸和甲酸按式(2)—(5)進行反應,脫硝的溶液變渾濁。此外,甲酸過量也可和模擬高放廢液中的硝酸鹽(如Al、Fe)發生如下反應[10]:
(6)
(7)
(8)
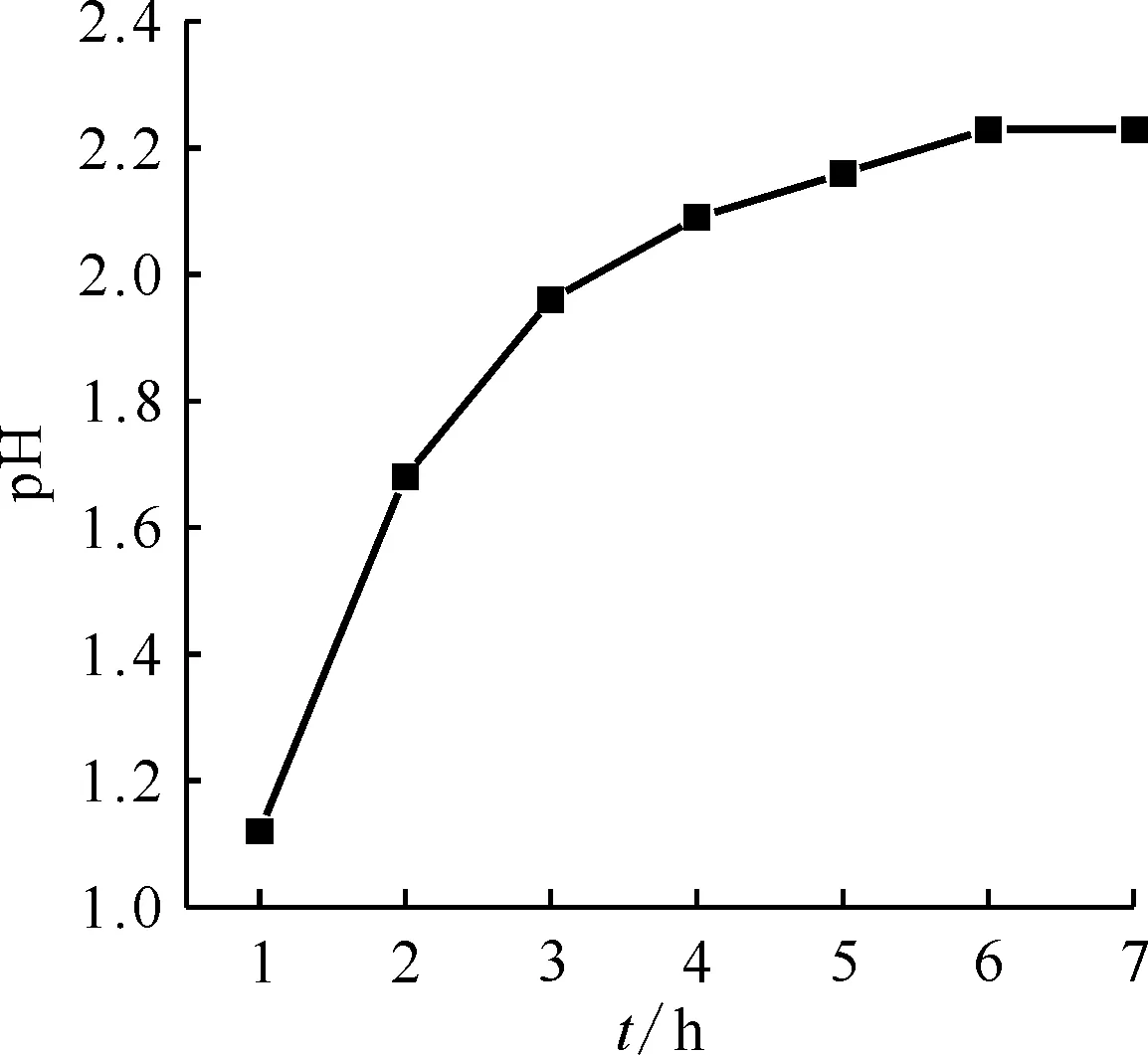
模擬高放廢液按不同甲硝比脫硝后上清液的pH變化示于圖1。由圖1可知:甲硝比為1.0~1.4,pH升高;甲硝比為1.4時pH最高,之后pH隨甲硝比的增加而降低。這是因為在低甲硝比(<1.4)條件下,由于HCOOH的量不足,脫硝不完全還存在游離的HNO3,pH較低;甲硝比為1.4時,脫硝反應后,HCOOH和HNO3的含量最低,pH達到最高;當甲硝比進一步增加(>1.4),pH隨之降低,由于加入的HCOOH過量,脫硝反應后HCOOH有剩余,所以pH較低。
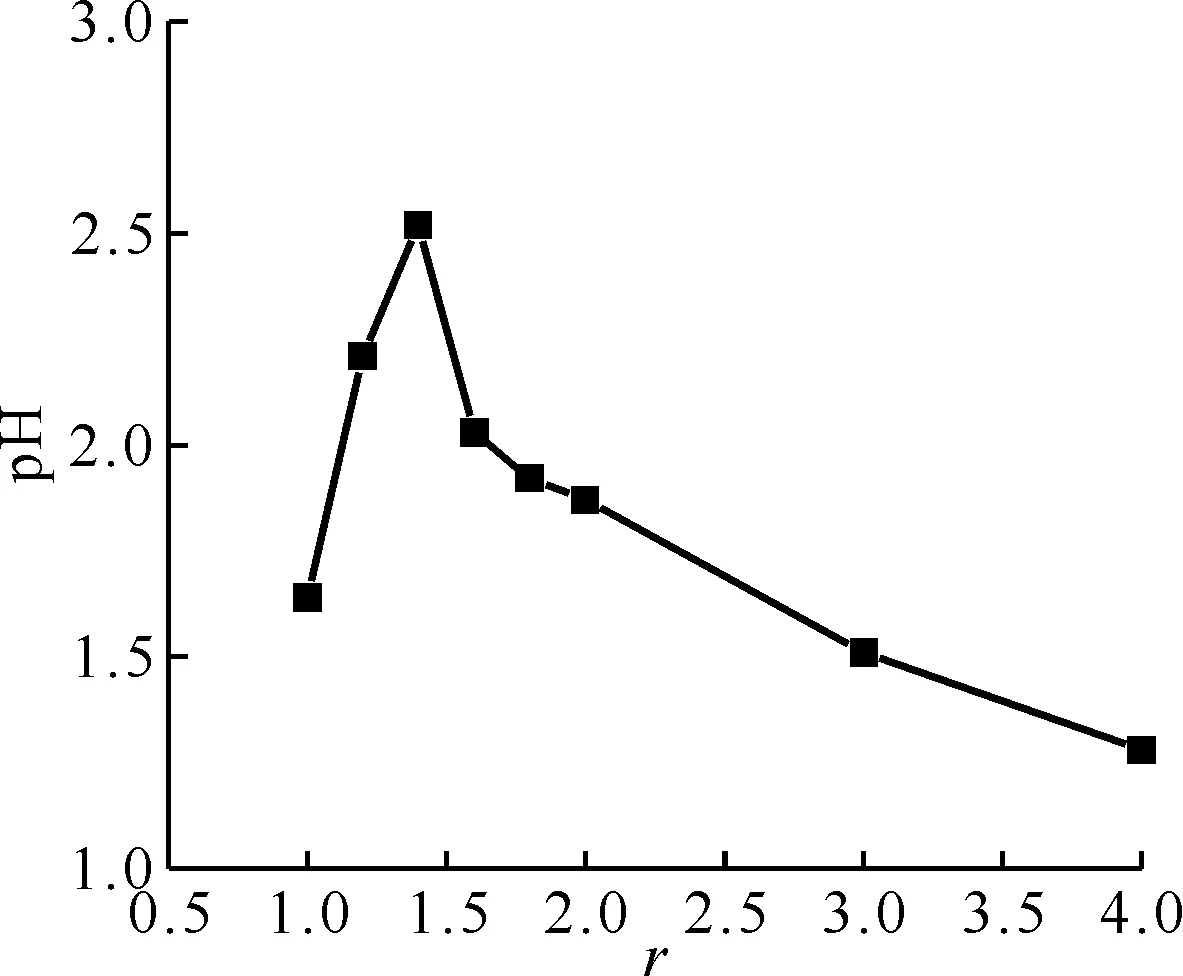
圖1 不同甲硝比脫硝后上清液的pH
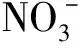
r=1.4
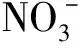
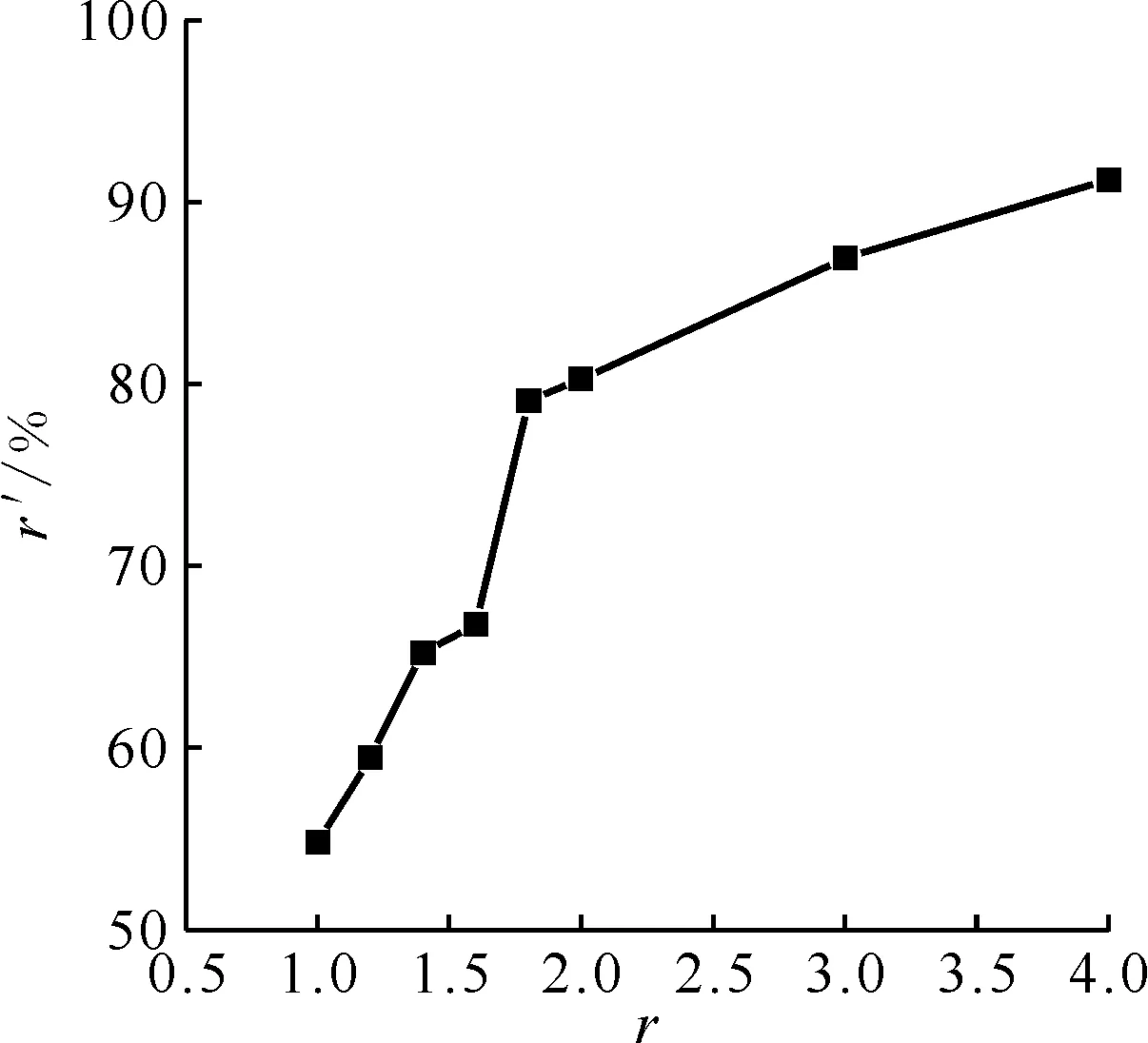
2.2 不同甲硝比的脫硝率
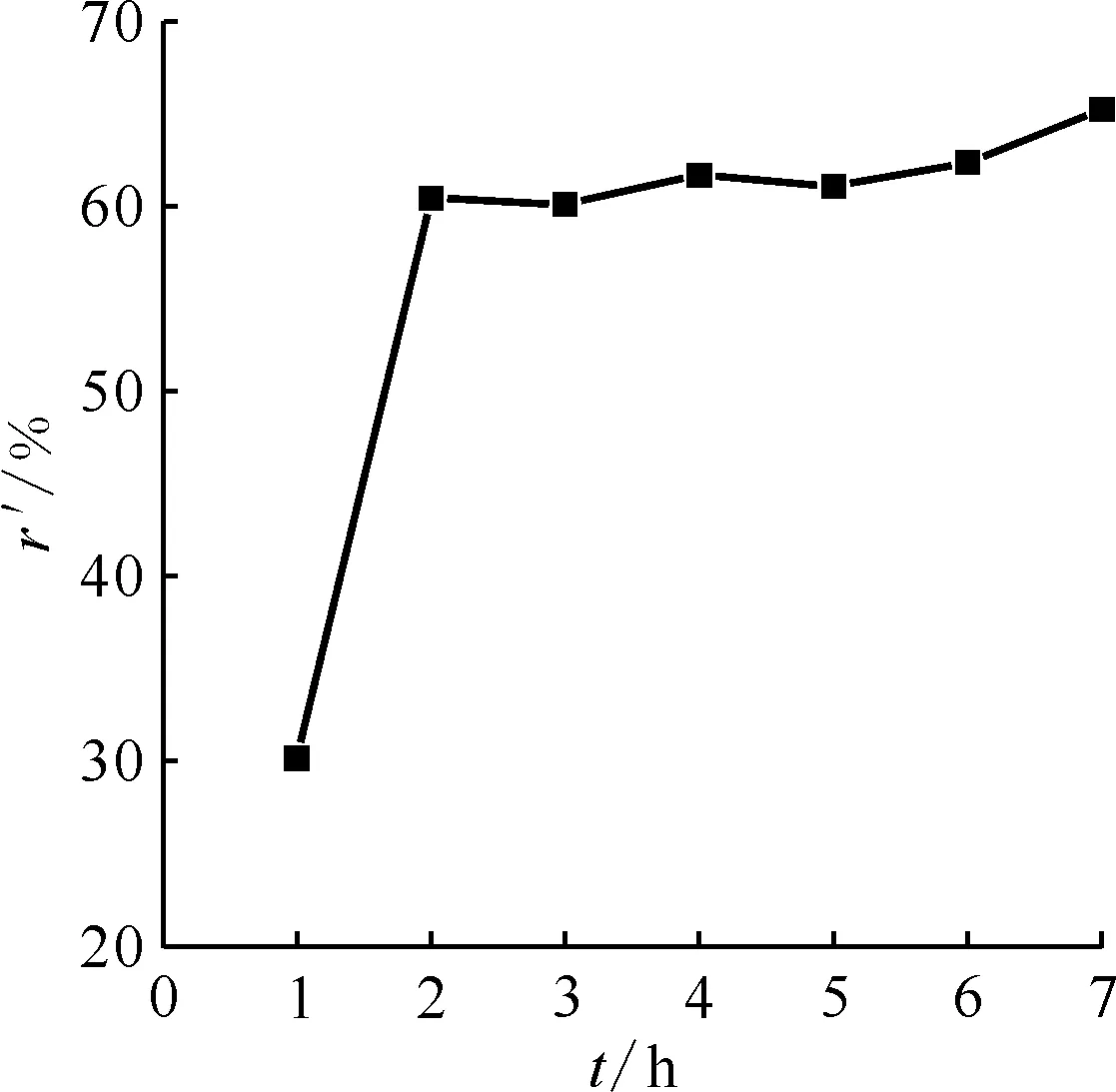
甲酸脫硝過程存在一個誘導期,其實質為脫硝反應重要中間產物——HNO2的累積過程。此外,脫硝過程中也會產生自由基HCOO·、HNO·,這些自由基和HNO2對氮氧化物的產生至關重要,脫硝過程中自由基涉及的反應如下[12]:

(9)
(10)

(11)

(12)

(13)

(14)
由于誘導期的存在,剛開始將甲酸加入模擬高放廢液中并沒有馬上反應,而是經過一段時間后才有反應發生,且反應劇烈,但持續時間很短。甲酸脫硝的速率與HNO3的濃度相關,HNO3濃度越大脫硝反應也越容易進行,脫硝速率越快,當溶液中HNO3濃度小于1.5 mol/L,脫硝反應的速率會降低[13]。溶液中HNO3濃度降低時,生成的HNO2含量也隨之降低,氮氧化物的形成速率也降低,脫硝速率降低。
2.3 脫硝后上清液Raman光譜分析
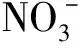

r:1——1.0,2——1.2,3——1.4,4——1.6,5——1.8,6——2.0,7——3.0,8——4.0
2.4 脫硝反應沉淀的成分分析
采用XRF法測定了脫硝過程沉淀中各元素的質量分數,結果示于圖6。由圖6可知:模擬高放廢液中的元素除了Cs和Ba外,其他元素在沉淀中的質量分數(w′)與脫硝前溶液中的質量分數(w)大體呈正比;各元素質量分數的變化不同,Zr、Mo、Fe質量分數隨著甲硝比的增加而減少,而Ce、Nd、La、Gd、Pr、Sm、Y、Eu則相反,其質量分數隨著甲硝比的增加而增加。
圖6 不同甲硝比脫硝前后沉淀中元素含量
脫硝過程中金屬離子的沉淀,主要有水解、共沉淀以及和甲酸形成的化合物。由于各金屬離子的水解及和甲酸反應的條件不同,因此采用不同甲硝比脫硝后,沉淀中各個元素的質量分數不同。
2.5 脫硝產物的熱重分析
高放廢液煅燒前,要進行脫硝預處理,煅燒過程中的煅燒溫度由脫硝產物決定。采用熱重方法研究了不同甲硝比時脫硝產物的熱分解性能,其結果示于圖7。由圖7可知:脫硝產物分解有三個階段,第一階段為水的蒸發,之后的兩個階段為脫硝產物的分解。第一階段失重約為5%,不同甲硝比脫硝產物失重達到5%的溫度不同,由100~230 ℃;第二階段脫硝產物的分解失重約為20%,脫硝產物分解的第二階段,不同甲硝比脫硝產物的失重不同,從10%~20%,r<1.6,隨著甲硝比的增加,失重量增加,r>1.6,失重量接近。脫硝產物的分解起始溫度與終止溫度和甲硝比有關,分解起始溫度隨著甲硝比的增加而增加;r<1.6,分解終止溫度也類似,隨著甲硝比的增加而增加,但r>1.6,脫硝產物的分解終止溫度接近。
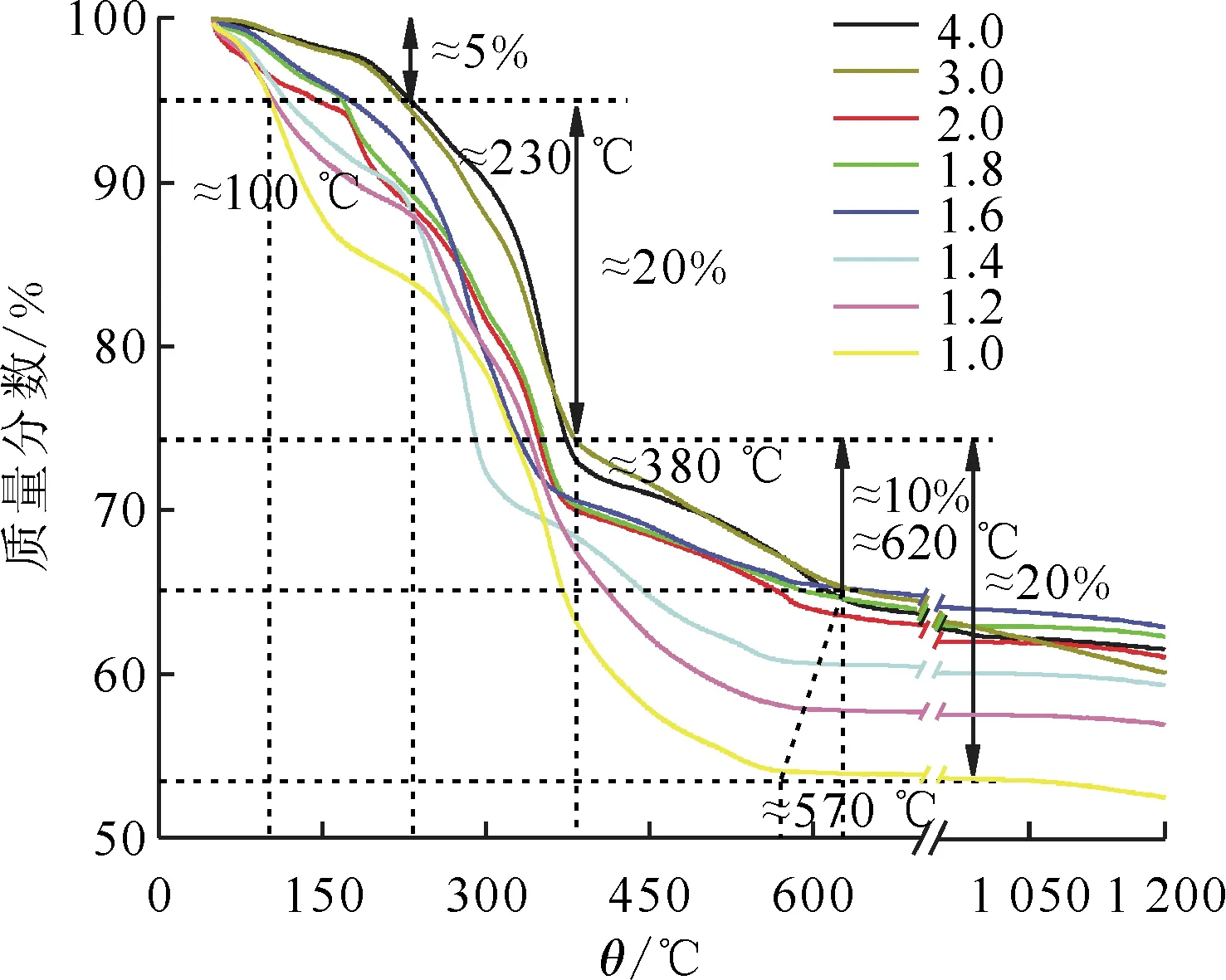
圖7 不同甲硝比脫硝產物的熱分解曲線
脫硝過程中產生的氮氧化物,不僅有溶液中的游離硝酸,也有溶液中的硝酸鹽。脫硝率愈高,硝酸鹽中N、O減少的越多,脫硝產物完全熱分解后其失重量越小。從脫硝產物的失重量和分解終止溫度結果,可認為甲硝比大于1.6之后的脫硝效果接近,而甲硝比小于1.6,不同的甲硝比脫硝效果不同。
3 結 論
脫硝過程中,硝酸在第一個小時基本消耗,脫硝率隨著甲硝比的增加而升高;甲硝比為1.4時,脫硝后溶液的pH最高。在脫硝過程中各元素在沉淀中的含量與甲硝比有關,Zr、Mo、Fe的質量分數隨著甲硝比的增加而減少,而Ce、Nd、La、Gd、Pr、Sm、Y、Eu的質量分數隨著甲硝比的增加而增加。甲硝比大于1.6時,脫硝產物完全熱分解后的失重接近。根據脫硝后溶液pH、脫硝率、甲酸的用量以及脫硝產物的熱重分析,可選取甲硝比為1.4~1.6作為脫硝的工藝參數。

