超聲處理對鯽魚皮膠原蛋白的自組裝行為和理化性質影響
賈俊強,孫晟源,周曉瑞,繆 楠,朱玉杰,吳瓊英,
(1.江蘇科技大學糧食學院,江蘇 鎮江 212004;2.江蘇科技大學生物技術學院,江蘇 鎮江 212018)
膠原蛋白是生物體中最主要的結構蛋白,目前已知有I、II型和III型等28 種膠原蛋白,主要存在于動物的皮、骨和肌腱等結締組織中,其中I型膠原蛋白具有弱的抗原性、良好的生物相容性和降解性,廣泛用于食品添加劑、生物醫學材料、醫學組織工程等領域[1-2]。目前生產的膠原蛋白制品主要來源于豬、牛和雞等陸生動物,但因受瘋牛病、口蹄疫和禽流感等流行病的影響限制了陸生動物膠原蛋白的應用[3]。與陸生動物膠原蛋白相比,魚類膠原蛋白在生物安全性上具有更大的優勢,現已受到國內外學者的高度關注[4]。我國是世界漁業大國,魚加工過程中產生的大量廢棄物中均富含膠原蛋白,其中,魚皮中粗膠原蛋白約占80%,且魚皮中膠原蛋白以I型膠原為主[5-6],具有良好的應用前景。因此,關于魚源膠原蛋白資源開發與應用的研究已成為熱點[7]。
自組裝是天然膠原蛋白的重要分子行為特征,可通過大量非共價鍵弱相互作用形成具有交錯條紋結構的膠原纖維,起到改善膠原蛋白纖維的生物學性能的作用[8-9]。現已發現賴氨酸和谷氨酸[8]、氨基胍[10]和海藻酸鹽[11]等化合物能夠影響膠原蛋白的自組裝過程,改善其生物特性。
超聲波是一種綠色的物理改性方法,具有操作簡單、成本低、可控性好的特點,在食品工業中已得到廣泛的應用[12]。Jiang Ying等[13]發現超聲波的空化作用能夠提高草魚皮膠原蛋白的自組裝速率,改善其膠原蛋白的黏彈性和結構特性;此外,Akram等[14]也發現超聲處理改變了雞胸骨軟骨膠原蛋白的微觀結構,形成了多層和多孔的膠原海綿。盡管魚皮膠原蛋白的自組裝行為已有研究[13],但關于鯽魚皮膠原蛋白的自組裝行為還鮮見報道。現有研究表明,不同種類魚的外皮膠原蛋白自組裝行為不盡相同,如草魚皮和鱈魚皮的膠原蛋白自組裝行為,兩者表現出完全不同的自組裝歷程[13,15]。因此,本實驗以鯽魚皮膠原蛋白為原材料,通過超聲波預處理鯽魚皮膠原蛋白,探究超聲波對鯽魚皮膠原蛋白的自組裝動力學和理化特性的影響,為超聲波在膠原蛋白改性方面的應用提供理論依據。
1 材料與方法
1.1 材料與試劑
新鮮鯽魚購于鎮江市萬達廣場蘇果超市;小鼠胚胎成纖維細胞NIH/3T3由江蘇科技大學生物技術學院提供。
噻唑藍(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、二甲基亞砜(dimethyl sulfoxide,DMSO)、胎牛血清、DMEM培養基、胰酶 美國Gibco公司;10~170 kDa蛋白Marker北京索萊寶科技公司;其他試劑均為分析純。
1.2 儀器與設備
Lyo Quest真空冷凍干燥機 西班牙Telstar公司;756CRT紫外-可見分光光度計 翱藝儀器(上海)有限公司;Mini-Protean垂直電泳儀 美國Bio-Rad公司;F4600熒光分光光度計 日本日立公司;Ntegra Prima原子力顯微鏡 俄羅斯NT-MDT公司;XTL-206A顯微鏡上海締倫光學儀器有限公司;Q700超聲破碎儀 美國Qsonica公司;HWCL-5集熱式恒溫磁力攪拌浴 鄭州長城科工貿公司;J-1500型圓二色光譜儀 日本Jasco公司。
1.3 方法
1.3.1 鯽魚皮膠原蛋白的制備
根據汪海嬰等[16]的方法,將魚皮剔除魚肉后洗滌干凈,切碎,用0.5 mol/L的乙酸溶液于4 ℃下浸提24 h,紗布過濾獲取濾液。重復提取兩次,收集濾液,5 000 r/min離心30 min,取上清液,添加NaCl固體粉末至終濃度為4 mol/L,攪拌后靜置鹽析24 h,過濾保留沉淀,用0.5 mol/L的乙酸溶液復溶沉淀,再次添加NaCl至濃度為0.9 mol/L,鹽析保留沉淀,0.5 mol/L乙酸復溶,先用0.01 mol/L乙酸透析24 h,再用蒸餾水透析12 h,然后冷凍干燥后備用。
1.3.2 超聲處理及樣品制備
將鯽魚皮膠原蛋白以質量分數0.2%溶解于0.5 mol/L的乙酸溶液中,充分攪拌均勻后進行超聲處理,處理過程中樣品溶液持續保持在冰浴中;超聲處理的單因素試驗設計為:樣品溶液在不同超聲功率(0、100、200、400、600 W)下處理5 min,用來研究超聲功率對鯽魚皮膠原蛋白自組裝行為的影響;在此基礎上,選擇適宜的超聲功率,用來研究不同超聲時間(0、1、5、10、25 min)對鯽魚皮膠原蛋白自組裝行為的影響。
1.3.3 自組裝行為觀察
根據參考文獻[13]的方法,并稍加修改。將超聲波處理的膠原蛋白樣品溶液稀釋到質量分數為0.1%,調節pH值至7.2,加入質量濃度150 g/L NaCl溶液(pH 7.2)至濃度為0.2 mol/L,立即置于20 ℃水浴中進行自組裝,每隔30 s在波長313 nm處測定吸光度,繪制自組裝動力學曲線。
1.3.4 十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳
將樣品溶于0.05 mol/L Tris-HCl緩沖液(pH 6.8,甘油質量濃度100 g/L、SDS質量濃度20 g/L、溴酚藍質量濃度1 g/L、巰基乙醇質量濃度10 g/L),沸水浴處理2 min并離心(5 000 r/min,1 min),取上清液進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)分析,SDS-PAGE凝膠由質量分數8%分離凝膠和質量分數5%濃縮凝膠組成,電泳設定為80 V、20 min,然后120 V、90 min。電泳后,將凝膠用考馬斯亮藍R-250溶液染色30 min,并在37 ℃反復脫色。
1.3.5 熒光光譜分析
利用膠原蛋白內源性酪氨酸殘基為熒光標記,使用熒光分光光度計樣品進行熒光掃描,激發波長設定為280 nm,發射波長為290~500 nm,激發和發射光譜狹縫為5 nm,掃描速率為1 200 nm/min。
1.3.6 圓二色光譜分析
采用J-1500型圓二色光譜儀研究膠原蛋白的二級結構,樣品的質量分數為0.1%,掃描波長范圍為190~250 nm,比色皿光徑1 mm,帶寬1 nm,分辨率0.5 nm,掃描速率500 nm/min。
1.3.7 微觀結構觀察
原子力顯微鏡觀察:將5 μL自組裝反應液(膠原蛋白質量濃度1.0 g/L)置于新鮮剝離的云母片表面,20 ℃下自組裝1 h,室溫陰干24 h,置于原子力顯微鏡下觀察。掃描模式為輕敲模式,掃描面積20 μm×20 μm、2 μm×2 μm,所有樣品均在室溫下成像。
顯微鏡觀察:將自組裝產物在-80 ℃快速冷凍,冷凍干燥后,膠原蛋白成海綿狀,剪取厚為1 mm的片狀橫截面,置于黑色載玻片上,在20 倍物鏡下用XTL-206A顯微鏡觀察,并使用連接到顯微鏡的EOS 6D數碼相機拍攝照片,每個樣品連續拍照100 次,并使用Photoshop CS6軟件對這些照片進行疊加優化處理。
1.3.8 細胞增殖實驗
采用MTT比色法測定細胞增殖實驗[13]。NIH/3T3細胞(4×103個/孔)接種在96 孔板中,在37 ℃和體積分數5% CO2下培養12 h后,加入100 μL膠原蛋白溶液(空白對照組不添加鯽魚皮膠原蛋白),以磷酸鹽緩沖液(phosphate buffered saline,PBS)為對照(未處理組),培養72 h,每孔加入100 μL質量濃度1 mg/mL MTT,在37 ℃繼續培養4 h后棄掉培養液,再加入100 μL DMSO后振蕩孵育10 min,在540 nm波長處測定吸光度。
1.4 數據統計與分析
實驗數據用平均值±標準偏差表示,采用Origin 8.0軟件進行統計學分析,組間比較采用t檢驗,P<0.05表示差異顯著。
2 結果與分析
2.1 超聲預處理對膠原蛋白的組裝動力學影響

圖1 不同超聲條件下鯽魚皮膠原蛋白裝配的濁度-時間曲線Fig. 1 Turbidity-time curves for self-assembly of collagen from Carassius auratus skin under different ultrasonic treatment conditions
膠原蛋白的自組裝進程可分為成核期(吸光度基本不變)、組裝期(吸光度迅速增加)和平衡期(吸光度達到最大并保持恒定),呈現典型的S型曲線[17]。由圖1可知,鯽魚皮膠原蛋白隨著自組裝時間的增加,在313 nm波長處的吸光度先保持不變,然后迅速升高至最高值并保持不變,符合S型曲線特征,這表明本實驗條件下鯽魚皮膠原蛋白能夠正確自組裝。圖1A表明未處理的鯽魚皮膠原蛋白成核期為600 s,組裝期為600~1 400 s;在超聲波100 W和200 W處理后,其成核期為420~480 s,組裝期為480~1 290 s,與超聲處理前相比,成核期明顯縮短,這表明100 W和200 W處理增加了膠原蛋白的纖維形成率;在超聲波400 W和600 W處理后,其成核期為630~690 s,組裝期為1 410~1 440 s,與超聲處理前相比,成核期明顯延長,這表明400 W和600 W處理降低了膠原蛋白的纖維形成率。研究結果表明,低功率超聲處理有利于鯽魚皮膠原蛋白的自組裝,其中超聲功率為200 W時效果最好。
由圖1B可知,超聲時間對鯽魚皮膠原蛋白的自組裝進程有明顯影響,在200 W處理1~10 min后,鯽魚皮膠原蛋白的成核期從處理前的600 s縮短至390~420 s,超聲處理增加了膠原蛋白的纖維形成率,但隨著超聲時間延長,膠原纖維形成率的增長速率卻逐漸越低,其中,200 W處理1 min時效果最好。此外,超聲處理25 min的鯽魚皮膠原蛋白的自組裝曲線的S型不明顯,這可能是長時間的空化作用導致鯽魚皮膠原蛋白部分降解[18],使其失去自組裝能力。
2.2 SDS-PAGE分析結果

圖2 不同超聲條件下鯽魚皮膠原蛋白的SDS-PAGEFig. 2 SDS-PAGE pattern of collagen from Carassius auratus skin under different ultrasonic treatment conditions
由圖2可知,鯽魚皮膠原蛋白存有兩條120 kDa左右的α亞基和一條200 kDa左右的β亞基,α亞基包含α1亞基和α2亞基,α1亞基的含量約為α2亞基的2 倍,有典型的I型膠原蛋白特征[19-20]。超聲功率對鯽魚皮膠原蛋白的亞基含量影響不明顯,在超聲功率100~200 W,膠原蛋白的α1亞基的含量繼續保持在α2亞基的2 倍左右,但當超聲功率在400 W和600 W時,α1亞基的含量略有減少,這種2 倍關系發生了改變,說明高功率超聲的空化作用可能引起膠原蛋白局部降解,使膠原蛋白的I型特征逐漸弱化,這與上述超聲功率對鯽魚皮膠原蛋白自組裝動力學的影響趨勢基本一致(圖1A)。超聲時間對鯽魚皮膠原蛋白的亞基含量略有影響,在1~10 min時,膠原蛋白的α1亞基的含量基本保持在α2亞基的2 倍左右,但當超聲時間達到25 min時,α1亞基含量與α2亞基含量的2 倍關系被打破,膠原蛋白的I型特征弱化,這表明長時間的超聲空化作用可能會導致膠原蛋白發生部分降解,這一現象與上述超聲時間對鯽魚皮膠原蛋白自組裝動力學的影響趨勢基本一致(圖1B)。
2.3 熒光光譜分析結果
色氨酸、酪氨酸和苯丙氨酸是組成蛋白質的基本氨基酸,因其含有苯環或共軛雙鍵結構能夠使蛋白質產生內源性熒光,常被用來分析蛋白質的結構變化[21-22]。在激發波長280 nm處,色氨酸、酪氨酸和苯丙氨酸殘基通常在發射波長282、305 nm和348 nm處有最高熒光強度,其中,酪氨酸和色氨酸殘基的熒光強度較強,而苯丙氨酸殘基的熒光強度最弱,這與其易淬滅有關[23]。在膠原蛋白中,色氨酸和苯丙氨酸含量通常較低[24],因此,選擇酪氨酸作為鯽魚皮膠原蛋白的內源熒光,如圖3所示。在超聲功率0~400 W,膠原蛋白的最大熒光強度隨著超聲功率的增加而增加;當超聲功率增大到600 W時,膠原蛋白的最大熒光強度下降,但仍然高于未處理組,這表明超聲波的空化作用導致了鯽魚皮膠原蛋白分子伸展,使分子內部酪氨酸殘基暴露,熒光強度增加,這與超聲波對麥胚清蛋白的熒光光譜影響基本一致[25](圖3A)。超聲時間對鯽魚皮膠原蛋白的熒光強度有顯著影響,隨著超聲時間的延長,熒光強度呈現不規律變化,但都明顯高于未處理組。這表明在超聲波空化作用下,膠原蛋白可能存在分子伸展和自裝配兩個過程,因為分子伸展程度要遠遠大于自裝配過程,使分子整體表現為分子伸展[25](圖3B)。此外,與未處理組相比,超聲處理后鯽魚皮膠原蛋白的發射波長藍移了約3 nm,這進一步表明超聲處理引起了鯽魚皮膠原蛋白的分子結構變化。
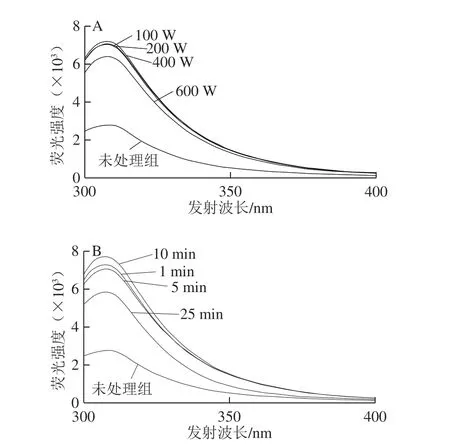
圖3 不同超聲條件下鯽魚皮膠原蛋白的熒光光譜Fig. 3 Fluorescence spectra of collagen from Carassius auratus skin under different ultrasonic treatment conditions
2.4 圓二色光譜分析結果
圓二色光譜借助于生物大分子的手性結構能產生左、右旋圓偏振光不同的吸光度,這可以用來分析生物分子結構,在膠原蛋白三股螺旋結構分析中也得到了廣泛應用[26]。超聲波處理對鯽魚皮膠原蛋白圓二色光譜的影響如圖4A、圖5A所示。鯽魚皮膠原蛋白在195~214 nm波長處出現一個低谷,在215~235 nm波長處出現一個高峰,呈現出典型的Cotton效應[27]。膠原蛋白通常在225 nm波長處有一個正吸收峰,在197 nm波長處有一個負吸收峰[19],然而鯽魚皮膠原蛋白的負吸收峰則紅移約9 nm,這主要與膠原蛋白的不同來源、氨基酸序列和分子質量大小有關[26],如鰱魚鱗膠原蛋白在202 nm波長處有強負吸收峰,負吸收峰同樣紅移了5 nm[28]。正負Cotton效應的比(ratio of positive to negative,RPN)值與膠原蛋白的螺旋程度呈正相關性,反映了膠原分子中螺旋區域與非螺旋區域的相對含量[29]。與未處理組相比,100 W超聲處理后膠原蛋白的三股螺旋含量基本沒變;但當超聲功率在200~600 W時,鯽魚皮膠原蛋白的三股螺旋含量明顯降低(圖4B);另外,隨著超聲處理時間的延長,鯽魚皮膠原蛋白的三股螺旋含量也明顯降低(圖5B),這說明高功率和長時間的超聲波處理會引起膠原蛋白解螺旋,出現三股螺旋向單體的轉變[30],最終引起鯽魚皮膠原蛋白的自組裝動力學發生變化。

圖4 不同超聲功率下鯽魚皮膠原蛋白的圓二色光譜和RPN值Fig. 4 Circular dichroism spectra and RPN values of collagen from Carassius auratus skin treated with different ultrasonic powers


圖5 不同超聲時間下鯽魚皮膠原蛋白的圓二色光譜和RPN值Fig. 5 Circular dichroism spectra and RPN values of collagen from Carassius auratus skin with different sonication durations
2.5 鯽魚皮膠原蛋白微觀形態分析結果
原子力顯微鏡常被用于觀察膠原蛋白的纖維形態。將超聲處理前后鯽魚皮膠原蛋白在自組裝環境下沉積在云母片上,然后采用原子力顯微鏡觀察其微觀結構,結果如圖6所示。膠原纖維的分支易發生交聯作用,交織后形成網狀結構[13-16],未處理的鯽魚皮膠原蛋白纖維之間交聯性較弱,膠原纖維所形成的網狀結構的空隙較大,且分布不均勻;而經超聲處理(200 W、1 min)后,膠原纖維交聯性增強,膠原纖維之間的結合變得緊密,所形成的網狀結構的空隙變小,分布也比較均勻。

圖6 超聲處理前后鯽魚皮膠原蛋白的原子力顯微鏡圖像Fig. 6 Atomic force microscope images for the morphology of collagen from Carassius auratus skin before and after ultrasonic treatment
采用顯微鏡在20 倍物鏡下觀察鯽魚皮膠原蛋白的橫截面(圖7),與未處理的膠原蛋白相比,經超聲處理的膠原蛋白形成了更加疏松多孔的網絡狀結構,這一現象與超聲處理對雞胸骨軟骨膠原蛋白微觀形態的影響一致[14]。
綜上所述,微觀形態分析表明了適度超聲波處理不僅能促進膠原蛋白的自組裝,而且能夠改善其纖維結構。

圖7 超聲處理前后鯽魚皮膠原蛋白的顯微鏡圖像Fig. 7 Microscopic images for the morphology of collagen from Carassius auratus skin before and after ultrasonic treatment
2.6 NIH/3T3細胞增殖能力分析結果
NIH/3T3是小鼠胚胎的成纖維細胞,能夠誘導膠原蛋白和細胞因子的分泌,參與肉芽的生成,修復損傷與傷口[31]。超聲處理對鯽魚皮膠原蛋白促進NIH/3T3細胞增殖能力見圖8。

圖8 超聲處理對鯽魚皮膠原蛋白的NIH/3T3細胞增值能力的影響Fig. 8 Effect of ultrasonic treatment on NIH/3T3 cell proliferation capacity of collagen from Carassius auratus skin
由圖8A可知,在相同超聲時間(5 min)下,超聲功率對鯽魚皮膠原蛋白促進NIH/3T3細胞增殖能力有顯著影響(P<0.05)。與未處理組相比,超聲功率在100 W和200 W下均能顯著提高NIH/3T3細胞的增殖活性(P<0.05),其中200 W的效果最好,可使NIH/3T3細胞的增殖能力提高8.2%;而在400 W和600 W處理下,鯽魚皮膠原蛋白的NIH/3T3細胞增殖活性略有下降,這可能與高功率超聲處理導致膠原蛋白部分降解有關。
從圖8B可知,在200 W超聲功率下處理1~10 min,均能顯著提高NIH/3T3細胞的增殖活性(P<0.05),其中超聲處理1 min效果最好,比未處理組提高了10.1%;當超聲處理25 min后鯽魚皮膠原蛋白的NIH/3T3細胞增殖活性則顯著下降(P<0.05),比未處理組降低了7.9%,這可能是長時間的超聲空化作用降解了膠原蛋白纖維。上述結果表明,在超聲功率200 W處理1~10 min均能有效改善鯽魚皮膠原蛋白的NIH/3T3細胞增殖活性,這可能與超聲處理后膠原蛋白形成多層多孔的網狀結構有關,這些多孔網狀結構增加了膠原蛋白的比表面積,有利于NIH/3T3細胞膜吸附作用,促進中層黏連蛋白的分泌,從而使細胞增殖活性增加[32]。
3 結 論
鯽魚皮膠原蛋白是一種I型膠原蛋白。在超聲200 W處理1 min后,鯽魚皮膠原蛋白的成核期明顯縮短,纖維生成率也得到提高。通過比較超聲波處理前后鯽魚皮膠原蛋白的SDS-PAGE圖譜、熒光光譜、圓二色光譜和微觀形態,發現過度的超聲空化作用會引起膠原蛋白亞基降解和三股螺旋結構解螺旋,膠原I型特征弱化;與未處理組相比,超聲處理的熒光吸收強度明顯增加,發射波長也藍移約3 nm,自組裝后的膠原蛋白的纖維粗細均勻、呈現疏松多孔的網狀結構。這些結果表明超聲處理改變了鯽魚皮膠原蛋白的分子結構。此外,細胞增殖實驗表明,適度超聲波處理能夠顯著改善鯽魚皮膠原蛋白的NIH/3T3細胞增殖能力(P<0.05),超聲功率200 W和超聲時間1 min的條件最佳,與未處理組相比,可使鯽魚皮膠原蛋白的NIH/3T3細胞增殖活性提高10.1%。

