多糖對腫瘤細胞自噬調(diào)控作用的研究進展
徐涵禹,李雨婷,金周雨,,宋 慧,2,
(1.吉林農(nóng)業(yè)大學生命科學學院,吉林 長春 130118;2.吉林農(nóng)業(yè)大學 教育部食藥用菌工程研究中心,吉林 長春 130118)
多糖作為生物大分子物質(zhì)與蛋白質(zhì)、核苷酸等共同在生物體的生長發(fā)育中有極其重要的作用,多糖具有調(diào)節(jié)免疫系統(tǒng)、抑制腫瘤細胞的生長、使腫瘤細胞周期阻滯并誘導其發(fā)生細胞凋亡[1]、抗心血管的生成和轉(zhuǎn)移[2-3]等方面的作用。目前,多糖因其高效率和低毒性的特點,已成為醫(yī)藥科學領(lǐng)域研究的重點。
自噬是一種細胞程序性死亡機制,類似于細胞凋亡和壞死,調(diào)節(jié)細胞發(fā)生自噬性死亡[4],其在進化上是一種高度保守的自我降解過程,在細胞應激反應及存活中起到關(guān)鍵作用[5]。細胞自噬是在細胞內(nèi)基因表達調(diào)控下進行的一種主動過程[6-7]。自噬在人體健康和疾病中的重要性得到了更廣泛的關(guān)注,其中尤為重要的是自噬在癌癥中的作用[8]。本文將圍繞多糖對腫瘤細胞自噬的影響展開綜述。
1 細胞自噬
1.1 自噬的過程
細胞自噬是指細胞在外界因素的影響下,對其內(nèi)部受損的細胞器、錯誤折疊的蛋白質(zhì)和侵入機體的病原體進行降解的生物學過程[9]。根據(jù)胞內(nèi)物質(zhì)運送至溶酶體內(nèi)的途徑不同,將自噬分為巨自噬、微自噬[10]及分子伴侶介導的自噬[11]。巨自噬是在即將發(fā)生自噬的細胞質(zhì)中出現(xiàn)大量游離的膜性結(jié)構(gòu),這些膜性結(jié)構(gòu)逐漸包裹受損的蛋白質(zhì)和細胞器,形成獨立有核的囊狀結(jié)構(gòu)并逐漸延伸成為自噬囊泡,然后自噬囊泡邊緣融合形成自噬小體,隨后自噬小體與溶酶體融合形成自噬溶酶體,最后降解所包裹的內(nèi)容物的過程[12];微自噬包含兩種自噬方式,分別為選擇性微自噬和非選擇性微自噬,選擇性微自噬是指特定細胞器直接靶向作用于溶酶體來介導自噬,非選擇性微自噬是通過管狀膜內(nèi)陷到溶酶體中直接吞噬細胞器及其組分介導自噬;分子伴侶介導的自噬是一種選擇性自噬形式,涉及熱休克蛋白70復合物和溶酶體膜相關(guān)蛋白2A的多聚化[13-14]。目前有關(guān)自噬的研究中,巨自噬相較于微自噬和分子伴侶介導的自噬報道較多。
1.2 腫瘤細胞自噬
自噬是一種存在于正常細胞中的生理過程,自噬失調(diào)會產(chǎn)生各種疾病,如神經(jīng)退行性疾病[15]、感染性疾病[16]、血管疾病、免疫系統(tǒng)疾病[17]和癌癥[18]。機體饑餓,缺氧及缺乏能量的情況下,自噬又是一種重要的細胞存活機制[19]。Aita等[20]在自噬與腫瘤發(fā)生的研究中發(fā)現(xiàn),自噬相關(guān)基因Beclin-1缺失的小鼠發(fā)生了原發(fā)性腫瘤,隨后在乳腺癌、卵巢癌、前列腺癌中也發(fā)現(xiàn)了有等位基因Beclin-1缺失的現(xiàn)象,使用熒光探針鑒定出22 個乳腺癌細胞系存在9 個等位基因Beclin-1的缺失。自噬過程是動態(tài)變化的,并可以在不同組織細胞中以不同的速率發(fā)生,自噬體的形成、自噬性底物向溶酶體的運送以及在溶酶體內(nèi)降解的整個過程稱為自噬流。研究表明,隨著在腫瘤細胞生長時間的延長,自噬流可能會隨著腫瘤生長量的上調(diào)或下調(diào)[21],產(chǎn)生兩種完全不同的自噬狀態(tài)。
一方面,有研究發(fā)現(xiàn)自噬上調(diào)會促進癌細胞死亡,Arcella等[22]在使用雷帕霉素誘導自噬從而使小鼠膠質(zhì)母細胞瘤細胞減小的實驗中證明,雷帕霉素誘導的自噬上調(diào)可以延長小鼠的存活時間并使腫瘤的體積變小;Zhou Chunxian等[23]在自噬影響結(jié)直腸癌細胞生長的實驗中也證明了自噬相關(guān)蛋白(autophagy-related protein,Atg)基因5(Atg5)的上調(diào),誘導結(jié)直腸癌細胞死亡。Liu Guoke等[24]發(fā)現(xiàn)自噬可以促進癌細胞存活并增加對化療藥物的耐藥性。另一方面,有研究發(fā)現(xiàn)抑制腫瘤細胞自噬,可以減少腫瘤細胞的生長,使細胞凋亡數(shù)增加,Jin Fangfang等[25]研究結(jié)果表明,抑制自噬的表達可以促進細胞凋亡并增強肝癌細胞對化療的敏感性;使用氯喹或通過下調(diào)Atg7抑制自噬可以促進細胞凋亡,進而誘導細胞死亡[26]。因此,癌癥治療中是否應該增強自噬[27-28]是值得深入探討的問題。后文將圍繞信號通路闡述自噬的形成過程及多糖對自噬的調(diào)控作用。
2 多糖調(diào)控自噬相關(guān)信號通路
多糖對自噬相關(guān)機制的研究主要集中在磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和腺苷一磷酸激活蛋白激酶(adenosine-monophosphateactivated protein kinase,AMPK)等信號通路,在自噬起始步驟中,Atg1/Unc-51樣激酶1(Unc-51-like kinase 1,ULK1)、Atg13基因及分子質(zhì)量為200 kDa的黏著斑激酶家族相互作用蛋白(focal adhesion kinase family interacting protein of 200 kDa,F(xiàn)IP200)激酶復合物被mTOR蛋白復合體1(mTORC1)抑制及腺苷一磷酸(adenosine monophosphate,AMP)依賴的AMPK、PI3K/AKT、p38 MAPK激活。在自噬的成核步驟中,ULK1復合物磷酸化并激活Beclin-1/囊泡蛋白分揀(vesicle protein sorting,VPS)4復合物。該復合物包括Beclin-1、VPS34、PI3K、VPS15、Atg14和自噬Beclin-1調(diào)節(jié)因子1(activating molecule in Beclin-1 regulated autophagy,AMBRA-1),起始蛋白和成核蛋白均促進自噬囊泡膜的形成。這種膜可以來自線粒體、質(zhì)膜或內(nèi)質(zhì)網(wǎng)[29]。在成熟步驟中,自噬體形成需要兩個獨特的蛋白質(zhì)偶聯(lián)事件:1)Atg7和Atg10結(jié)合至Atg5和Atg12;2)Atg7、Atg3和Atg1與輕鏈3(light chain 3,LC3)共軛結(jié)合[30-31]。Atg5-Atg12結(jié)合物與自噬相關(guān)16樣蛋白1(Atg 16-like 1,Atg16L1)形成復合物,Atg5-Atg12-Atg16L1復合物錨定在VPS34上,通過含有多個保守的WD基元的蛋白質(zhì)重復結(jié)構(gòu)域,與磷酸肌醇(phosphatidylinosito-2b,WIPI-2b)相互作用產(chǎn)生新的自噬體膜。自噬相關(guān)信號通路指示圖如圖1所示。
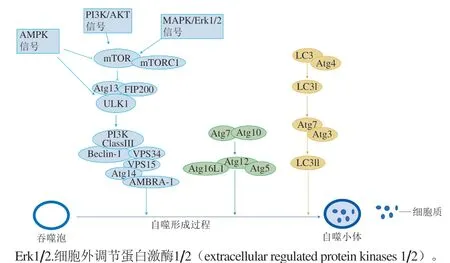
圖1 自噬相關(guān)信號通路指示圖Fig. 1 Autophagy-related signaling pathways
2.1 多糖調(diào)控PI3K/AKT/mTOR信號通路
PI3K/AKT/mTOR信號通路的機制靶標參與細胞生長、增殖與分化、凋亡與自噬,并在腫瘤的發(fā)生、發(fā)展及治療中起著至關(guān)重要的作用。PI3K刺激信號級聯(lián)產(chǎn)生磷脂酰肌醇三磷酸并促進AKT的激活;AKT是抑制細胞凋亡促進細胞存活的相關(guān)蛋白;mTOR激酶是吞噬誘導過程中的關(guān)鍵分子,磷酸化AKT作用于mTOR,激活mTOR通路,這些作用能增強細胞增長的蛋白質(zhì)表達。PI3K/AKT/mTOR信號通路的調(diào)節(jié)可以增強或抑制自噬。這條通路是癌癥治療的關(guān)鍵靶點,因為它可以作為許多生長刺激的匯聚點,通過其下游底物控制改善癌癥發(fā)生和維持的細胞穩(wěn)態(tài)的過程[32]。
黃芪多糖抑制白細胞介素(interleukin,IL)-1β刺激的RSC-364細胞中PI3K/AKT/mTOR信號傳導途徑的激活,并通過調(diào)節(jié)PI3K/AKT/mTOR自噬途徑在IL-1β刺激的成纖維細胞樣滑膜細胞中發(fā)揮促凋亡和抗炎作用來降低類風濕性關(guān)節(jié)炎的病理進展[33]。白靈菇多糖(Pleurotus ferulae Lanzi polysaccharide,PN50G)抑制PI3K/AKT磷酸化進而抑制mTOR的活化。體內(nèi)對攜帶腫瘤的小鼠進行成像,結(jié)果表明PN50G能夠顯著增加細胞內(nèi)活性氧(reactive oxygen species,ROS)水平。此外,它表明PN50G以劑量依賴性方式提高Beclin-1和LC3的蛋白表達量。即PN50G介導的A549腫瘤細胞自噬主要通過PI3K/AKT/mTOR通路發(fā)揮作用[34]。枸杞多糖預處理大大減弱了原代培養(yǎng)的海馬神經(jīng)元中的氧葡萄糖剝奪/再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)損傷,增加了OGD/R后的p-AKT和p-mTOR水平,即枸杞多糖通過激活PI3K/AKT/mTOR信號傳導途徑來保護原代海馬神經(jīng)元中的OGD/R誘導的神經(jīng)元損傷[35]。枸杞多糖處理也可誘導人類血管瘤內(nèi)皮細胞凋亡,抑制增殖細胞核抗原、腫瘤增殖抗原、血管內(nèi)皮生長因子(vascular endothelial growth factor,VEGF)、血管內(nèi)皮細胞生長因子受體2(VEGF receptor 2,VEGFR2)和PI3K/AKT信號通路蛋白的表達[36]。
2.2 多糖調(diào)控p38 MAPK信號通路
MAPK參與控制細胞因子和應激細胞反應的信號級聯(lián)反應。p38 MAPK途徑是轉(zhuǎn)錄和翻譯水平的促炎細胞因子生物合成的關(guān)鍵調(diào)節(jié)劑,其使得該途徑的不同組分成為治療自身免疫和炎性疾病的潛在靶標。MAPK通路是細胞增殖、分化、炎癥、凋亡和自噬等信號轉(zhuǎn)導通路的共同交匯通路之一。
有研究發(fā)現(xiàn)脂多糖在小膠質(zhì)細胞中觸發(fā)p 3 8 α MAPK依賴的ULK1磷酸化。該磷酸化抑制ULK1活性,阻止其與下游效應因子Atg13結(jié)合,并減少小膠質(zhì)細胞中的自噬[37]。黃芪多糖聯(lián)合10-羥基喜樹堿(10-hydroxycamptothecin,HCPT)對各種腫瘤細胞具有顯著的抗腫瘤活性[38],包括肺癌細胞、人神經(jīng)細胞瘤細胞、DU145-TxR前列腺癌細胞、肝癌細胞、口腔鱗狀細胞癌和乳腺癌細胞等。已經(jīng)發(fā)現(xiàn)HCPT在體外抑制H1299細胞中的促分裂原活化蛋白激酶3(mitogenactivated protein kinase 3,MAP4K3)活性和Thr389位點處的核糖體S6K蛋白磷酸化。但是,HCPT是否能夠在H1299細胞中誘導自噬尚待闡明。因此,評估了自噬相關(guān)蛋白(LC31/2和P62)的表達,并證明了并通過破壞MAP4K3/mTOR信號轉(zhuǎn)導S6K誘導了H1299細胞的自噬[39]。從金針菇中分離的多糖(Flammulina velutipes polysaccharide,WFVP-N-b1)被Toll樣受體4(Toll-like receptor 4,TLR4)識別,促進了MAPK和AKT的磷酸化,促進核因子κB(nuclear factor kappa-B,NF-κB)p65亞基的核轉(zhuǎn)位和NF-κB的抑制蛋白(inhibitor of NF-κB,IκB)的降解。使用自噬抑制劑(bafilomycin A1,Baf-A1)阻斷WFVP-N-b1誘導的自噬進而降低了巨噬細胞的活化。表明WFVP-N-b1激活巨噬細胞是通過自噬途徑介導的,這是第一份報道自噬介導異半乳聚糖誘導巨噬細胞活化的研究。總地來說,WFVP-N-b1通過MAPKs、AKT/NF-κB信號通路使TLR4受體激活RAW264.7細胞[40]。Erk和p38 MAPK在保護枸杞多糖免受電刺激誘導的細胞損傷方面發(fā)揮了多種作用。枸杞多糖通過調(diào)節(jié)自噬和MAPK途徑改善雙極脈沖電流誘導的小膠質(zhì)細胞(BV-2)損傷[41]。通過自噬雙標腺病毒共定位分析發(fā)現(xiàn)靈芝多糖在CRC細胞中阻斷了自噬體和溶酶體融合,證明了GLP誘導的自噬體積聚和凋亡是通過MAPK/Erk活化介導的。靈芝多糖抑制腫瘤生長并且還抑制體內(nèi)自噬通量。這些結(jié)果揭示了靈芝多糖抗腫瘤作用的新分子機制,表明靈芝多糖是一種有效的自噬抑制劑,可能在腫瘤治療中起重要作用[42]。
2.3 多糖調(diào)控AMPK信號通路
AMPK已被廣泛證明是一種在各種代謝應激下起作用的重要代謝調(diào)節(jié)因子,其中AMPK抑制合成代謝途徑并同時激活分解代謝途徑以實現(xiàn)能量穩(wěn)態(tài)。研究揭示了許多營養(yǎng)信號分子,包括AMPK、AMPK-mTORC1-ULK1三聯(lián)體參與自噬的調(diào)節(jié)[43]。AMPK通過在絲氨酸(Ser)317和Ser777直接磷酸化和激活ULK1促進自噬。PI3K激活AKT使mTOR阻遏物結(jié)節(jié)性硬化癥2磷酸化,導致mTOR活化并隨后抑制自噬活性。
靈芝多糖逆轉(zhuǎn)了由棕櫚酸促進的細胞凋亡和自噬,通過刺激MAPKs和AMPK磷酸化,抑制AKT和mTOR的磷酸化,揭示了靈芝多糖通過抗細胞凋亡和抗自噬特性對棕櫚酸誘發(fā)的IPEC-J2細胞死亡的保護作用[44]。在高脂飲食喂養(yǎng)的小鼠組織中,從果膠蜂花粉中分離出多糖以AMPK/mTOR依賴性方式增強自噬[45]。脂多糖促進AMPK磷酸化并使mTOR失活,用脂多糖處理鼻上皮細胞(HNEpC)增加了TLR4的數(shù)量,而多黏菌素B抑制TLR4則降低了由脂多糖引起的自噬。此研究首次證明脂多糖在HNEpC中引起自噬,該過程是由AMPK-mTOR途徑介導的[46]。脂多糖處理導致LX-2細胞和肝星狀細胞(HSC)中自噬體形成和自噬通量的顯著增加,其通過AKT-mTOR和AMPK-ULK1途徑介導[47]。海藻糖抑制了H2O2誘導的人神經(jīng)母細胞瘤細胞(SH-SY5Y)內(nèi)ROS的增加以及超氧化物歧化酶活性的降低,使用抗氧化劑N-乙酰-L-半胱氨酸減輕細胞內(nèi)ROS水平并顯著減弱了H2O2誘導的AMPK激活和內(nèi)質(zhì)網(wǎng)應激。該研究表明海藻糖通過減輕ROS依賴性內(nèi)質(zhì)網(wǎng)應激和AMPK活化來預防H2O2誘導的SH-SY5Y細胞自噬性死亡[48]。
3 多糖與腫瘤細胞自噬關(guān)系
自然界中,多糖存在于幾乎所有的生物體中,包括種子組織、草本植物的莖和葉、動物的體液、細菌細胞壁、酵母和真菌的細胞外液等[49],是機體重要組成物質(zhì)。在中國等亞洲國家,中草藥具有悠久的發(fā)展歷史[50],多糖作為中草藥中的活性成分受到了廣泛的關(guān)注。目前大多數(shù)抗腫瘤藥物及放療、化療手段對機體損傷較大,多糖能減輕放療和化療藥物的毒副作用并延長腫瘤患者生存時間。多糖可能是開發(fā)抗腫瘤藥物的理想候選者[51-53],其中最具代表性的香菇多糖已被用作治療腫瘤的藥劑。自噬性細胞死亡是目前抗腫瘤研究的熱點,天然產(chǎn)物多糖能否調(diào)節(jié)細胞自噬受到了越來越多學者的關(guān)注。
近4 年來有關(guān)多糖影響腫瘤細胞自噬的相關(guān)文獻總結(jié)見表1。
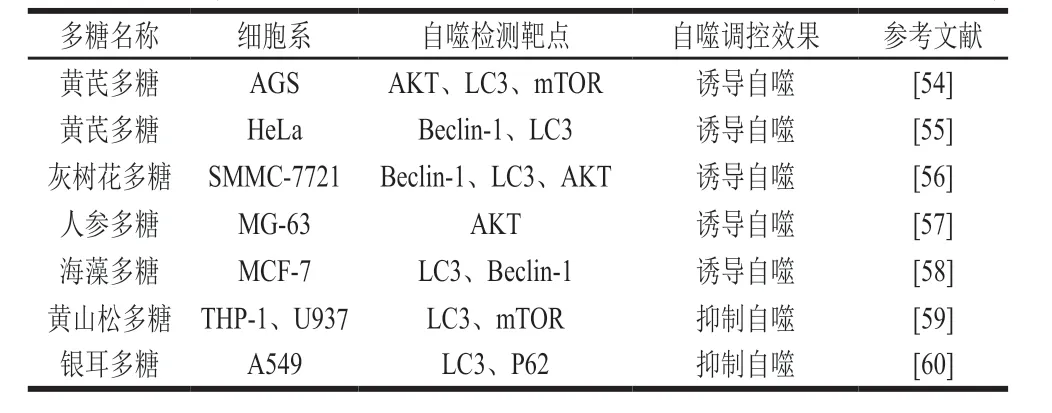
表1 多糖影響腫瘤細胞自噬的調(diào)控效果Table 1 Polysaccharides affect the regulation of tumor cell autophagy
3.1 多糖激活自噬、誘導腫瘤細胞死亡
自噬可以在多糖的不同調(diào)控作用下產(chǎn)生抗腫瘤作用。多糖可以激活腫瘤細胞自噬、抑制腫瘤細胞增殖。中藥黃芪多糖具有較強的抗腫瘤活性和抗炎作用,常被認為是抗癌藥物佐劑。Wu Jun等[54]研究表明,中藥黃芪多糖通過抑制AKT信號通路增強了抗腫瘤藥物阿帕替尼誘導胃癌AGS細胞自噬的能力,減輕其毒副作用從而起到抗腫瘤效果,該實驗還發(fā)現(xiàn)阿帕替尼和中藥黃芪多糖的組合可能是癌癥治療的潛在物質(zhì);海藻中含有營養(yǎng)豐富的海藻糖,Park等[58]研究發(fā)現(xiàn)海藻多糖激活乳腺癌MCF-7細胞中的mTOR信號傳導途徑,增強自噬。中藥黃芪多糖可通過調(diào)節(jié)細胞自噬來增加宮頸癌HeLa細胞對抗癌藥物順鉑的敏感性,實時熒光定量聚合酶鏈式反應和蛋白質(zhì)印記分析結(jié)果顯示,與對照組相比,Beclin-1、LC3的基因和蛋白表達水平均上調(diào),而p62的基因和蛋白表達水平下調(diào),說明中藥黃芪多糖激活了HeLa細胞發(fā)生自噬[55]。
除此之外,多糖還可以同時激活腫瘤細胞的凋亡和自噬,兩者共同作用抑制腫瘤細胞增殖。Zhang Xiaoyu等[57]研究表明人參多糖可以明顯誘導骨肉瘤細胞MG-63發(fā)生早期細胞自噬和凋亡,Western blot分析表明,人參多糖降低了p38和AKT的磷酸化以及Bax和Caspase3的蛋白表達。總之,GPS抑制MG-63細胞的增殖,增加凋亡和自噬性細胞死亡[57]。通過檢測自噬標記物LC3的表達也可以判斷多糖誘導腫瘤細胞發(fā)生自噬,自噬發(fā)生時,胞漿型LC3被Atg4水解并切割掉一小段多肽形成LC3-1,LC3-1和磷脂酰乙醇胺(即腦磷脂)結(jié)合轉(zhuǎn)變?yōu)樽允审w模型LC3-2,這兩種形式存在于正常細胞中,但發(fā)生自噬的細胞中LC3-2明顯增加,檢測LC3-2/LC3-1的值即可判斷自噬水平高低。如VC與灰樹花多糖聯(lián)合誘導人肝癌細胞(SMMC-7721)凋亡及自噬,檢測到LC3表達水平上調(diào),自噬被激活[56]。
3.2 多糖抑制自噬、誘導腫瘤細胞死亡
腫瘤細胞的自噬是一把“雙刃劍”,在饑餓條件下,腫瘤細胞為了存活,一部分腫瘤細胞發(fā)生自噬并為其他腫瘤細胞快速分化生長提供所需的營養(yǎng)物質(zhì),自噬能使腫瘤細胞繼續(xù)存活及生長,是腫瘤細胞的一種自我保護機制。而抑制自噬,是使其不能為快速分化的腫瘤細胞提供營養(yǎng)物質(zhì),降低腫瘤細胞的生長速率。有研究表明,多糖既可以直接抑制自噬,進而抑制腫瘤細胞增殖;又可以抑制腫瘤細胞自噬進而引發(fā)細胞凋亡,兩者共同作用抑制腫瘤細胞增殖。
Chao等[59]研究表明,黃山樺的水溶性多糖(Inonotus taiwanensispolysaccharid,WSPIS)以劑量和時間依賴性的方式降低LC3的表達,說明WSPIS能夠抑制自噬。為研究自噬在WSPIS誘導的細胞凋亡和細胞死亡中的作用,使用自噬誘導劑mTOR激活自噬,自噬的上調(diào)降低了WSPIS誘導的細胞凋亡和細胞死亡,發(fā)現(xiàn)WSPIS抑制THP-1細胞中的自噬從而起到了抗腫瘤的作用[59]。Shi Xiaolan等[60]研究了銀耳多糖在人上皮肺癌細胞(A549)中由銅綠假單胞菌脂多糖誘導的細胞凋亡和自噬的作用,加入銀耳多糖后,抑制了脂多糖誘導的自噬,加快腫瘤細胞死亡,該研究對肺損傷相關(guān)銅綠假單胞菌感染的治療具有重要意義。昆布多糖修飾的硒納米粒子誘導早期自噬的激活,但阻止了自噬晚期的激活,自噬晚期的抑制作用導致受損的細胞器無法清除并加重HepG2細胞凋亡[61]。
4 結(jié) 語
自噬使細胞在饑餓和受到打擊情況下維持細胞穩(wěn)態(tài)。適度自噬是一種保護機制,過度自噬則會造成細胞死亡。以調(diào)節(jié)自噬活性為目的的治療已經(jīng)成為腫瘤治療的熱門[62]。在研究腫瘤細胞自噬過程中發(fā)現(xiàn),通過自噬抑制腫瘤可以分為兩種途徑:1)直接上調(diào)自噬相關(guān)基因表達,增加腫瘤細胞自噬量,達到抑制腫瘤細胞增長的目的;2)抑制自噬,阻斷細胞獲取能量,進而誘導細胞凋亡來抑制腫瘤細胞生長。天然產(chǎn)物多糖抑制腫瘤細胞自噬的途徑也分為兩種,與以上研究結(jié)果相似。低毒高產(chǎn)的多糖是否可以成為抗腫瘤藥物的輔助品、降低化學藥品帶來的副作用,成為了目前眾多學者研究的重點。從相關(guān)報道中發(fā)現(xiàn),多糖相關(guān)的自噬研究靶點主要集中在PI3K/AKT/mTOR、MAPK、AMPK等信號通路。而自噬性質(zhì)判定,即保護機體引發(fā)的自噬和致死性自噬的鑒別則較為鮮見。多糖能否與腫瘤細胞表面某一特定受體結(jié)合,影響PI3K/AKT/mTOR、MAPK、AMPK上游的某一蛋白,從而激活自噬相關(guān)通路表達有待進一步探討。因此,多糖對腫瘤細胞自噬的調(diào)控作用有待更深入的研究。

