抑制lncRNA LUCAT1表達通過靶向調控miR-204-3p減輕高糖誘導的心肌H9c2細胞損傷*
陳婉斐, 泮慧俐, 李珍珍, 盧慧琴
(1臺州市中心醫院心血管內科,浙江臺州318000;2臺州市第一人民醫院新生兒科,浙江臺州318020)
糖尿病心肌病是由糖尿病引起的可導致心力衰竭的一種病理狀態[1],其發病機制與心肌細胞凋亡和氧化應激損傷密切相關[2-4]。長鏈非編碼RNA(long noncoding RNA,lncRNA)是一類長度超過200 nt 的非編碼 RNA,微小 RNA(microRNA,miRNA,miR)是一類長度在22 nt 左右的內源性單鏈非編碼RNA,兩者均不參與編碼蛋白質但參與基因的調控,且可相互作用,在細胞增殖、凋亡、氧化應激等過程中發揮著重要作用,其表達和功能異常與包括糖尿病心肌病在內的多種疾病的發生發展密切相關[5-7]。近年來,有學者指出,lncRNA 肺癌相關轉錄本1(lung cancer-associated transcript 1,LUCAT1)高表達與糖尿病心肌病的發病機制有關,抑制其表達對高糖(high glucose,HG)誘導的心肌細胞損傷具有抑制作用[8],但具體的作用機制并不完全清楚。miR-204-3p在lncRNA AK139328介導的心肌細胞凋亡和氧化應激損傷過程中發揮著重要的抑制作用[9]。本研究采用生物信息學軟件預測發現LUCAT1 與miR-204-3p 之間存在互補的結合位點,推測抑制LUCAT1 表達可能通過靶向調控miR-204-3p抑制心肌細胞凋亡和氧化應激,進而發揮心肌保護作用。因此本研究開展體外細胞實驗加以驗證,旨在進一步揭示敲減LUCAT1 表達減輕HG 誘導的心肌細胞損傷的分子機制,為LUCAT1 成為糖尿病心肌病治療的靶點提供新線索。
材料和方法
1 主要材料
大鼠心肌H9c2 細胞株購于中科院上海生命科學研究所。DEME 培養基購于HyClone;胎牛血清購于杭州四季青公司;Trizol試劑和Lipofectamine 2000購于Invitrogen;丙二醛(malondialdehyde,MDA)含量檢測試劑、超氧化物歧化酶(superoxide dismutase,SOD)活性檢測試劑、谷胱甘肽過氧化酶(glutathione peroxidase,GSH-Px)活性檢測試劑盒和乳酸脫氫酶(lactate dehydrogenase,LDH)試劑盒購于南京建成生物公司;RIPA 裂解液、CCK-8 試劑盒、螢光素酶報告基因檢測試劑盒和BCA蛋白檢測試劑盒購于上海碧云天生物技術公司;SDS-PAGE 凝膠制備試劑盒購于北京索萊寶科技有限公司;抗Bax、Bax 和GAPDH抗體購于Cell Signaling Technology;辣根過氧化物酶標記的II 抗購于北京中杉金橋生物公司;miR-204-3p mimics、miR-204-3p inhibitor 及相應的陰性對照mimics-NC 和inhibitor-NC 購于上海吉瑪基因公司;靶向LUCAT1 的干擾序列siRNA-LUCAT1 及其陰性對照siRNA-NC購于廣州銳博生物公司;PCR引物購于上海生工生物工程有限公司。凝膠成像系統購于Bio-Rad;流式細胞儀購于Beckman Coulter;熒光定量PCR 儀購于Applied Biosystems;多功能酶標儀購于Tecan;超微量分光光度計購于Implen;CO2培養箱購于Thermo。
2 方法
2.1 細胞培養、分組與轉染 將解凍復蘇后的H9c2 細胞以含 5.5 mmol/L D-葡萄糖的 DMEM 培養基(內含10%胎牛血清)在5% CO2、37℃細胞培養箱中常規培養。實驗分為:(1)對照(control)組:正常培養72 h;(2)HG 組:以含25.5 mmol/L D-葡萄糖的高糖 DMEM 培養基培養 72 h;(3)HG+siRNA-NC組:轉染siRNA-NC 48 h后用高糖DMEM 培養基培養24 h;(4)HG+siRNA-LUCAT1 組:轉染 siRNA-LUCAT1 48 h后用高糖培養基培養24 h;(5)HG+siRNALUCAT1+inhibitor-NC 組:共轉染 siRNA-LUCAT1 和inhibitor-NC 48 h 后用高糖培養基培養 24 h;(6)HG+siRNA-LUCAT1+miR-204-3p inhibitor 組:共轉染siRNA-LUCAT1和inhibitor-NC 48 h 后用高糖培養基培養24 h。每組設置3 個復孔。將生長良好的對數生長期H9c2 細胞按照每孔5×105個接種至6 孔細胞板,置于細胞培養箱中常規培養;待細胞融合度達70%左右時,按照上述分組根據Lipofectamine 2000說明書分別將siRNA-LUCAT1、siRNA-NC、miR-204-3p inhibitor和inhibitor-NC 轉染 H9c2 細胞。轉染 5 h后更換新鮮培養基繼續培養。培養48 h 后,根據實驗分組以高糖培養基繼續培養24 h。
2.2 雙螢光素酶報告基因實驗檢測LUCAT1 和miR-204-3p 的靶向結合關系 采用生物學信息學軟件對LUCAT1 的靶基因進行預測,發現miR-204-3p與LUCAT1 存在互補的結合位點,將該片段克隆重組至螢光素酶報告載體上,構建LUCAT1 野生型載體質粒,標記為LUCAT1-WT;同時,將miR-204-3p 與LUCAT1結合位點定點突變后,克隆重組至螢光素酶報告載體上,構建LUCAT1 突變型載體質粒,標記為LUCAT1-MUT。參照Lipofectamine 2000 說明書將LUCAT1-WT、LUCAT1-MUT 質粒分別與 miR-204-3p mimics、mimics-NC 共轉染至 H9c2 細胞中,其中每個處理設置3 個平行孔;轉染48 h 后,收集各組細胞并參照螢光素酶活性檢測試劑盒說明書步驟檢測各組細胞的螢光素酶活性。實驗重復3次。
2.3 RT-qPCR檢測LUCAT1和miR-204-3p的表達Trizol 法提取H9c2 細胞的總RNA 后,采用微量分光光度計檢測RNA 的濃度、純度及完整性。將高質量的RNA 參照逆轉錄試劑盒說明書步驟合成cDNA;將cDNA 作為模板,按照熒光定量PCR 檢測試劑盒說明書上PCR 儀進行擴增。反應條件如下:94℃預變性3 min;94℃變性10 s,60℃退火30 s,72℃延伸30 s,38 個循環;循環結束后,72℃再延伸5 min。所用到的PCR 引物序列如下:LUCAT1 的上游引物序列為5'-GCTCGGATTGCCTTAGACAG-3',下游引物序列為5'-GGGTGAGCTTCTTGTGAGGA-3';GAPDH的上游引物序列為5'-TGACTTCAACAGCGACACCCA-3',下游引物序列為5'-CACCCTGTTGCTGTAGCCAAA-3';miR-204-3p 的上游引物序列為5'-ACACTCCAGCTGGGGCTGGGAAGGCAAAGGG-3',下游引物序列為5'-CTCAACTGGTGTCG-TGGA-3';U6 的上游引物序列為5'-CTCACTTCGGCAGCACATA-3',下游引物序列為5'-AACTCTTCACGATTTTGTCTGTC-3'。
2.4 CCK-8 法檢測細胞的活力 將對數生長期的H9c2 細胞按照每孔 1×105個接種至 96 孔細胞板,置于細胞培養箱中培養過夜;將其按照2.1 中的分組與處理,并將無細胞的培養基作為空白調零孔;處理72 h 后,每孔加入 CCK-8 工作液 100 μL;孵育 4 h 后,采用多功能酶標儀檢測H9c2 細胞在490 nm 波長處的A值,并計算出各組細胞的相對活力。細胞相對活力(%)=(實驗組A值-調零組A值)/(對照組A值-調零組A值)×100%。實驗重復3次。
2.5 LDH 試劑盒檢測LDH 漏出量 按照2.1 中的分組處理H9c2 細胞72 h 后,收集各組細胞上清液,參照LDH試劑盒說明書步驟檢測各組細胞上清液中LDH活性。實驗重復3次。
2.6 流式細胞術檢測細胞凋亡 按照2.1 中的分組處理H9c2 細胞72 h 后,收集各組細胞,以預冷的磷酸鹽緩沖液洗滌 2 次后,加入 1× binding buffer 制成濃度為1×109/L的細胞懸液;取細胞懸液100 μL于樣品管中,加入5 μL annexin V-FITC 和5 μL PI;混勻后,室溫避光放置15 min;補加1× binding buffer 400 μL后,1 h內上流式細胞儀檢測各組細胞凋亡率。實驗重復3次。
2.7 Western blot 檢測細胞中 Bcl-2和Bax 蛋白的表達 向H9c2 細胞中加入RIPA 裂解液抽提細胞總蛋白后,參照BCA 蛋白檢測試劑盒說明書檢測蛋白的濃度與純度;將蛋白樣品按照1∶1 比例與上樣緩沖液混勻后,以每孔50 μg 上樣至SDS-PAGE 凝膠孔中行電泳分離;電泳結束后,轉至PVDF 膜上。采用含5%脫脂奶粉的封閉液封閉2 h 后,加入按照1∶1 000比例稀釋的抗Bcl-2、Bax 和GAPDH 抗體;4℃孵育過夜后,加入按照1∶2 000稀釋的辣根過氧化物酶標記的II 抗;室溫孵育2 h 后,滴加化學發光劑;暗室內顯影曝光后,以GAPDH 為內參,采用凝膠成像系統掃描分析H9c2 細胞中Bcl-2 和Bax 蛋白的表達水平。實驗重復3次。
2.8 比色法檢測SOD和GSH-Px活性及MDA含量按照2.1 中的分組處理H9c2 細胞后收集細胞,反復凍融破碎細胞后,1 000 r/min 離心10 min;取200 μL上清液后,參照SOD 和GSH-Px 活性及MDA 含量檢測試劑盒說明書步驟檢測各處理組中SOD 和GSHPx活性及MDA含量。實驗重復3次。
3 統計學處理
采用SPSS 22.0 軟件進行統計學分析。實驗結果取3 次實驗的均值,結果以均數±標準差(mean±SD)表示,兩組間比較采用獨立樣本t檢驗,多組間比較采用方差分析和SNK-q檢驗,以P<0.05 為差異有統計學意義。
結 果
1 LUCAT1和miR-204-3p的靶向結合關系
LncBase Predicted v.2 軟件預測到 LUCAT1 和miR-204-3p 之間存在互補的結合位點,見圖1A。采用雙螢光素酶報告基因實驗進一步檢測LUCAT1 和miR-204-3p 的靶向結合關系,結果顯示,與陰性對照mimics-NC 組比較,miR-204-3p mimics 與 LUCAT1-WT 質粒共轉染后H9c2 細胞的螢光素酶活性明顯降低(P<0.05),但miR-204-3p mimics 與LUCAT1-MUT質粒共轉染后H9c2 細胞的熒光素酶活性差異無統計學顯著性(P>0.05),見圖1B。
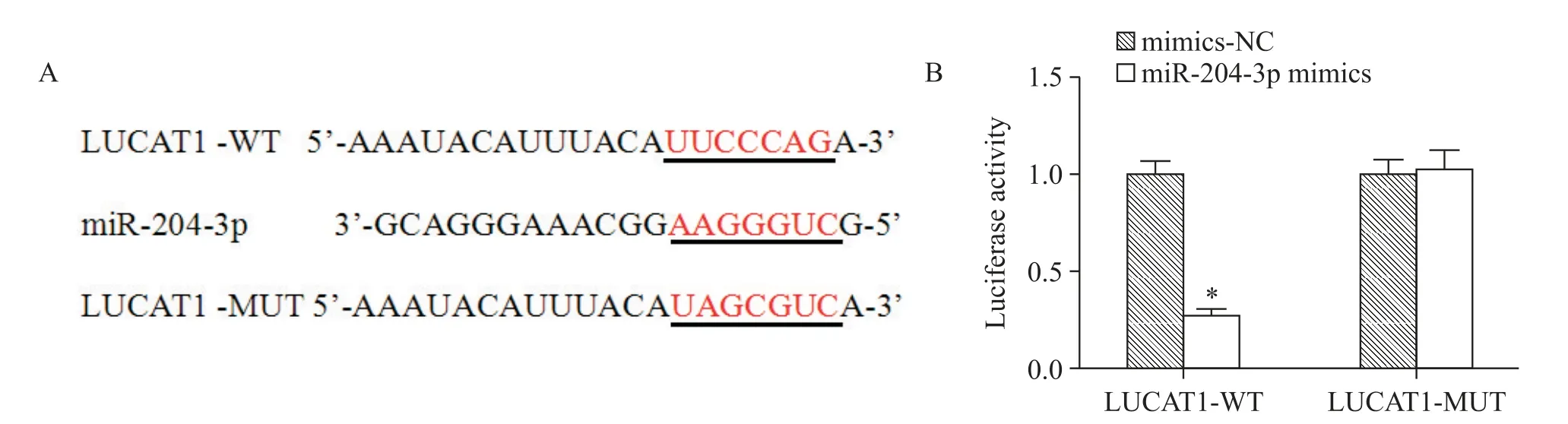
Figure 1.The complementary binding sites between LUCAT1 and miR-204-3p(A)and the changes of luciferase activity(B).Mean±SD. n=3.*P<0.05 vs mimics-NC group.圖1 LUCAT1和miR-204-3p之間存在互補的結合位點及螢光素酶報告基因實驗的驗證
2 轉染后各組心肌細胞中LUCAT1 和miR-204-3p表達水平的變化
與對照組比較,給予HG 刺激后H9c2 細胞中LUCAT1 的表達水平明顯升高,而miR-204-3p 的表達水平明顯降低(P<0.05);與 HG 組比較,轉染siRNA-NC 后 H9c2 細 胞中 LUCAT1和miR-204-3p 的表達水平差異均無統計學顯著性(P>0.05),但轉染siRNA-LUCAT1 后 H9c2 細胞中 LUCAT1 的表達水平明顯降低,miR-204-3p 的表達水平明顯升高(P<0.05);與HG+siRNA-LUCAT1 組比較,轉染inhibitor-NC 對H9c2 細胞中miR-204-3p 的表達水平無明顯影響(P>0.05),但轉染 miR-204-3p inhibitor 后H9c2 細胞中 miR-204-3p 的表達水平明顯降低(P<0.05),見圖2。
3 LUCAT1 低表達靶向調控 miR-204-3p 對 HG 環境下心肌細胞活力和LDH漏出量的影響
與對照組比較,HG 組H9c2 細胞的活力明顯降低,而 LDH 漏出量明顯升高(P<0.05);與 HG 組比較,轉染siRNA-NC 后H9c2 細胞的活力和LDH 漏出量均無顯著改變(P>0.05),但轉染siRNA-LUCAT1后H9c2細胞的活力明顯升高,而LDH 漏出量明顯降低(P<0.05);與HG+siRNA-LUCAT1組比較,轉染inhibitor-NC 對H9c2 細胞的活力和LDH 漏出量無明顯影響(P>0.05),但轉染miR-204-3p inhibitor 后H9c2細胞的活力明顯降低,而LDH 漏出量明顯升高(P<0.05),見圖3。
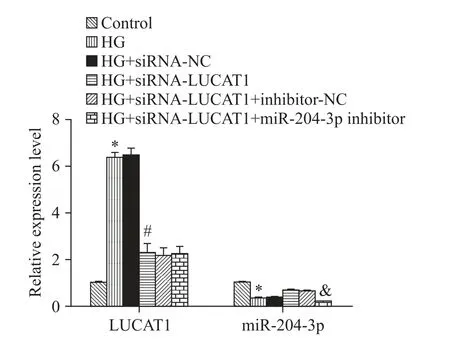
Figure 2.Comparison of expression levels of LUCAT1 and miR-204-3p in H9c2 cells of each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs HG group;&P<0.05 vs HG+siRNA-LUCAT1 group.圖2 各組H9c2 細胞中LUCAT1 和miR-204-3p 表達水平的比較
4 LUCAT1 低表達靶向調控 miR-204-3p 對 HG 環境下心肌細胞凋亡的影響
與對照組比較,HG組H9c2細胞的凋亡率明顯升高(P<0.05);與HG 組比較,轉染siRNA-NC 對H9c2細胞的凋亡無明顯影響(P>0.05),但轉染siRNALUCAT1 可明顯抑制 HG 誘導的 H9c2 細胞凋亡(P<0.05);與HG+siRNA-LUCAT1 組比較,轉染inhibitor-NC 對H9c2 細胞的凋亡無顯著影響(P>0.05),但轉染miR-204-3p inhibitor后siRNA-LUCAT1對HG 環境下H9c2 細胞凋亡的抑制作用明顯減弱(P<0.05), 見圖4。
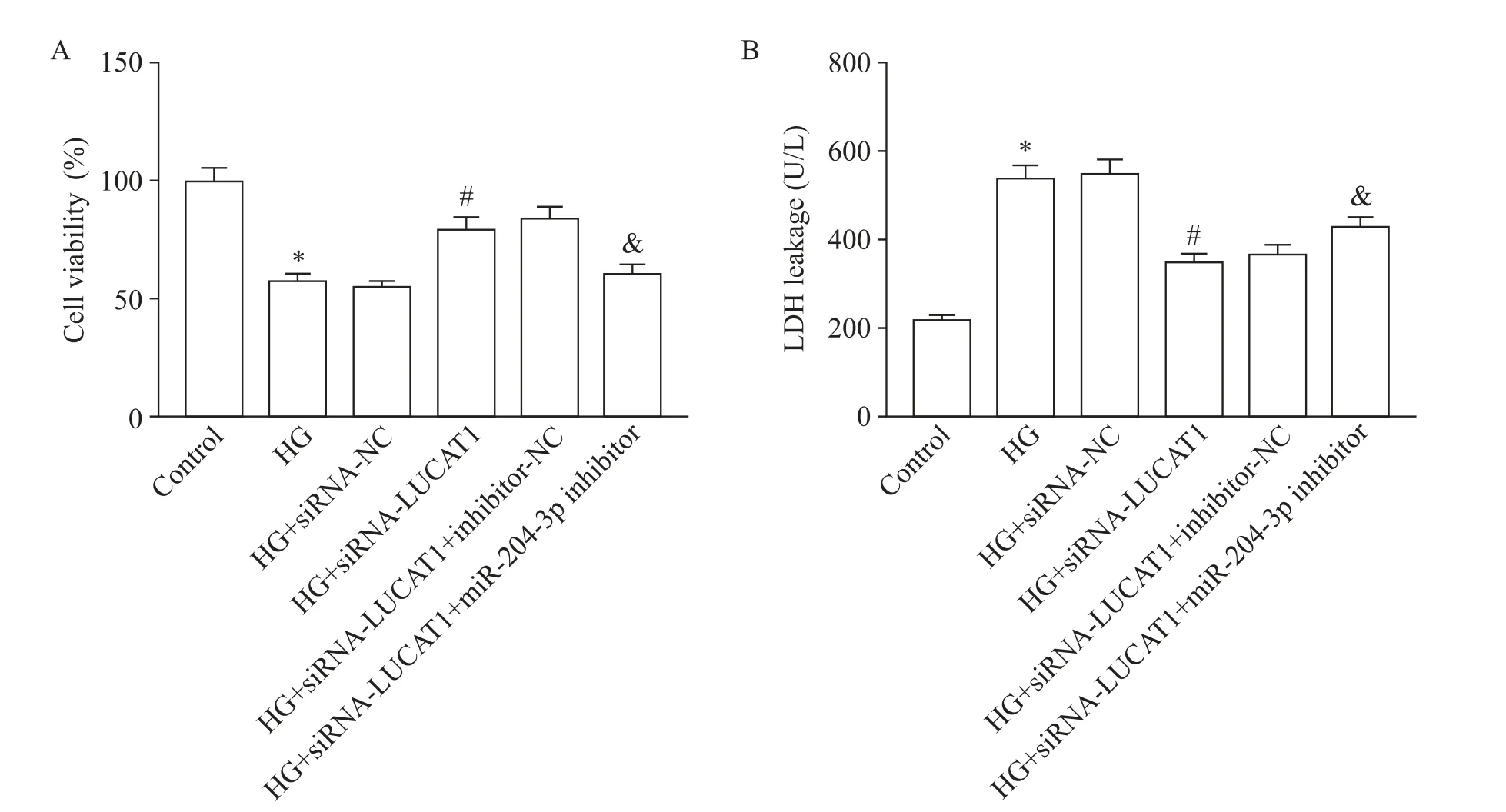
Figure 3.Comparison of the viability(A)and LDH leakage(B)in the H9c2 cells.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs HG group;&P<0.05 vs HG+siRNA-LUCAT1 group.圖3 各組H9c2細胞活力和LDH漏出量的比較
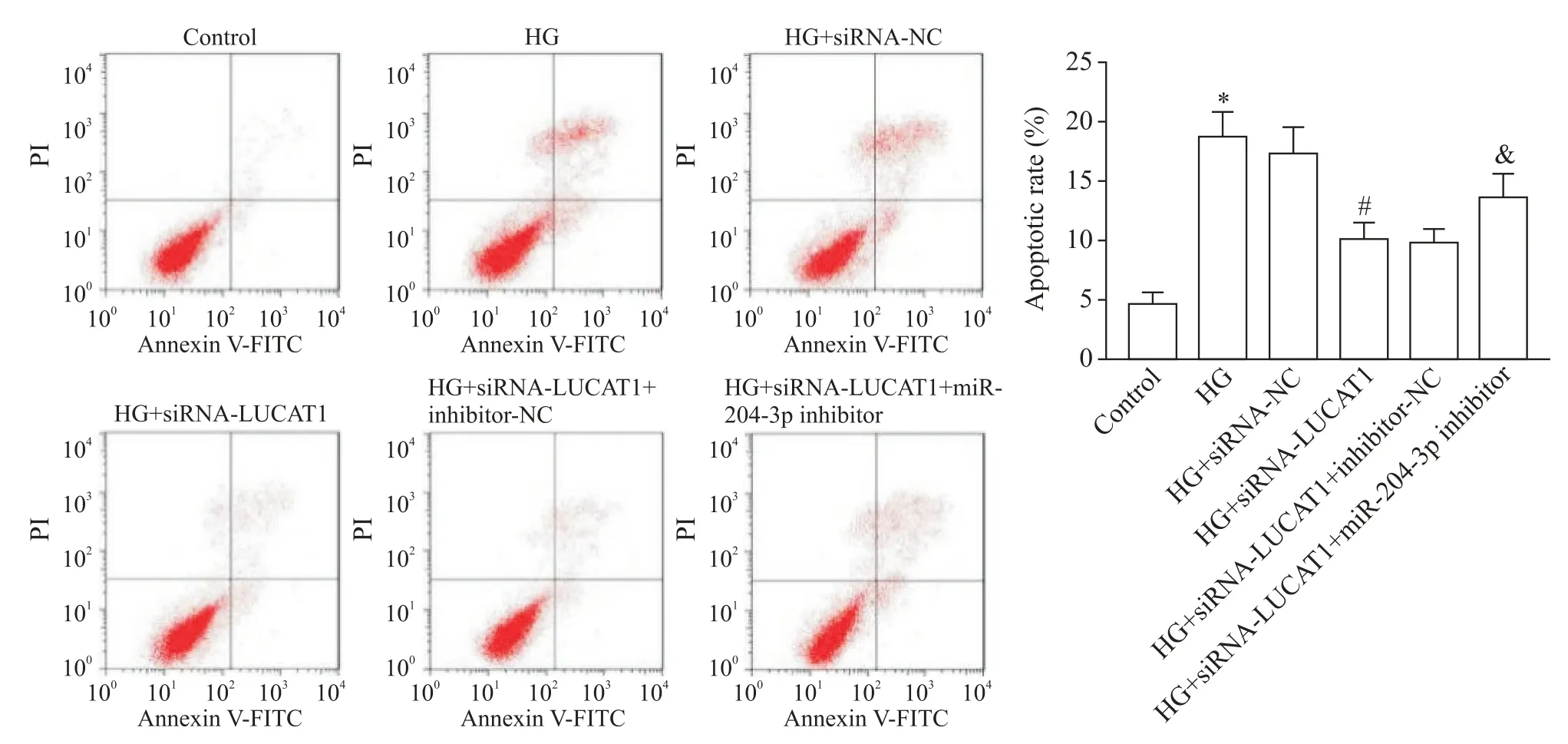
Figure 4.The apoptosis of the H9c2 cells in each group detected by flow cytometry.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs HG group;&P<0.05 vs HG+siRNA-LUCAT1 group.圖4 流式細胞術檢測各組H9c2細胞凋亡的變化
5 LUCAT1 低表達靶向調控 miR-204-3p 對 HG 環境下心肌細胞中Bcl-2和Bax蛋白表達的影響
與對照組比較,HG 組H9c2細胞中Bcl-2的蛋白表達水平明顯降低,而Bax 的蛋白表達水平明顯升高(P<0.05);與HG 組比較,轉染siRNA-NC 對H9c2細胞中Bcl-2 和Bax 的蛋白表達水平無明顯影響(P>0.05),但轉染 siRNA-LUCAT1 可明顯上調 HG 環境下H9c2 細胞中Bcl-2 的蛋白表達并下調Bax 的蛋白表達(P<0.05);與HG+siRNA-LUCAT1 組比較,轉染inhibitor-NC 對 H9c2 細胞中 Bcl-2和Bax 的蛋白表達水平無明顯影響(P>0.05),但轉染miR-204-3p inhibitor 可明顯逆轉 siRNA-LUCAT1 對 Bcl-2 蛋白表達的促進及對Bax 蛋白表達的抑制作用(P<0.05),見圖5。
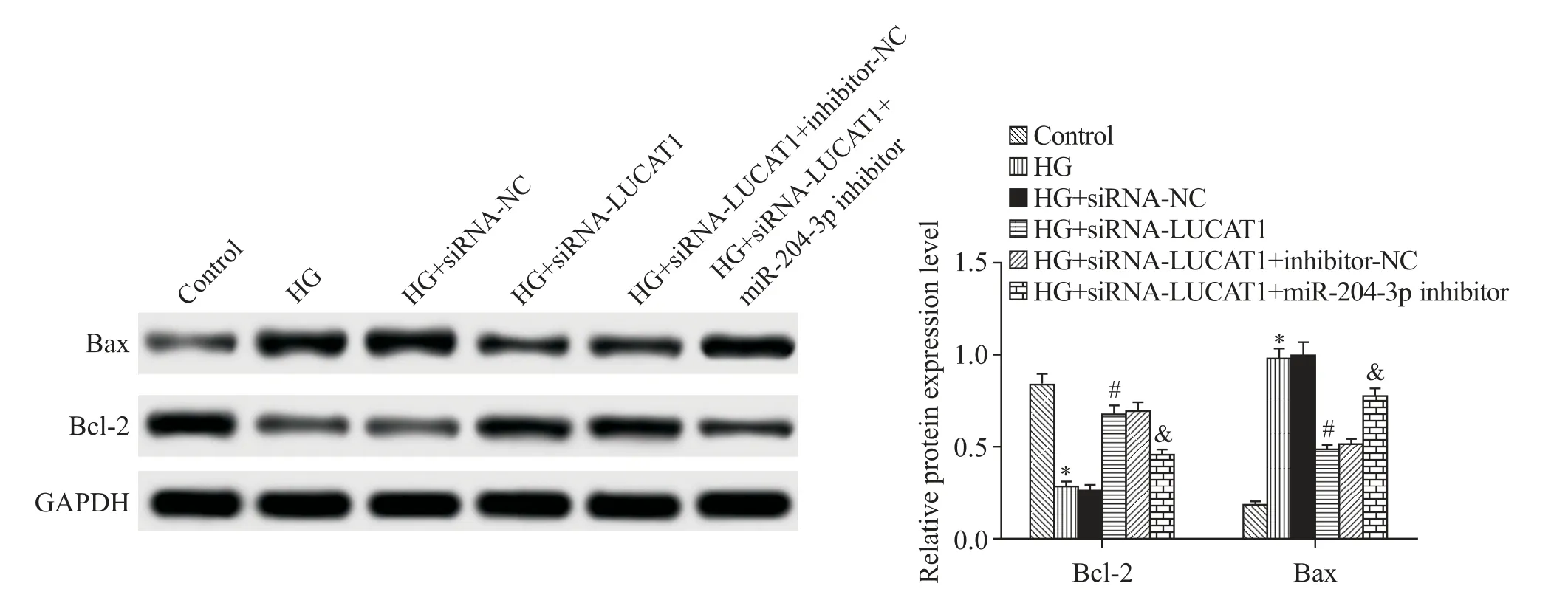
Figure 5.The protein expression of Bcl-2 and Bax in the H9c2 cells of each group determined by Western blot.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs HG group;&P<0.05 vs HG+siRNA-LUCAT1 group.圖5 Western blot檢測各組H9c2細胞中Bcl-2和Bax蛋白表達
6 LUCAT1 低表達靶向調控miR-204-3p 對心肌細胞SOD和GSH-Px活性及MDA含量的影響
與對照組比較,HG 組H9c2細胞的SOD 和GSHPx 活性均明顯降低,而MDA 含量明顯升高(P<0.05);與 HG 組比較,轉染 siRNA-LUCAT1 可明顯逆轉 HG 引起的 H9c2 細胞 SOD和GSH-Px 活性及 MDA含量的變化(P<0.05),但轉染siRNA-NC 對HG 環境下 H9c2 細胞的 SOD和GSH-Px 活性及 MDA 含量無顯著影響(P>0.05);與HG+siRNA-LUCAT1 組比較,轉染 inhibitor-NC 對 HG 環境下 H9c2 細胞的 SOD 和GSH-Px活性及MDA含量無顯著影響(P>0.05),但轉染miR-204-3p inhibitor 可明顯逆轉siRNA-LUCAT1對 HG 環境下 H9c2 細胞 SOD和GSH-Px 活性及 MDA含量的作用(P<0.05),見圖6。
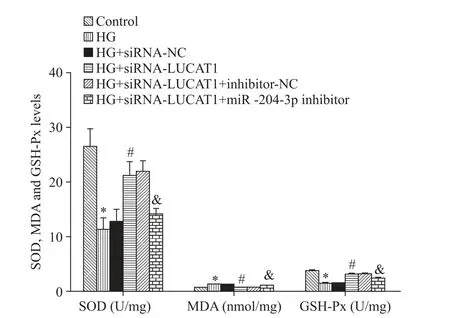
Figure 6.The activity of SOD and GSH-Px and the content of MDA in the H9c2 cells of each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs HG group;&P<0.05 vs HG+siRNA-LUCAT1 group.圖6 各組H9c2細胞SOD和GSH-Px活性及MDA含量的比較
討 論
糖尿病是一種快速增長的流行疾病,而糖尿病心肌病是其最主要的并發癥之一,對糖尿病患者的生命健康和生活質量帶來很大的威脅[10]。血糖升高與糖尿病心肌病的發生發展密切相關,高血糖可誘導心肌細胞凋亡和氧化應激損傷,改變心肌結構與功能,進而加重糖尿病心肌病的發生發展[11-12]。本研究以含25.5 mmol/L D-葡萄糖[13]的高糖培養液培養大鼠心肌細胞后發現,心肌細胞活力、SOD 活性、GSH-Px 活性和抑凋亡蛋白Bcl-2 表達水平均明顯降低,而細胞膜損傷指標LDH 釋放量、細胞凋亡率、促凋亡蛋白Bax表達水平和氧化應激指標MDA 含量均明顯升高,即HG 可引起心肌細胞凋亡,促進氧化應激反應的發生,降低細胞活力。這表明HG誘導的大鼠心肌細胞損傷模型構建成功。在糖尿病心肌病患者中存在著異常表達的lncRNAs,而這些lncRNAs 可能通過調控HG 誘導的心肌細胞凋亡和氧化應激反應介導心肌細胞損傷,參與糖尿病心肌病的發生發展[5,14-15]。作為 lncRNAs 家族成員,LUCAT1(又名SCAL1)定位于人5 號染色體上,由香煙煙霧抽提物誘導產生,在肺癌、胃癌、肝癌等腫瘤中異常高表達,且可通過調控細胞增殖和遷移等發揮著重要的調控作用[16]。此外,LUCAT1 異 常活化可通過下調DNMT1 表達參與 PM2.5誘導的細胞凋亡[17]。近年來有研究發現,糖尿病心肌病的發展機制與LUCAT1有關,敲減LUCAT1 的表達能減輕HG 誘導的心肌細胞損傷[8],但具體的保護機制并不完全清楚。
miRNAs 是一類廣泛存在于生物體內的內源性非編碼RNA,其異常表達可通過調控細胞增殖、凋亡和氧化應激反應等參與包括糖尿病心肌病在內的多種疾病的發生發展[18-20]。lncRNAs 常被作為 miRNA的海綿吸附因子,可通過競爭性結合miRNA 在轉錄后水平調控miRNA 的表達而發揮功能[21]。本研究采用生物信息學軟件對LUCAT1 的靶基因進行預測,發現miR-204-3p 與LUCAT1 之間存在潛在相互作用。研究顯示,miR-204-3p 異常表達可調控細胞凋亡和氧化應激反應與白內障等疾病的發病有關[22]。過表達 miR-204-3p 通過靶向緩激肽 B2 受體在HG 誘導的足細胞凋亡和功能障礙中發揮保護作用[23]。此外,在糖尿病心肌缺血再灌注損傷心肌細胞和組織中miR-204-3p 表達下調,抑制lncRNA AK139328 通過上調miR-204-3p 減輕心肌細胞缺血再灌注損傷[9]。本研究結果顯示,HG 刺激后心肌細胞中LUCAT1 表達上調,而miR-204-3p 表達下調;采用雙螢光素酶報告基因實驗證實,LUCAT1 可與miR-204-3p 靶向結合降低心肌細胞的螢光素酶活性;此外,成功下調LUCAT1 表達可明顯抑制HG 誘導的心肌細胞凋亡和Bax 蛋白表達,降低LDH 釋放量和MDA 含量,并上調心肌細胞中miR-204-3p 表達和Bcl-2 蛋白表達,提高心肌細胞活力及SOD 和GSH-Px 活性;而成功下調miR-204-3p 表達后,LUCAT1 低表達對HG 誘導的心肌細胞凋亡和氧化應激反應的抑制作用明顯逆轉。本研究結果表明,敲減LUCAT1 的表達可通過靶向上調miR-204-3p 抑制HG誘導的心肌細胞凋亡和氧化應激反應,從而減輕心肌細胞損傷。下一步我們將研究miR-204-3p是否特異影響凋亡和氧化應激相關蛋白的表達進而影響HG誘導的心肌細胞損傷。
綜上所述,敲減LUCAT1 的表達可通過靶向調控miR-204-3p 表達抑制心肌細胞凋亡和氧化應激,從而減輕HG 誘導的心肌細胞損傷。這為在糖尿病心肌病中調控LUCAT1 的表達水平以保護心肌細胞提供了新的參考依據。

