雙氫青蒿素對人胃癌細胞BGC-823細胞增殖、凋亡的影響及機制研究
徐彥楠,孟 麗,朱 艷,閆 靜,王彥玲,周晨明*
(1.河北醫科大學教學實驗中心,河北 石家莊 050017;2.河北醫科大學電鏡實驗中心,河北 石家莊 050017;3.河北醫科大學細胞生物教研室,河北 石家莊 050017)
胃癌是世界上常見的消化道惡性腫瘤之一,對人類的健康造成巨大威脅。其發病率和病死率分別位于世界惡性腫瘤第4位和第2位[1]。目前,在臨床上主要通過手術切除病灶來治療癌癥改善病情。但是臨床癥狀對于胃癌早期患者來說并不明顯,以至于就診率很低。并且目前在診療過程中缺乏診斷胃癌的生物學指標,導致眾多出現臨床癥狀的患者在確診時已是伴有轉移的中晚期胃癌[2]。最佳手術治療時期已經錯過,非手術治療是唯一緩解病情的方式。目前,放療與化療已被廣泛應用于中晚期腫瘤的非手術治療中,但在治療過程中容易出現不良反應,甚至出現器官衰竭。因此,尋找高效低毒的天然藥物至關重要。青蒿素是1971年我國科學家在中草藥青蒿中分離出的環狀倍半萜類化合物,是一種低毒、高效治療瘧疾的天然藥物。青蒿素難溶于水,使其療效不能充分的發揮,因此合成了抗瘧效果強于青蒿素且低毒、安全的青蒿素衍生物——雙氫青蒿素(dihydroartemisinin,DHA)。有研究表明,DHA對宮頸癌、胰腺癌、肺癌、肝癌、淋巴癌和前列腺癌等腫瘤細胞的生長有明顯地抑制作用[3-8],但是否能抑制人胃癌細胞BGC-823細胞及其作用機制的研究尚未報道。因此,本研究旨在探討DHA抑制人胃癌細胞BGC-823細胞增殖并促凋亡的作用及作用機制,以期為中藥抗腫瘤藥物的開發提供依據。
1 材 料 與 方 法
1.1實驗材料 人胃癌細胞系BGC-823細胞;DHA購自美國Sigma公司;RPMI1640培養基購自美國Gibco公司;噻唑藍(methylthiazoletetrazolium,MTT)購自美國Pharma Minger公司;兔抗人Bax、Caspase-3、Caspase-8單克隆抗體購自美國Santa Cruz公司;羊抗兔二抗購自康為世紀生物試劑公司;倒置顯微鏡購自日本奧林巴斯公司;倒置熒光顯微鏡購自日本奧林巴斯公司;二氧化碳培養箱購自美國Formascientific公司;酶標儀購自美國Bio-Rad公司;電泳儀購自比利時Consort公司;超薄切片機UC7購自德國徠卡公司;流式細胞儀購自美國BD公司;透射電子顯微鏡H-7500購自日本日立公司。
1.2方法
1.2.1細胞培養 BGC-823細胞在含有10%胎牛血清的RPMI1640培養基中培養,置于CO2培養箱中,每周傳代2~3次,維持細胞處于對數生長期。
1.2.2MTT法檢測DHA對BGC-823細胞的抑制率 取對數生長的BGC-823細胞,棄培養基,用PBS進行清洗,加入0.25%胰酶進行消化,用培養基調成單細胞懸液,接種到96孔板上,置于培養箱中培養過夜,待貼壁后根據分組加入不同濃度的DHA[0(對照組),0.67,1.34,2.68,5.36,10.72 μmol/L]生長24,48,72 h。定時觀察細胞生長情況,每孔加入5 g/L MTT 溶液20 μL/孔,孵育4 h后,棄上清加入150 μL/孔 二甲基亞砜。利用酶標儀以波長490 nm測各孔吸光值(absorbance,A),根據下列公式計算DHA對BGC-823細胞的抑制率:抑制率(%)=(1-實驗組A/對照組A)×100%,并將上述計算結果用82798-IC50軟件計算出DHA作用的半數抑制濃度(half maximal inhibitory concentration,IC50)。
1.2.3流式細胞術(flow cytometry,FCM)檢測凋亡率 實驗分組為對照組、1.7 μmol/L組、3.4 μmol/L組、6.8 μmol/L組。在細胞培養瓶中以1×105個/mL的濃度接種5 mL BGC-823細胞,24 h后在對照組加入3 mL培養基,實驗組中分別加入3 mL終濃度為1.7、3.4、6.8 μmol/L DHA,之后繼續在CO2培養箱中培養48 h,終止培養并收集細胞。細胞經0.04%乙二胺四乙酸消化,離心,收集細胞。用預冷PBS重懸,離心、清洗兩次,用體積分數為70%乙醇吹打制成單細胞懸液。上機檢測前棄乙醇,用PBS清洗重懸,取單細胞懸液0.1 mL,加入1 mL碘化丙啶染液,將其置于4 ℃冰箱避光繼續孵育30 min,以500目銅網過濾,用流式細胞儀進行分析檢測凋亡率。
1.2.4DHA對BGC-823細胞凋亡的形態學影響 分組同FCM,每組均做3個復孔,給藥方式同FCM,繼續培養48 h后離心,棄上清,PBS洗滌,用4%多聚甲醛固定30 min,PBS洗滌,DAPI避光孵育3 min,PBS清洗后置于熒光顯微鏡下觀察、拍照。收集細胞,離心成團,棄上清,加入2.5%戊二醛進行前固定、1%四氧化鋨后固定1.5 h、經50%、70%、80%、90%、100%丙酮梯度脫水、Epon812樹脂包埋、超薄切片機切50 nm超薄切片、醋酸雙氧鈾及檸檬酸鉛染色各30 min,在透射電子顯微鏡下檢測、拍照。
1.2.5Western blotting檢測相關蛋白表達 細胞分組及處理同FCM,繼續孵育48 h后,經預冷的PBS洗滌,用裂解液裂解60 min,測定蛋白質濃度。之后進行蛋白電泳和轉膜,再進行免疫反應:將膜用5%脫脂奶粉37 ℃封閉2 h,加入兔抗人Bax、Caspase-3、Caspase-8孵育,4 ℃冰箱過夜;TBST洗滌3次后,與辣根過氧化物酶標記的羊抗兔二抗孵育1 h,TBST洗滌3次,滴加發光液,顯影并采用凝膠圖像系統分析。
1.3統計學方法 應用SPSS13.0統計軟件分析數據。計量資料比較采用單因素方差分析和SNK-q檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1不同濃度DHA對BGC-823細胞的增殖活性的影響 不同濃度DHA作用于BGC-823細胞后,其抑制率隨藥物濃度的增加而增大,且隨著時間的延長而增大,具有顯著的劑量和時間依賴性,差異有統計學意義(P<0.05)。見表1。DHA作用的IC50為3.4 μmol/L。
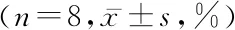
表1 不同濃度DHA對BGC-823細胞的抑制率比較
2.2FCM檢測DHA對BGC-823細胞凋亡的影響 隨著DHA藥物濃度的增加,凋亡峰愈加明顯,并呈現出劑量依賴性。差異有統計學意義(P<0.01)。見表2,圖1。
2.3DHA對BGC-823細胞凋亡形態學的影響 熒光顯微鏡觀察細胞凋亡的形態特征,對照組呈現淡藍色熒光,且分布均勻、形態完整;隨著DHA濃度的增加,實驗組BGC-823細胞表現為細胞核固縮,藍色熒光增強,部分細胞核呈現顆粒團狀染色質或碎裂成許多球形顆粒物質,見圖2。透射電子顯微鏡觀察細胞凋亡的形態特征:對照組細胞器豐富,細胞核染色質分布均勻;1.7 μmol/L組細胞輕度固縮,染色質電子密度增加,邊集于核膜下;3.4 μmol/L組細胞固縮加重,核膜下染色質邊集進一步增厚;6.8 μmol/L組細胞體積明顯縮小,胞質高度濃縮,染色質邊集更加明顯,見圖3。
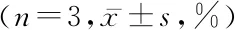
表2 FCM檢測不同濃度DHA作用48 h后BGC-823細胞凋亡率比較
2.4DHA對BGC-823細胞凋亡相關蛋白Bax、Caspase-3、Caspase-8的影響 Western blotting結果表明,BGC-823細胞隨著DHA用藥濃度的增大,Bax、Caspase-3、Caspase-8條帶變寬、變深。細胞中Bax、Caspase-3、Caspase-8蛋白表達隨著DHA給藥濃度的增加而增高,差異有統計學意義(P<0.05)。見表3,圖4。

表3 不同濃度DHA及對照組作用48 h后BGC-823細胞Bax 、Caspase-3、Caspase-8蛋白表達

Figure 3 BGC-823 cells morphology using transmission electron microscope
3 討 論
我國每年新增的胃癌患者約為67.9萬,死亡約為49.8萬,占全球總人數的45%[9]。雖然近些年,通過改善飲食習慣、降低危險因素等方法,胃癌發病率逐年降低,但仍是常見的惡性腫瘤之一。抑制腫瘤生長是目前臨床治療腫瘤的重要途徑。DHA是青蒿素的主要衍生物,對多種組織的人類惡性腫瘤具有明顯的細胞毒性作用[3-8]。為了考察DHA抗胃癌的作用和機制,本研究采用人胃癌細胞BGC-823細胞探討DHA抗胃癌的效果及機制。本實驗通過MTT檢測DHA對人胃癌細胞BGC-823細胞增殖活性的影響,結果顯示DHA對BGC-823細胞增殖的抑制作用明顯且具有時間和劑量依賴性。
在MTT檢測過程中,通過倒置顯微鏡可見用藥組細胞凋亡現象明顯。細胞凋亡是一個高度調控的細胞死亡過程,主要負責清除那些已經高度損壞、被破壞、老化和不可修復的細胞,以維持多細胞生物的正常生理過程。細胞凋亡出現異常可以導致和促進多種疾病如:自身免疫性疾病、神經退行性疾病、心臟病和癌癥等的發生[10-12]。因此,涉及細胞凋亡調控的因素對疾病的診斷和干預有著巨大的價值。本實驗通過 FCM檢測發現隨著DHA給藥濃度的升高,細胞凋亡率也隨之升高,表現為明顯濃度依賴性。進一步通過熒光顯微鏡及透射電子顯微鏡觀察,發現用藥組細胞隨著給藥濃度的升高,細胞凋亡形態的變化更加明顯,與FCM結果一致。
Caspases是屬于半胱氨酸天冬氨酸蛋白酶的一類蛋白質,在凋亡的過程中發揮著重要的作用[13]。內源性和外源性凋亡都依賴于Caspases家族成員的激活。在細胞凋亡之前,細胞的表面受體會傳遞一種來自細胞外微環境的死亡信號,“死亡”配體與其受體結合,形成誘導死亡的信號復合體,然后激活Caspase-8,進一步激活Caspase-3,從而引發細胞凋亡[14]。Caspase-8主要位于線粒體,少數位于胞質和胞核中,其介導TNFR1等死亡受體誘導的細胞凋亡,是凋亡途徑關鍵的啟動者[15]。Caspase-3是整個凋亡通路的中樞,是Caspase凋亡級聯通路的效應體,Caspase-3在啟動外部凋亡通路和內部凋亡通路后均被激活,其作為細胞凋亡的執行者,通過特異性地裂解底物最終導致細胞凋亡[16]。Bax 又稱成孔蛋白,是Bcl-2家族中經典的促凋亡因子,在調節細胞凋亡中發揮著重要的作用[17]。它可以在線粒體外膜上形成孔,導致線粒體的破壞并使細胞色素C釋放增加,與Apaf-1相互作用,導致Caspase-9的激活,引起Caspases 的級聯反應,最終導致細胞凋亡[18]。有研究表明,Bax、Caspase-3、Caspases-8基因的激活促進細胞凋亡[19]。本實驗通過Western blotting測定Bax、Caspase-3、Caspase-8基因表達,結果顯示其表達量用藥組高于對照組,提示DHA可以使Bax、Caspase-3、Caspase-8的表達增加,進而誘導細胞凋亡。
由此可見,DHA對BGC-823細胞的增殖具有明顯的抑制作用,其誘導凋亡的機制可能是通過上調Bax、Caspase-3、Caspases-8的表達而起作用,但DHA誘導凋亡信號通路的具體分子機制有待進一步研究。

