響應(yīng)面法優(yōu)化蝸牛酶輔助超聲提取荷葉總生物堿的工藝研究
鄭艷艷 李莉 袁曉慶


摘要 [目的]以荷葉中生物堿類化合物的提取率為評價指標(biāo),采用響應(yīng)面試驗建立并優(yōu)化蝸牛酶輔助超聲提取荷葉總生物堿的最佳工藝。[方法]通過單因素試驗研究了HCl濃度(%)、料液比(g/mL)、酶解時間(h)、酶解溫度(℃)、酶添加量(%)對荷葉總生物堿提取率的影響,并在此基礎(chǔ)上采用響應(yīng)面法建立數(shù)學(xué)模型進(jìn)行數(shù)據(jù)分析,對荷葉中總生物堿提取工藝進(jìn)行優(yōu)化及驗證。[結(jié)果]當(dāng)HCl提取液濃度為1.0%、料液比(g/mL)為1∶40、酶解時間為2.3 h、酶解溫度為53 ℃、酶添加量為1.3%時,荷葉總生物堿的提取效果最佳,平均提取率為1.03 %。[結(jié)論]蝸牛酶輔助超聲提取荷葉中的總生物堿效果較好,該研究能夠為荷葉資源的充分利用提供一定的技術(shù)支撐和理論依據(jù)。
關(guān)鍵詞 蝸牛酶;荷葉;總生物堿;超聲輔助;響應(yīng)面法
中圖分類號 R284.2 ?文獻(xiàn)標(biāo)識碼 A
文章編號 0517-6611(2020)21-0183-05
Abstract [Objective]Taking the extraction rate of alkaloids from lotus leaf as the evaluation index,response surface experiment was used to establish and optimize the best process of snailase assisted ultrasonic extraction of total alkaloids in lotus leaf.[Method]The effects of HCl concentration (%),material liquid ratio (g/mL),enzymolysis time (h),enzymolysis temperature (℃) and enzyme addition (%) on the extraction rate of total alkaloids were studied by single factor experiment.On the basis,the response surface method was used to establish a mathematical model for data analysis and to optimize and verify the extraction process of total alkaloids from lotus leaf.[Result]When the concentration of HCl was 1.0%,the ratio of material to liquid (g/mL) was 1∶40,the time of enzymolysis was 2.3 h,the temperature of enzymolysis was 53℃,and the amount of enzyme added was 1.3%,the extraction effect of total alkaloids from lotus leaf was the best,and the average extraction rate was 1.03%.[Conclusion]Ultrasonic assisted extraction of total alkaloids from lotus leaf with snailase has a good effect.This study can provide some technical support and theoretical basis for the full utilization of lotus leaf resources.
Key words Snailase;Lotus leaf;Total alkaloid;Ultrasonicassisted extraction
基金項目 大學(xué)生創(chuàng)新創(chuàng)業(yè)項目(201910452001);臨沂大學(xué)博士科研啟動經(jīng)費項目(LYDX2016BS050)。
作者簡介 鄭艷艷(1999—),女,山東臨沂人,本科生,研究方向:天然產(chǎn)物的分離與純化。*通信作者,講師,從事天然產(chǎn)物的色譜分離與分析研究。
收稿日期 2020-04-13
荷葉(Lotus leaf)是睡蓮科植物蓮(Nelumbo nucifera Gaertn)的葉片。荷葉在我國的應(yīng)用歷史悠久,《本草綱目》記載“荷葉服之,令人瘦劣,故單服可消陽水浮腫之氣” [1-2]。我國荷葉資源非常豐富,但沒有得到很好的利用,每年僅有約1%荷葉得到合理開發(fā),剩余的絕大部分均被廢棄。研究表明,荷葉中含有多種天然產(chǎn)物,主要包括黃酮、生物堿、有機(jī)酸和揮發(fā)油類等[3]。荷葉提取物具有抗氧化、抑菌、降脂減肥、鎮(zhèn)靜催眠、抗焦慮、防治高膽固醇血癥和動脈硬化等功效[4-5]。很多研究表明,荷葉具有眾多生物活性的物質(zhì)基礎(chǔ)是其含有的黃酮類和生物堿類化合物。其中,荷葉生物堿具有抗腫瘤、調(diào)脂減肥、抗衰老和抗瘧等生物活性[6]。目前,已有很多關(guān)于荷葉堿分離提取和藥理活性等的研究報道。
傳統(tǒng)的提取生物堿的方法有溶劑萃取法、索氏提取法、酸水提取法、超臨界萃取法、微波輔助提取法和超聲輔助提取法等[7]。由于生物堿等天然產(chǎn)物存在于植物細(xì)胞中,用傳統(tǒng)方法進(jìn)行提取時,溶劑需克服細(xì)胞壁和細(xì)胞間質(zhì)等造成的傳質(zhì)阻力才能滲透進(jìn)細(xì)胞。細(xì)胞壁由半纖維素、纖維素和果膠質(zhì)等物質(zhì)構(gòu)成,其結(jié)構(gòu)致密,因此會對提取造成一定的阻力[8]。酶輔助提取能分解構(gòu)成細(xì)胞壁的半纖維素、纖維素和果膠,使細(xì)胞壁塌陷、溶解、疏松,破壞細(xì)胞壁的結(jié)構(gòu),從而能減少提取時細(xì)胞壁和細(xì)胞間質(zhì)造成的阻力,使各類天然產(chǎn)物溶出細(xì)胞的速率加快,縮短提取時間,提高提取效率。蝸牛酶是果膠酶、纖維素酶和淀粉酶等20多種酶的混合酶,能同時降解果膠和纖維素等細(xì)胞壁的成分[9-10]。
將蝸牛酶用于超聲提取荷葉生物堿,能使荷葉破壁,加速細(xì)胞中生物堿等天然產(chǎn)物的釋放,從而提高荷葉生物堿的提取率。筆者采用單因素試驗考察酶用量、酶解時間、酶解溫度和HCl濃度等因素對荷葉生物堿提取率的影響,并在此基礎(chǔ)上,采用響應(yīng)面法對酶輔助超聲提取荷葉生物堿的提取工藝進(jìn)行優(yōu)化,得到最佳提取工藝,旨在為荷葉資源的進(jìn)一步開發(fā)應(yīng)用提供技術(shù)支撐和理論依據(jù)。
1 材料與方法
1.1 材料 荷葉采購自山東省濟(jì)寧市,粉碎成細(xì)粉,備用。蝸牛酶(BR,破壁率90%),上海源葉生物科技有限公司;荷葉堿(分析標(biāo)準(zhǔn)品,HPLC≥98%),上海源葉生物科技有限公司;二氯甲烷(分析純),天津市永大化學(xué)試劑有限公司;無水乙醇(分析純),天津市永大化學(xué)試劑有限公司;鹽酸(分析純),南京化學(xué)試劑有限公司;檸檬酸(分析純),天津博迪化工股份有限公司;檸檬酸鈉(分析純),天津市鑫鉑特化工有限公司。
1.2 儀器
KQ-500B型超聲波清洗器,昆山市超聲儀器有限公司;TU-1901雙光束紫外可見分光光度計,北京普析通用儀器有限責(zé)任公司;SHB-B95型循環(huán)水式多用真空泵,鄭州長城科工貿(mào)有限公司;ME104E電子天平,梅特勒-托利多儀器(上海)有限公司;GZX-GFC·101-2-S電熱恒溫鼓風(fēng)干燥箱,上海博泰實驗設(shè)備有限公司;SE-750型高速粉碎機(jī),永康市圣象電器有限公司;DZF-6021型真空干燥箱,上海一恒科技有限公司。
1.3 方法
1.3.1 對照品溶液的制備。
精密稱取荷葉堿對照品2.5 mg,置于50 mL容量瓶中,用無水乙醇溶解并定容至刻度,搖勻,即得荷葉堿對照品溶液(0.05 mg/mL)。再分別量取0.5、1.0、1.5、2.0、2.5、3.0 mL于10 mL容量瓶中并用無水乙醇稀釋定容至刻度,搖勻,即得濃度分別為2.5、5.0、7.5、10.0、12.5、15.0 μg/mL的荷葉堿對照品溶液。
1.3.2 荷葉生物堿標(biāo)準(zhǔn)曲線的繪制。
取荷葉堿對照品溶液,利用紫外可見分光光度計在紫外可見光區(qū)測其吸收曲線,得到荷葉堿的最大吸收波長。在最大吸收波長處,分別檢測“1.3.1”中配制的不同濃度對照品溶液的吸光度,以吸光度為橫坐標(biāo)、對照品溶液濃度為縱坐標(biāo)作圖,從而得到標(biāo)準(zhǔn)曲線以及標(biāo)準(zhǔn)曲線方程。
1.3.3 荷葉總生物堿含量測定。
稱取3 g荷葉粉,加入蝸牛酶和30 mL pH 5的檸檬酸緩沖溶液,于水浴鍋恒溫酶解,加入一定體積一定濃度的稀HCl溶液,室溫下浸泡提取一定時間,然后再超聲20 min,抽濾,提取3次,合并提取液,得荷葉總生物堿提取液。精密量取提取液5 mL,用氨水調(diào)pH至9后,置于60 mL分液漏斗中,加入10 mL二氯甲烷萃取,萃取3次,合并二氯甲烷層萃取液,用移液管移取二氯甲烷層萃取液2 mL,干燥,然后用無水乙醇溶解于10 mL容量瓶,定容至刻度,搖勻,即得荷葉總生物堿供試品溶液。以無水乙醇為空白,于波長270 nm下測其吸光度,根據(jù)“1.3.2”所得標(biāo)準(zhǔn)曲線方程計算荷葉中總生物堿的含量。
1.3.4 蝸牛酶輔助超聲提取荷葉總生物堿的單因素試驗。
選取HCl濃度、料液比、酶解時間、酶解溫度、酶添加量為考察參數(shù),以荷葉堿提取率為評價指標(biāo),進(jìn)行單因素試驗,試驗設(shè)計如下:①檸檬酸/檸檬酸鈉緩沖液30 mL,0.5%蝸牛酶,酶解溫度50 ℃,酶解時間1.5 h,料液比(g/mL)1∶10,浸提時間2.5 h,超聲20 min,HCl濃度分別為0.25%、0.50%、0.75%、1.00%、1.25%;②檸檬酸/檸檬酸鈉緩沖液30 mL,0.5%蝸牛酶,酶解溫度50 ℃,酶解時間1.5 h,濃度1.0%的HCl,浸提時間2.5 h,超聲20 min,料液比分別為1∶10、1∶20、1∶30、1∶40、1∶50 (g/mL);③檸檬酸/檸檬酸鈉緩沖液30 mL,0.5%蝸牛酶,酶解溫度50 ℃,濃度1.0%的 HCl,料液比(g/mL)1∶40,浸提時間2.5 h,超聲20 min,酶解時間分別為1.0、1.5、2.0、2.5、3.0 h;④檸檬酸/檸檬酸鈉緩沖液30 mL,0.5%蝸牛酶,酶解時間2.5 h,濃度1.0%的 HCl,料液比(g/mL)1∶40,浸提時間2.5 h,超聲20 min,酶解溫度分別為40、45、50、55、60 ℃;⑤檸檬酸/檸檬酸鈉緩沖液30 mL,酶解溫度50 ℃,酶解時間2.5 h,濃度1.0%的HCl,料液比(g/mL)1∶40,浸提時間2.5 h,超聲20 min,酶添加量分別為0.5%、1.0%、1.5%、2.0%、2.5%。
1.3.5 超聲輔助提取工藝參數(shù)BBD設(shè)計試驗。
根據(jù)單因素試驗的結(jié)果,以酶解時間(A)、酶解溫度(B)、酶添加量(C)3個因素作為變量,利用Design-Expert.V8.0.6軟件,以-1、0、1代表變量水平,進(jìn)行BBD設(shè)計的3因素3水平響應(yīng)面試驗,獨立變量的真實值與編碼水平如表1所示。
選擇3因素3水平的BBD結(jié)合響應(yīng)面對試驗進(jìn)行進(jìn)一步優(yōu)化,以此來考察酶解時間、酶解溫度、酶添加量3個因素不同水平組合對荷葉總生物堿提取率的影響。荷葉總生物堿提取率的二階多元回歸方程如下式所示:
Y=β0+βi3Xi+βiiXi2+33βijXiXj
式中,Xi、Xj表示獨立的變量;Y表示響應(yīng)變量;β0表示常數(shù);βi表示一次項系數(shù);βii表示二次項系數(shù);βij表示交互項常數(shù)。
2 結(jié)果與分析
2.1 荷葉生物堿標(biāo)準(zhǔn)曲線
取0.05 mg/mL荷葉堿對照品,用紫外可見分光光度計測其吸收曲線,得荷葉堿的最大吸收波長為270 nm。在波長270 nm處檢測“1.3.1”中所配制的不同濃度對照品溶液,所得標(biāo)準(zhǔn)曲線如圖1所示。由圖1可知,線性回歸方程、相關(guān)系數(shù)分別為:y=17.719x-0.065 2,R2=0.999 8。
2.2 HCl濃度對荷葉總生物堿提取率的影響
在其他參數(shù)(酶添加量、酶解時間、酶解溫度、料液比)相同的條件下,比較不同濃度HCl對荷葉總生物堿提取率的影響,結(jié)果如圖2所示。
由圖2可知,隨著HCl濃度的升高,荷葉總生物堿提取率先升高后降低,HCl濃度為1.00%時,總生物堿提取率最大。出現(xiàn)這一現(xiàn)象的原因可能是HCl濃度過高,蝸牛酶的生物活性受到一定抑制,不利于提取。因此,該試驗選擇 HCl濃度為1.00%。
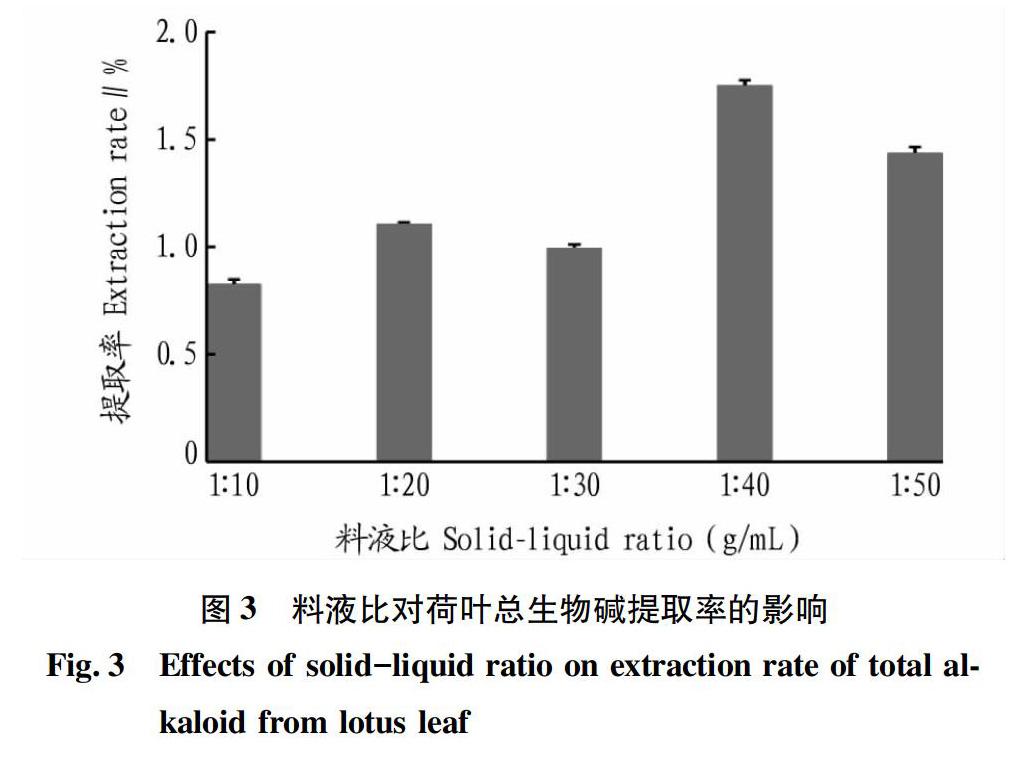
2.3 料液比對荷葉總生物堿提取率的影響
在其他參數(shù)(酶添加量、酶解時間、酶解溫度、HCl濃度)相同的條件下,比較不同料液比對荷葉總生物堿提取率的影響,結(jié)果圖3所示。
由圖3可知,隨著料液比的減小,荷葉總生物堿提取率先升高后降低;當(dāng)料液比為1∶40時,荷葉總生物堿的提取率達(dá)到最高。出現(xiàn)這一現(xiàn)象的原因可能是溶劑量的增加使荷葉粉與溶劑接觸面積增大,同時,溶液的傳質(zhì)推動力也增大,有利于總生物堿的溶出,從而使其提取率變大;但是,當(dāng)溶劑增加過多時,大量溶劑的存在會稀釋生物堿提取液,使得提取率下降。因此,該研究選擇最佳料液比為1∶40(g/mL)。
2.4 酶解時間對荷葉總生物堿提取率的影響
在其他參數(shù)(酶添加量、料液比、酶解溫度、HCl濃度)相同的條件下,比較不同酶解時間對荷葉總生物堿提取率的影響,結(jié)果如圖4所示。
由圖4可知,隨著提取時間的延長,總生物堿提取率呈先升高后降低的趨勢。在提取時間為2.5 h時,提取率達(dá)到最高;繼續(xù)延長提取時間,荷葉總生物堿提取率下降。因此,該研究選擇提取時間為2.5 h進(jìn)行后續(xù)試驗。
2.5 酶解溫度對荷葉總生物堿提取率的影響
在其他參數(shù)(酶添加量、料液比、酶解時間、HCl濃度)相同的條件下,比較不同酶解溫度對荷葉總生物堿提取率的影響,結(jié)果如圖5所示。
由圖5可知,在溫度低于50 ℃時,荷葉總生物堿得率隨著溫度的升高而增大,50 ℃時得率達(dá)到最大值;繼續(xù)升高溫度后,荷葉總生物堿提取率開始下降。出現(xiàn)這一現(xiàn)象的原因可能是,溫度在低于50 ℃的范圍內(nèi)逐漸升高,蝸牛酶的活性逐漸增強(qiáng),酶水解反應(yīng)較強(qiáng),使得細(xì)胞壁上的果膠物質(zhì)水解程度增大,且反應(yīng)速率加快;溫度超過50 ℃以后,維系酶空間結(jié)構(gòu)的非共價鍵因高溫斷裂,部分蝸牛酶失去活性,細(xì)胞壁上的纖維素和果膠物質(zhì)等水解程度降低,細(xì)胞中的生物堿類化合物溶出能力降低,從而導(dǎo)致提取率下降。因此,該研究選擇提取溫度為50 ℃進(jìn)行后續(xù)試驗。
2.6 酶添加量對荷葉總生物堿提取率的影響
在其他參數(shù)(酶解溫度、料液比、酶解時間、HCl濃度)相同的條件下,比較不同酶添加量對荷葉總生物堿提取率的影響,結(jié)果如圖6所示。
由圖6可知,隨著酶添加量的增多,荷葉總生物堿的提取率先升高后降低,當(dāng)酶添加量為1.5%時,提取率最大;酶添加量繼續(xù)增大,生物堿得率呈下降趨勢。其原因可能是酶用量較低時,酶與底物結(jié)合較充分,細(xì)胞壁與細(xì)胞間的果膠物質(zhì)水解程度大,生物堿能很好的溶出。當(dāng)酶用量大于1.5%時,底物濃度不能使酶達(dá)到飽和,從而抑制酶水解果膠成分,使總生物堿的提取率下降[11]。因此,該研究選擇酶添加量為1.5%進(jìn)行后續(xù)試驗。
2.7 響應(yīng)面法優(yōu)化蝸牛酶輔助超聲提取荷葉總生物堿的工藝研究
2.7.1 BBD與響應(yīng)面試驗結(jié)果。
根據(jù)BBD設(shè)計原理,綜合單因素試驗結(jié)果,選取酶解時間(A)、酶解溫度(B)、酶添加量(C)3個因素,在單因素試驗的基礎(chǔ)上,采用3因素3水平的響應(yīng)面分析方法,研究3因素之間的不同組合對荷葉總生物堿提取率的影響。試驗設(shè)計及結(jié)果如表2所示。
利用Design-Expert 8.0.6軟件對試驗結(jié)果進(jìn)行回歸擬合,得到總生物堿提取率對以上3個因素的二次多項回歸模型為:
Y=1.05+0.021A+0.011B-0.022C+0.025AB-0.017AC-0.013BC-0.062A2-0.037B2-0.080C2
式中,Y代表提取率,A代表酶解時間,B代表酶解溫度,C代表酶添加量。
從表3方差分析可知,該模型的F值為22.11>0.05,P=0.000 2<0.01,表明該模型方程具有極顯著差異,利用該模型分析各因素對試驗過程的影響是合理的。失擬項檢驗P=0.157 5,說明失擬項差異無統(tǒng)計學(xué)意義。綜上可知,該二次方程模型擬合度好,試驗誤差小,能夠準(zhǔn)確地反映酶解溫度、酶解時間和酶添加量3 個因素對荷葉總生物堿提取率的影響,可以利用該模型對荷葉總生物堿的蝸牛酶輔助超聲提取工藝進(jìn)行優(yōu)化分析。由表3可知,一次項A、C,交互項AB,二次項A2、B2和C2對響應(yīng)值影響顯著。比較各項的F值可知,各因素對響應(yīng)值提取率的影響大小為C>A>B,即酶添加量>酶解時間>酶解溫度。
2.7.2 響應(yīng)面分析。
響應(yīng)曲面的陡峭程度反映兩因素交互作用的顯著程度,曲面越陡峭,顯著程度越高;陡峭程度越小,則表示交互作用程度越低。各因素之間的響應(yīng)曲面如圖7~9所示。
如圖7所示,酶解溫度和酶解時間對提取率的響應(yīng)曲面陡峭,說明酶解溫度和酶解時間的交互作用顯著。總生物堿提取率隨酶解溫度和酶解時間的遞增先增加后減少,酶解時間對荷葉總生物堿提取率的影響大于酶解溫度。
如圖8所示,響應(yīng)曲面不陡峭,說明酶解時間和酶添加量的交互作用不顯著,總生物堿的提取率隨酶解時間和酶添加量的遞增先增加后減少,且酶添加量對于荷葉總生物堿提取率的影響大于酶解時間。
如圖9所示,曲面相對平緩,說明酶解溫度和酶添加量
的交互作用不顯著,總生物堿提取率隨酶解溫度和酶添加量的遞增先增加后減少,且酶添加量對于荷葉總生物堿提取率的影響大于酶解溫度。
2.7.3 最佳工藝條件的確定。
通過Design-Expert 8.0.6軟件,依據(jù)數(shù)學(xué)回歸模型對數(shù)據(jù)進(jìn)行優(yōu)化,得出蝸牛酶輔助超聲提取荷葉總生物堿的最佳工藝條件為酶解時間2.29 h,酶解溫度52.66 ℃,酶添加量1.3%,預(yù)測荷葉總生物堿提取率為1.06 %。
實際操作調(diào)整為酶解時間2.3 h,酶解溫度53 ℃,酶添加量1.3%,驗證試驗得荷葉總生物堿提取率為1.03 %,與模型預(yù)測值接近,表明該響應(yīng)面法優(yōu)選的提取條件準(zhǔn)確可靠。
3 結(jié)論
本研究考察了蝸牛酶輔助超聲提取荷葉中總生物堿的各項影響參數(shù),確定 HCl濃度為1.0 %,最佳料液比為1∶40(g/mL)時提取效果最佳。在此基礎(chǔ)上,以Design-Expert 8.0.6軟件為平臺,對酶解時間、酶解溫度、酶添加量進(jìn)行3因素3水平的響應(yīng)面設(shè)計試驗,結(jié)果表明:酶解時間2.29 h,酶解溫度52.66 ℃,酶添加量1.3%,預(yù)測荷葉總生物堿提取率為1.06 %。以響應(yīng)面優(yōu)化的參數(shù)為指導(dǎo),最終確定蝸牛酶輔助超聲提取荷葉總生物堿的最佳工藝條件為酶解時間2.3 h,酶解溫度53℃,酶添加量1.3%,按照該工藝條件進(jìn)行提取,荷葉生物堿的平均得率為1.03%。研究結(jié)果表明,蝸牛酶輔助超聲提取對荷葉總生物堿類化合物具有較好的溶出效果,可將其應(yīng)用于生物堿及其他天然產(chǎn)物的提取中。蝸牛酶輔助超聲提取荷葉中的總生物堿具有操作簡單、成本低、綠色環(huán)保等特點,可為廢棄荷葉的開發(fā)利用提供一定的技術(shù)支撐和理論依據(jù)。
參考文獻(xiàn)
[1]李毛毛,黃鑫源,梁乾坤,等.荷葉水提物對實驗性肥胖大鼠脂代謝的影響及機(jī)制[J].中國應(yīng)用生理學(xué)雜志,2017,33(5):476-480.
[2]YOU J S,LEE Y J,KIM K S,et al.Ethanol extract of lotus (Nelumbo nucifera) root exhibits and antiadipogenic effect in human preadipocytes and antiobesity and antioxidant effects in rats fed a highfat diet [J].Nutrition research,2014,34(3):258-267.
[3]王玉霞,劉斌,姜艷艷.荷葉生物堿提取純化工藝研究[J].北京中醫(yī)藥大學(xué)學(xué)報,2013,36(9):622-626.
[4]黃秀瓊,卿志星,曾建國.蓮不同部位化學(xué)成分及藥理作用研究進(jìn)展[J].中藥,2019,50(24):6162-6180.
[5]夏明輝,趙晶,韓立峰,等.荷葉化學(xué)及藥理學(xué)研究進(jìn)展[J].遼寧中醫(yī)藥大學(xué)學(xué)報,2015,17(11):102-104.
[6]程婷婷,原新博,惠小涵,等.荷葉生物堿成分及其調(diào)脂機(jī)制研究進(jìn)展[J].中草藥,2019,50(8):1998-2003.
[7]邢毅.荷葉堿的提取分離及荷葉提取物降血脂功能研究[D].無錫:江南大學(xué),2019.
[8]JOO C G,LEE K H,PARK C,et al.Antioxidative activities and composition analysis of Pinus densiflora root by ultra high pressure extraction[J].Journal of industrial and engineering chemistry,2011,17(4):712-716.
[9]陳文娟,陳建福,盧惠婷,等.蝸牛酶輔助提取白芽奇蘭茶多糖及其抗氧化活性[J].安徽農(nóng)業(yè)大學(xué)學(xué)報,2018,45(6):996-1003.
[10]楊春瑜,劉海玲,楊春莉,等.響應(yīng)曲面法優(yōu)化蝸牛酶輔助提取黑木耳多糖工藝[J].食品工業(yè)科技,2015,36(22):198-202.
[11]崔瑋,張勇,高海寧,等.響應(yīng)面試驗優(yōu)化果膠酶輔助提取鎖陽原花青素工藝[J].食品科學(xué),2016,37(14):18-23.

