BDT、BDTO分子結構修飾后高發光性能納米材料的篩選及其在血清PCT檢測中的應用
張海燕,張賽,鄺振展,胡蓉,劉仲明 中國人民解放軍南部戰區總醫院,廣州5000;深圳市亞輝龍生物科技股份有限公司;華南理工大學
降鈣素原(PCT)是降鈣素的前肽物質,廣泛應用于感染性疾病的診斷及鑒別診斷,近年來PCT已經成為全身性炎癥反應、敗血癥、膿毒血癥等疾病的預警生物指標之一[1]。目前,PCT的檢測方法主要有免疫熒光法、膠體金免疫層析法、凝膠層析法及高效液相色譜分析法等[2],但現有的商品化熒光材料在高濃度或聚集狀態下通常發光會減弱甚至不發光,即聚集導致的熒光淬滅(ACQ),從而嚴重影響了檢測靈敏度[3]。具有聚集誘導發光(AIE)性能的熒光材料被證實在聚集態及固態下均具有較高的發光性能,可有效減少ACQ現象,廣泛應用于檢測、成像等諸多領域[4]。苯并[1,2-b:4,5-b′]二噻吩(BDT)是一種重要的含硫雜環,具有較大的共軛平面等特點[5,6],能賦予體系優異的光學性能。此外,BDT是一種典型的給電子基團,便于構筑給-受體(D-A)型結構,調控發光性能。2019年2~8月,本研究制備了含BDT及對BDT氧化后的苯并[1,2-b:4,5-b′]-二噻吩1,1,5,5-四氧化物(BDTO)的系列衍生物,篩選BDT和BDTO經三苯胺(TPA)、3位連接咔唑(PcZ)、9位連接咔唑(CzP)及叔丁基(TCzP)分子結構修飾后具有高發光性能的納米材料,并將其應用于血清PCT的磁微球免疫熒光分析檢測。現報告如下。
1 材料與方法
1.1 材料 血清樣本:檢測確認后的不同濃度血清PCT樣品由中國人民解放軍南部戰區總醫院檢驗科提供。主要試劑:300 μm粒徑磁珠標記的抗PCT捕獲抗體(0.1 mg/mL)、熒光微球FM02標記的抗PCT檢測抗體(1 mg/mL)均購自深圳市亞輝龍生物科技股份有限公司,清洗液(含0.2% Tween的PBS溶液)、酶聯免疫熒光試劑均購自梅里埃診斷產品有限公司。主要儀器:F97熒光分光光度計購自上海棱光技術有限公司,ThermoCell MiXing Block MB-102恒溫金屬浴購自杭州博日科技有限公司,八通道磁分離架購自德國Merck Millipore公司。
1.2 BDT、BDTO的分子結構修飾 參照Zhen等[7]的方法,對BDT、BDTO進行TPA、PcZ、CzP及TCzP分子結構修飾,制備TPA-BDT、TPA-BDTO、PcZ-BDT、PcZ-BDTO、CzP-BDT、CzP-BDTO、TCzP-BDT、TCzP-BDTO等8種BDT、BDTO化合物,其結構式見圖1。以CzP-BDT及CzP-BDTO為例,CzP-BDT的制備方法:在125 mL的兩口瓶中加入604 mg(1 mmol)雙溴苯并二噻吩、1 150 mg(4 mmol)咔唑硼酸、58 mg四(三苯基膦)鈀(0.05 mmol)和553 mg碳酸鉀(4 mmol),抽換氣3次之后加入甲苯∶乙醇∶水(體積比為8∶1∶1)150 mL,加熱反應12 h后,冷卻至室溫;倒入蒸餾水中,二氯甲烷萃取3次,合并萃取得到的有機層溶液,飽和碳酸氫鈉洗2次、水洗3次;無水硫酸鎂干燥,過濾后將有機溶劑通過旋蒸除去;采用柱層析法進行分離提純,最后得到黃色固體產物CzP-BDT。CzP-BDTO的制備方法:在125 mL的兩口瓶中加入670 mg(1 mmol)雙溴苯并氧化二噻吩、1 150 mg(4 mmol)咔唑硼酸、58 mg四(三苯基膦)鈀(0.05 mmol)和553 mg碳酸鉀(4 mmol),其余步驟同CzP-BDT的制備,最后得到橙紅色固體產物CzP-BDTO。采用核磁(1H-NMR和13C-NMR)以及高分辨質譜對8種BDT、BDTO化合物進行結構表征分析,結果顯示其表征數據與Zhen等[7]的研究結果一致,證實所制備的化合物與預期一致。
圖1 8種BDT、BDTO化合物的結構式
1.3 高發光性能納米材料的篩選
1.3.1 發光性能相關指標檢測 將1.2得到的8種化合物溶解在四氫呋喃(THF)中,分別在紫外-可見分光光度計及熒光光譜儀上分析其紫外吸收光譜以及熒光發射光譜,以此判斷其最大吸收波長(λabs)、最大發射波長(λem)及Stokes位移。Stokes位移越大表示其發射的熒光越不容易被自吸收,即發光效率越高。將1.2得到的相同濃度的8種化合物(10 μmol/L)分別溶解在THF溶液(10 μmol/L,溶液態)和90%去離子水(THF∶H2O=1∶9,10 μmol/L,聚集態)中,用各自的λabs作為激發光源,測試其分別在溶液態及聚集態的絕對量子產率。絕對量子產率越高表示在相同激發條件下材料的發光性能越高,信噪比越高,即檢測的靈敏度越高。
1.3.2 在水中的聚集態行為觀察 利用動態光散射(DLS)法觀察8種納米材料在水中的分散行為。以CzP-BDT為例,將CzP-BDT分散在水中(10 μmol/L),總體積不超過1 mL,靜置2 min排除水溶液中的氣泡,在DLS儀器上檢測其粒徑分布,平行檢測3次得到最終的實驗結果。以粒徑分布判斷其在水中的分散性,在水中分散較好的疏水性分子越容易制備得到納米粒子,且粒徑分布越好、穩定性越高。其他化合物的粒徑表征均與CzP-BDT一致。
1.4 CzP-BDT納米粒子的包裝及標記 ①CzP-BDT納米粒子的包裝:采用改進的共沉淀技術[7]。基于DSPE-PEG-Mal聚合物作為包覆基質,通過注入含有CzP-BDT和DSPE-PEG-Mal的THF溶液,制備CzP-BDT納米粒子,并分散于去離子水中。經過連續超聲處理形成CzP-BDT納米粒子,DLS持續檢測,結果顯示其具有高穩定性、良好的水分散性,此外采用的包覆基質末端為羧基,使其表面易于功能化。將制備得到的CzP-BDT納米粒子行DLS檢測,結果顯示CzP-BDT納米粒子的水合粒徑為347 nm。②CzP-BDT納米粒子的標記:采用酰胺縮合一步法對CzP-BDT納米粒子標記抗PCT檢測抗體,在納米粒子水溶液中加入N-羥基琥珀酰亞胺及1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽活化納米粒子表面的羧基,攪拌30 min后,加入抗體,繼續反應5 h。
1.5 血清PCT檢測 ①采用熒光微球FM02的磁微球免疫熒光分析法(簡稱FM02法)。用生理鹽水將濃度為75 ng/mL的血清PCT樣品分別稀釋為45、30 ng/mL。取濃度分別為45、30、<0.05 ng/mL的血清PCT樣品和生理鹽水各100 μL,分別與磁珠標記的抗PCT捕獲抗體(0.1 mg/mL)和熒光微球FM02標記的抗PCT檢測抗體(0.1 mg/mL)各100 μL振蕩混勻;37 ℃條件下孵育20 min,置于磁分離架靜置2 min,清洗液清洗后復溶,在470 nm激發波長下檢測其熒光發射光譜。②采用CzP-BDT的磁微球免疫熒光分析法(簡稱CzP-BDT法)。用生理鹽水將濃度為75 ng/mL的血清PCT樣品分別稀釋為45、30 ng/mL。取濃度分別為45、30、<0.05 ng/mL的血清PCT樣品和生理鹽水各100 μL,與磁珠標記的抗PCT捕獲抗體(0.1 mg/mL)和CzP-BDT納米粒子標記的抗PCT檢測抗體(0.1 mg/mL)各100 μL振蕩混勻;37 ℃條件下孵育20 min,置于磁分離架靜置2 min,清洗液清洗后復溶,在364 nm激發波長下檢測其熒光發射光譜。記錄兩種方法檢測時在最大發射峰處的熒光強度。
2 結果
2.1 8種BDT、BDTO化合物的發光性能相關指標檢測結果 8種化合物在聚集態均有較強的熒光發射,其λem均在可見光范圍內,BDT化合物的λem為453~475 nm、BDTO化合物的λem為573~630 nm;在同種BDT或BDTO化合物中,PcZ、CzP、TCzP修飾后化合物的λabs、λem差異較小,而TPA修飾后化合物較前面三者修飾后化合物的λabs、λem均有一定程度紅移,即向長波長方向移動;BDTO化合物的λabs、λem相較于BDT化合物均發生紅移。BDTO化合物的Stokes位移普遍大于BDT化合物,而CzP修飾化合物的Stokes位移大于TPA、TCzP和TCzP修飾化合物。CzP-BDT、TCzP-BDT和TCzP-BDTO聚集態的絕對量子產率高于溶液態,BDTO化合物在溶液態、聚集態中的絕對量子產率普遍高于BDT化合物。8種化合物中,CzP-BDT無論在溶液態還是聚集態均具有較高的發光性能。見表1。
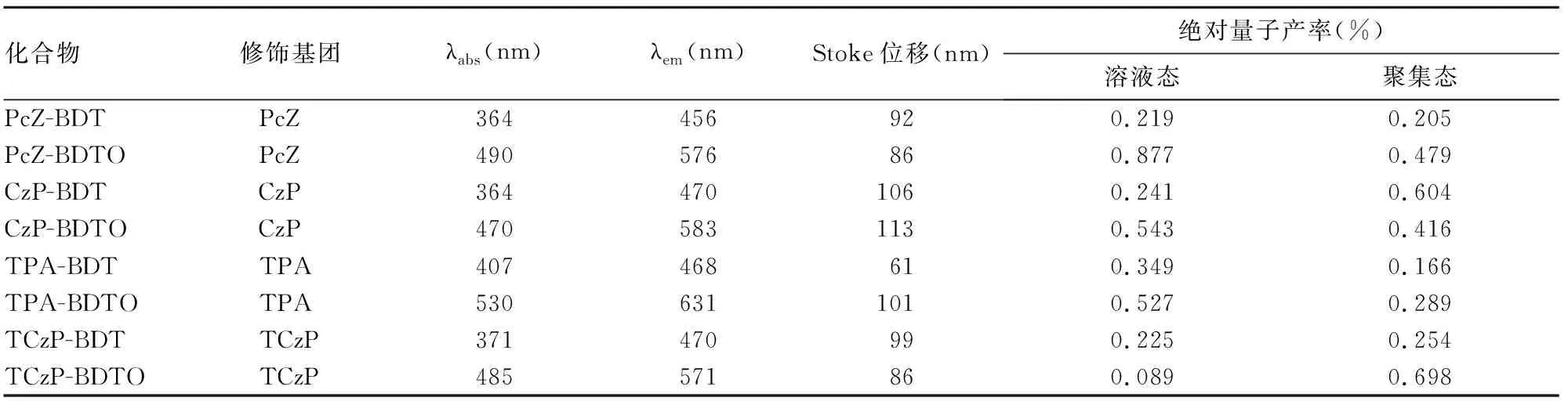
表1 8種BDT、BDTO化合物的發光性能相關指標檢測結果
2.2 8種BDT、BDTO化合物在水中的粒徑分布情況比較 除TCzP-BDT外,其他3種BDT化合物在水中的粒徑分布相差不大;4種BDTO化合物在水中的粒徑分布只有細微差異,并且BDTO化合物在水中的分散性較BDT化合物均有一定程度的增加。CzP-BDT在水中雖然分布不均,但在BDT化合物中,CzP-BDT在低于100 nm部分有較多的分布,綜合其較高的發光性能,選擇CzP-BDT作為進行后續實驗的納米材料。8種BDT、BDTO化合物在水中的粒徑分布情況見圖2。

圖2 8種BDT、BDTO化合物在水中的粒徑分布情況
2.3 兩種方法檢測不同濃度血清PCT的熒光光譜比較 在470 nm激發光波長下,FM02法檢測的發射光譜為500~650 nm,在525 nm處測得最大熒光強度;其中檢測45 ng/mL的血清PCT樣品時在525 nm處熒光強度為415.5,檢測30 ng/mL和<0.05 ng/mL的血清PCT樣品以及生理鹽水時在525 nm處熒光強度分別為197.5、197.5、146.8。在340 nm激發光波長下,CzP-BDT法檢測的發射光譜為500~650 nm,在525 nm處測得最大熒光強度;其中檢測45 ng/mL的血清PCT樣品時在525 nm處熒光強度為1 064.0,檢測30 ng/mL和<0.05 ng/mL的血清PCT樣品以及生理鹽水時在525 nm處熒光強度分別為766.2、664.0、456.9。兩種方法均能檢出45 ng/mL的血清PCT樣品,但對于30 ng/mL、<0.05 ng/mL的血清PCT樣品,只有采用CzP-BDT納米粒子進行免疫熒光檢測能實現有效鑒別并與生理鹽水進行區分。兩種方法檢測不同濃度血清PCT的熒光光譜見圖3。
3 討論
3.1 高發光性能納米材料的發光性能相關指標
3.1.1 λemλem與給電子能力相關。本研究結果顯示,8種化合物在聚集態都有較強的熒光發射,其λem均在可見光范圍內;同種BDT或BDTO化合物中,PcZ、CzP、TCzP修飾后化合物的λabs、λem差異較小,而TPA修飾后化合物較前面三者修飾后化合物的λabs、λem均有一定程度紅移;說明TPA較PcZ、CzP、TCzP的給電子能力更強,其化合物的D-A效果更明顯。此外,BDTO化合物的λabs、λem相較于BDT化合物均發生紅移,說明將噻吩氧化以后能夠使BDTO化合物形成D-A型結構,提高其吸電子能力。由此可見,同種類型取代基對化合物的發光性能影響不大,其發光性能主要取決于骨架結構。
3.1.2 Stokes位移 Stokes位移大小取決于取代基給電子能力,取代基給電子能力越弱,Stokes位移就越大。由于本研究所選用的發光材料激發態構型相較于基態變化較大,導致其激發態能量耗散而具有較大的Stokes位移,較大的Stokes位移可以使化合物的發射光受激發光影響小,防止自身ACQ,能量損失少,能有效提高檢測時的信噪比[8]。本研究結果顯示,這8種化合物均具有較大的Stokes位移(68~127 nm),同時BDTO化合物的Stokes位移大于BDT化合物,而CzP修飾化合物的Stokes位移大于TPA、TCzP、TCzP修飾化合物。
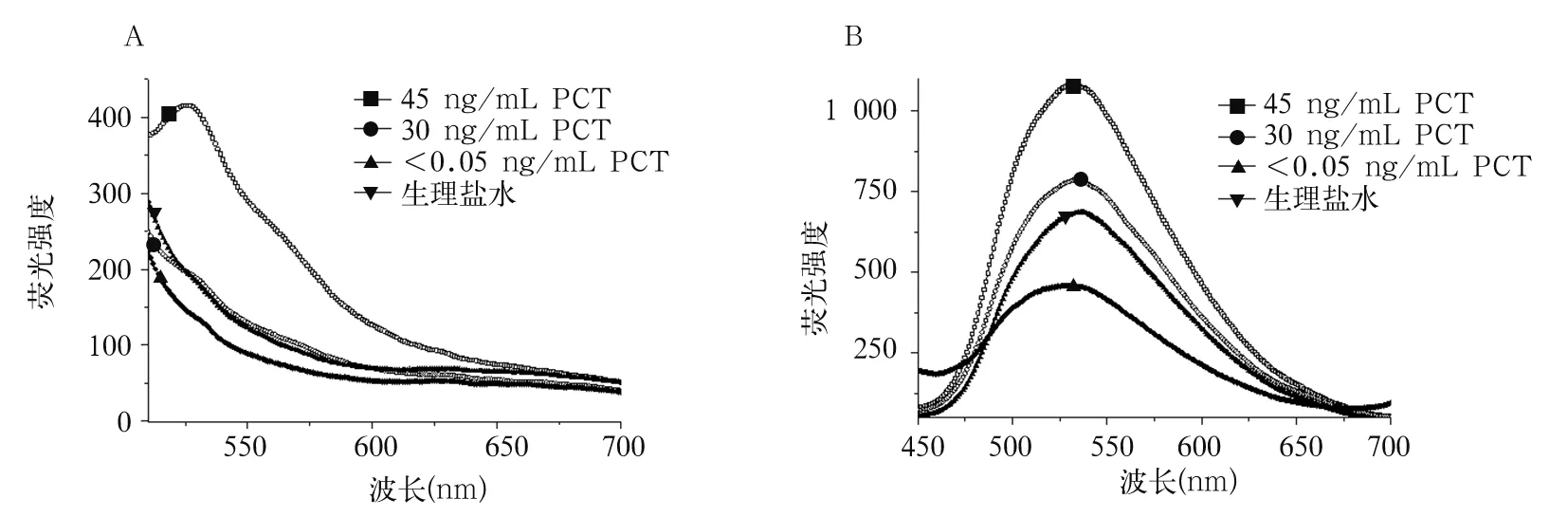
注:A為FM02法;B為CzP-BDT法。
3.1.3 發光效率 本研究結果顯示,BDTO化合物的發光效率普遍高于BDT化合物,提示噻吩環的氧化能夠有效提高化合物在溶液態及聚集態的發光效率。分析原因,氧化噻吩中的硫元素(S)被氧化以后,S上面的孤對電子會消失,降低單線態到三線態之間的系間竄躍,從而提高材料的量子產率;此外,氧化噻吩會有效提高π-π之間的距離,降低分子之間的相互作用,進一步提高發光效率[9]。本研究中,相對于其他7種化合物,TCzP-BDTO聚集態的發光效率最高,推測是由于叔丁基的引入會進一步降低分子間相互作用力,降低ACQ,從而提高固態發光量子效率。此外,CzP-BDT、TCzP-BDT和TCzP-BDTO聚集態的絕對量子產率高于溶液態,是因為隨著聚集體的形成,其分子內運動受限,從而有效抑制激發態能量以非輻射的形式耗散,提高了聚集態及固態發光效率,表現出明顯的AIE性能[10]。
3.1.4 在水中的聚集態行為 本研究結果顯示,除TCzP-BDT外,其他3種BDT化合物在水中的粒徑分布相差不大,說明TCzP的引入會大大增加化合物的疏水性,從而導致粒徑增加。本研究BDT化合物具有較大且規整的平面結構,能夠增加體系的電子離域能力,賦予體系良好的光學性能。推測是因為噻吩環的氧化引入了氧原子,有效增加了BDTO化合物與水的相互作用,從而提高了BDTO化合物在水溶液中的分散性和溶解性[11]。這為制備在水環境中具有良好分散性的發光材料提供了行之有效的策略。BDTO化合物能夠提高分子內吸電子能力,形成D-A型結構,導致最高占據軌道(HOMO)與最低空軌道(LUMO)分離,使其吸收及發射均向長波移動;并且氧化噻吩會進一步提高化合物在水溶液及生理環境下的分散性,且這類化合物在聚集態下具有較高的發光效率,使得該類材料在生物大分子檢測方面具有非常好的前景。
針對上述8種化合物的光物理性能分析結果, CzP-BDT在水中雖然分布不均,但其在低于100 nm部分有較多的分布;綜合其發光性能,CzP-BDT是一種典型的AIE材料,擁有較大的Stokes位移及良好的光穩定性,可用于制備穩定性好、粒徑小的納米材料用于生物檢測。因此,本研究選擇CzP-BDT作為代表,用于研究具有良好發光性能的AIE材料在生物大分子檢測中的應用。
3.2 血清PCT的免疫熒光檢測 熒光微球在生物醫學領域有著重要的應用價值,目前幾乎所有高性能、高附加值的熒光微球材料都被國外壟斷,我國熒光微球技術的發展處于一個滯后階段,開發具有自主知識產權且產業化的高性能熒光微球已迫在眉睫。AIE材料是一種由中國科學家原創的新型發光材料,具有固態發光效率高、光穩定性強和Stokes位移大等光學特性,將其應用于熒光微球制備的研究,有望獲得性能優異的功能性納米熒光材料[12]。
本研究結果顯示,兩種熒光材料的發射光譜非常相似,而CzP-BDT納米粒子的激發光波長比FM02熒光微球小,表明CzP-BDT納米粒子具有更大的Stokes位移。此外,相同濃度下熒光光譜分析顯示,相同條件下CzP-BDT納米粒子的熒光強度高于FM02,因此CzP-BDT納米粒子具有更高的量子效率,能有效提高檢測的信噪比和靈敏度。本研究結果顯示,相比FM02熒光微球,CzP-BDT納米粒子最高峰的熒光強度更高,說明CzP-BDT納米粒子的檢測分辨率更高;兩種方法均能檢出45 ng/mL的血清PCT,但對于30 ng/mL、<0.05 ng/mL的血清PCT,只有采用CzP-BDT納米粒子的熒光檢測方法能實現有效鑒別并與生理鹽水區分,說明CzP-BDT納米粒子具有更低的檢測限及更高的靈敏度。
綜上所述,本研究對BDT、BDTO分子結構修飾后篩選出高發光性能的CzP-BDT納米粒子,其應用于血清PCT免疫熒光檢測的靈敏度高于FM02熒光微球,有望應用于臨床生物分子的熒光檢測,為發展具有我國自主知識產權的新一代發光材料及發光檢測技術打下基礎。隨著未來對納米粒子合成技術的改進和載體與熒光物質作用機理的深入研究,該類新型功能性熒光微球在生物醫學領域可以得到進一步發展與應用。

