歐盟傳統草藥注冊制度對我國經典名方簡化注冊監管體系的啟示
葛文霞 錢欣誠 邵蓉


摘 要 目的:為完善我國經典名方簡化注冊制度監管體系的建設提供參考。方法:從監管機構、監管法規體系、簡化注冊條件、簡化注冊目錄、注冊資料要求等方面對歐盟傳統草藥和我國經典名方簡化注冊制度進行比較研究,并在歐盟傳統草藥簡化注冊制度的經驗基礎上,提出對完善我國經典名方簡化注冊制度的建議。結果與結論:歐盟設有專門的草藥藥品委員會進行注冊監管工作;建立了從指令到具體指南的完善的監管法規體系;注重傳統草藥的人用歷史和使用條件;發布了歐盟草藥專論和歐盟草藥目錄,并以此作為安全有效性依據,對注冊資料進行進一步減免。我國由國家藥品監督管理局與國家中醫藥管理局共同負責經典名方注冊監管工作,目前已經發布了簡化注冊審批的相關文件,但缺少相應的實施細則和指南。我國同樣重視經典名方的臨床使用經驗,并強調制備方法、劑型等與古代典籍的一致性。目前,我國已經發布了包括100個經典名方在內的《古代經典名方目錄(第一批)》,目錄內的經典名方注冊申報時可免除部分注冊資料。我國可以借鑒歐盟經驗,結合經典名方監管的實際情況建立專家委員會,以質量控制和風險管控為重心完善簡化注冊監管體系,優化經典名方遴選條件,探索制定經典名方專論,從而進一步激發我國中藥產業創新活力。
關鍵詞 歐盟;傳統草藥;注冊制度;經典名方;簡化注冊;啟示
ABSTRACT ? OBJECTIVE: To provide reference for improving the monitoring system of simplified registration system of Chinese classical formulas. METHODS: A comparative study was conducted on the simplified registration system of traditional herbal medicines in the European Union and Chinese classical formulas from the aspects of regulatory agencies, regulatory systems, simplified registration conditions, simplified registration catalogs and registration data. On the basis of the experience of the simplified registration system of traditional herbal medicines in the European Union, some suggestions were put forward to improve the simplified registration system of Chinese classical formulas. RESULTS & CONCLUSIONS: The European Union establishes special committee on traditional herbal medicine for registration and supervision; has established a complete regulatory system from directives to specific guidelines; focuses on the history and conditions of the use of traditional herbal medicine; has published the European Union monographs and European Union list, which are used as a basis for safety and effectiveness to further reduce or exempt registration data. In China, National Medical Products Administration and the National Administration of Traditional Chinese Medicine are jointly responsible for the registration and supervision of classical formulas. At present, the relevant documents to simplify the registration and approval have been issued, but there is no corresponding implementation rules and guidelines. China also attaches great importance to the clinical experience of classical formulas, and emphasizes the consistency of preparation methods and dosage forms with ancient classics. Recently, China has published the Catalogue of Ancient Classic Formula (the First Batch), including 100 classical formulas, and the classic formulas in the catalogue can be exempted from relevant registration materials when applying for registration. Our country can learn from the experience of the European Union and combine the actual situation of classic formulas supervision to establish an expert committee, focus on quality control and risk control to improve registration and supervision system, optimize the selection conditions of classic formulas, and explore the classic formulas monographs, to further stimulate the innovation vitality of traditional Chinese medicine industry.
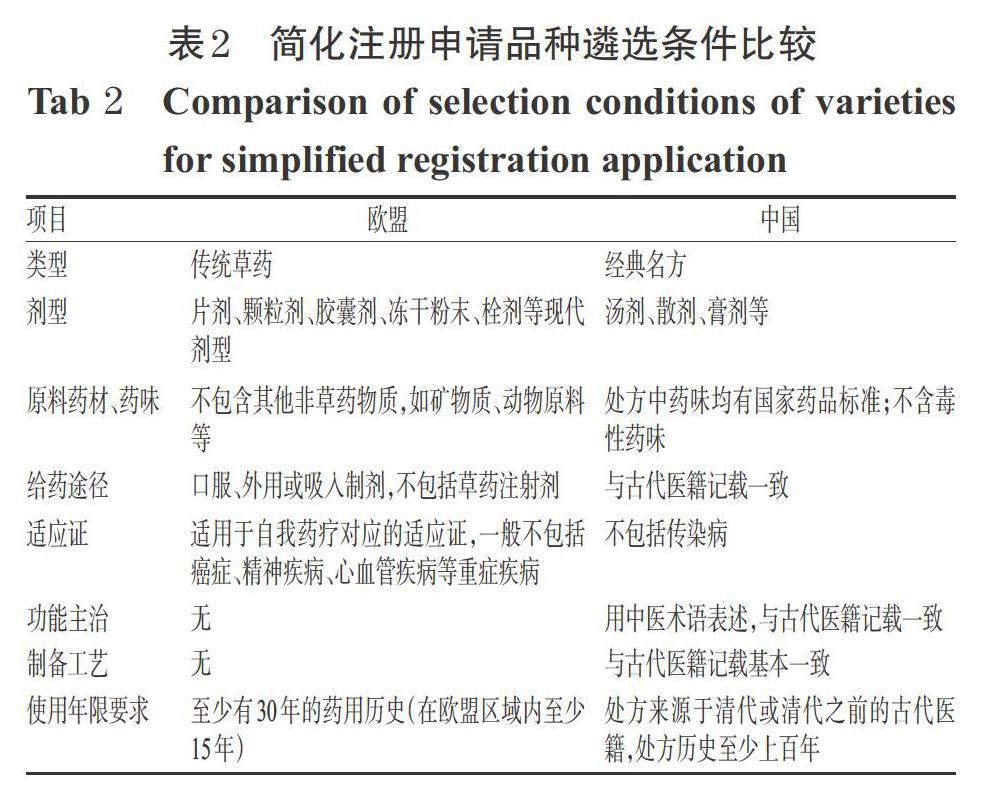
我國經典名方簡化注冊在劑型、給藥途徑、使用年限等方面也限定了相應條件。經典名方應當出自清代(1911年)或清代之前代表性的古醫籍或醫案選錄,具有廣泛應用、療效確切、特色明顯的特點,有較多的古代記載和現代文獻研究報道,并能得到專家認同且被中醫藥教材收錄[17]。實施簡化注冊審批的經典名方制劑品種必須符合“一有”“四不”“五一致”的要求:有國家藥品標準;不含配伍禁忌,不含毒性,不包括傳染病,不涉及特殊用藥人群;制備方法、劑型、給藥途徑、日用飲片量、功能主治與古代醫籍記載一致[18]。可見,我國經典名方同樣注重臨床應用,而適應證范圍相較歐盟更加廣泛。但是強調與古代醫籍的一致性問題值得進一步探討,如在功能主治上強調用中醫術語表述,可能導致醫師,尤其是西醫師對傳統術語的理解障礙,限制經典名方的臨床應用。此外,由于現代中藥材以人工培育為主,藥材品質可能發生變化,且古代度量衡制度幾經變化[19],強調日用飲片量與古代醫籍的一致性可能會影響中藥的安全性和有效性。歐盟與我國簡化注冊申請品種遴選條件比較見表2。
1.4 簡化注冊目錄
歐盟沒有出臺簡化注冊的草藥目錄,傳統草藥在滿足相應條件的情況下即可申請簡化注冊。但是,HMPC會針對臨床用草藥的所有安全性和有效性相關數據及資料進行科學評價,制定并發布EUM,其代表了歐盟技術評估機構對草藥制劑安全有效性的官方觀點,但不具備法律約束力[20]。一旦相應的草藥制定了EUM,該文件即可作為申報資料的組成部分,可供成員國在進行注冊審批時充分參考。HMPC每隔4年還會定期重新征集該種草藥產品的科學數據及資料,并基于此更新EUM內容。此外,歐盟委員會還會發布EULE,與同樣作為草藥安全有效性評估文件的EUM比較,EULE的區別在于其具有強制法律效力,成員國當局必須接受其作為安全有效性證據[21],因此EULE對安全有效性的評價會更為嚴格。截至2020年8月,歐盟已經發布了164個草藥專論,但僅有13個藥品進入EULE[22]。
我國的經典名方采用目錄制管理,《古代經典名方目錄(第一批)》是當前我國經典名方簡化注冊處方的全部來源,共收錄100個經典名方,其內容包括方名、出處、處方、制法及用法和劑型[23]。當前階段的目錄將可申請簡化注冊的經典名方范圍限制得較窄,而且該目錄與歐盟EUM和EULE不同的是,其僅作為經典名方簡化注冊的范圍限定,不具備對藥品安全性、有效性的技術指導意義。
1.5 注冊資料要求
無論是歐盟傳統草藥還是我國經典名方,簡化注冊的意義不在于注冊流程的減少,而是注冊資料的減免。
根據歐盟《傳統草藥注冊指令》規定,傳統草藥申請注冊上市可不必提供臨床試驗資料;在非臨床試驗資料方面,可減免藥理學、藥效學和藥動學研究資料[24]。此外,根據EMA于2019年2月發布的《傳統草藥銷售授權/注冊申請的非臨床文檔》相關規定,如果在有文獻資料可以充分證明藥品安全性或者基于長期應用和實踐使用經驗下,可不必提供單次給藥和重復給藥毒性、毒動學、免疫毒性以及局部耐受性試驗的技術資料;而關于生殖毒性、遺傳毒性和致癌性這3個部分的資料,如果提供的已發表文獻不適用或不足,則在必要情況下需附加相關試驗[25]。對于建立了EUM或EULE的傳統草藥,其注冊申報資料在簡化申請的基礎上可進一步減免,不必再提供該產品在其他國家被批準上市的證書或證明文件、歐盟范圍內15年的銷售記錄證明、安全性文獻綜述以及專家報告[26]。
我國對于符合簡化注冊審批要求的經典名方注冊申報資料同樣進行減免,申請者只需提交綜述資料、藥學資料以及非臨床研究資料,免除了臨床試驗研究資料及藥效學研究資料。其中藥學研究資料除藥材、飲片炮制外,還應包括經典名方物質基準。但是由于我國尚未出臺類似EUM或EULE的經典名方安全有效性評價官方文件,因此無法進一步減免注冊資料。歐盟與我國簡化注冊資料要求比較見表3。
2 歐盟傳統草藥簡化注冊制度對我國的啟示
2.1 建立經典名方專家委員會,加強部門間、政企間的溝通協調
歐盟在傳統草藥注冊監管中設立HMPC進行指南、目錄的制定,提出對草藥產品的評估意見,為各成員國藥品審批提供參考意見。特別的是,HMPC還會為草藥研發企業提供技術支持和科學建議。HMPC的建立充分保證了歐盟市場的協調統一,成為歐盟草藥監管強有力的技術支撐。而我國經典名方簡化注冊工作涉及國家藥品監督管理局和國家中醫藥管理局兩個部門,面臨著部門間溝通協調、政策銜接等矛盾,增加了經典名方簡化注冊監管工作的組織協調成本。因此,筆者建議由兩部門聯合成立國家經典名方專家委員會:一是對現階段經典名簡化注冊過程中涉及的具體問題,如藥材基源、中藥炮制、劑量轉換、藥學、安全性等進行專題研究,及時解答業界關于相關問題的困惑[27];二是制定經典名方從研發到上市后監管的系列技術指南文件,為經典名方監管提供技術支撐;三是作為技術指導為企業研發過程提供建議和技術支持,以此建立監管部門與企業的溝通協調機制,進一步提高經典名方的研發速度。
2.2 完善經典名方簡化注冊的監管法規體系,加強質量控制與風險管控
歐盟傳統草藥監管從綜合性法規到注冊申請程序、臨床研究、非臨床研究、質量控制等各環節形成了一套完善的簡化注冊監管體系。我國經典名方盡管已經出臺了目錄、注冊管理規定、申報資料等部分文件,但尚未有具體的指導措施和執行細則。建議可借鑒歐盟傳統草藥監管體系的經驗,綜合我國經典名方簡化注冊的要求,重點關注經典名方質量控制和上市后的風險管控問題:一是提高經典名方制劑質量標準要求,全方位開展“原料藥材-中間體-經典名方物質基準-經典名方成品制劑”質量概貌研究,確定其中關鍵質量屬性,以此出臺相應的質量標準指南性文件;二是在企業內部建立覆蓋原料藥材種植到最終經典名方成品制劑生產的全過程質量控制體系,并建立質量檢測反饋機制,對于任何檢測到的質量問題及時分析評估并解決,全面加強質量管理;三是加強不良反應監測,在說明書或包裝標簽等方面,嚴格規范不良反應、禁忌、注意事項等安全性信息說明,對于此類安全性信息可采取醒目顏色的字體進行標注,以此更好地指導臨床合理用藥。
2.3 優化經典名方遴選條件,評估與古代醫籍一致的合理性問題
歐盟對傳統草藥簡化注冊條件著重強調人用歷史、自我藥療和質量控制要求,沒有嚴格的范圍限制。而我國在《古代經典名方中藥復方制劑簡化注冊審批管理規定》中對符合經典名方簡化注冊的條件要求較為嚴苛,尤其是要求日用飲片量、功能主治與古代醫籍一致的合理性問題有待商榷。關于功能主治的中醫術語表述,可以在進行相關評估后考慮采用我國中成藥說明書方式,同時包括中西醫兩種術語說明,中醫術語說明作用、療效、適應證,西醫術語表明現代醫學下適用的具體病種,從而拓寬經典名方的臨床應用途徑。關于日用飲片量的一致性問題,建議一是在對古代度量衡變化研究的基礎上重新進行劑量折算,二是要對現代人工培育的中藥材藥性進行相應評估,分析不同時代和環境下中藥材藥味藥量的變化,確保日用飲片量設置的合理性[28]。
2.4 探索制定經典名方專論,提高審評效率
EUM和EULE作為歐盟最高技術審評機構對草藥安全有效性評估的官方文件[29],具有學術權威性,對傳統草藥的注冊管理、臨床使用指導具有重要意義。目前我國還未出臺關于中藥復方制劑,尤其是經典名方制劑安全性、有效性的官方或類官方指導性文件,而像《中華本草》等傳統中藥專著類書籍記載的內容雖詳細,但偏向臨床用藥指導方面,無法形成安全性、有效性的官方評價指南。建議根據經典名方上市后臨床使用情況,重點關注其中部分臨床優勢較為明顯、不良反應少、臨床安全性評價高的品種,對于此部分品種在經典名方目錄基礎上,參照EUM和EULE,探索形成“經典名方專論”的指南性文件,內容主要包括安全性、有效性評價信息,并在相關網站公示專論報告。在企業注冊申請時可將專論作為安全性、有效性的評價依據,并在原先基礎上進一步減免注冊申報資料,提高審評效率,提升企業研發的積極性。
3 結語
經典名方是中醫藥傳統文化的重要組成部分,有著上千年的人用經驗,在常見病、慢性病領域有著廣泛應用,或可一定程度彌補我國部分疾病治療藥物的空白,對維護人民健康有著重要意義。歐盟傳統草藥盡管與中藥在醫學理論、制備工藝等方面有著較大差別,但其簡化注冊制度的監管經驗對我國經典名方注冊制度的發展有著重要的參考價值。希望我國在經典名方注冊監管中充分吸取相關國際經驗,從監管部門、法規體系、經典名方遴選與注冊申報要求等方面進行完善,在保障安全有效性的同時實行簡化注冊,進一步激活我國中醫藥產業,推動中醫藥高質量發展,落實“健康中國”戰略。
參考文獻
[ 1 ] 中共中央辦公廳,國務院辦公廳.關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見[EB/OL].(2017- 10-08)[2020-08-01].http://www.gov.cn/xinwen/2017- 10/08/content_5230105.htm.
[ 2 ] 李浩,田侃,喻小勇,等.歐盟成員國植物藥產品審評現狀分析及啟示[J].中草藥,2016,47(24):4494-4498.
[ 3 ] 李秦川,陳永法.中藥復方和歐盟草藥復方臨床前安全性評價要求的比較研究[J].中國執業藥師,2011,8(11):30-32、39.
[ 4 ] 蘇芮,孫鵬,范吉平.中藥貿易相關的歐盟指令研究[J].環球中醫藥,2014,7(6):486-488.
[ 5 ] 黃宇虹,張伯禮. Directive 2001-83-EC關于傳統草藥的具體規定[J].中國新藥雜志,2011,20(7):587-589.
[ 6 ] 葉祖光,張陸勇.歐盟傳統草藥簡化申請指令述評[J].中國天然藥物,2006(3):238-240.
[ 7 ] 張鈺,沙康,吳正紅,等.中成藥歐盟注冊分析[J].世界中醫藥,2020,15(17):2660-2666.
[ 8 ] 湯依娜,鄒文俊,劉忠榮,等.歐盟草藥藥品管理機構及其職能[J].中國中醫藥信息雜志,2006,13(6):1-2、9.
[ 9 ] European Medicines Agency. Committee on Herbal Medi- cinal Products[EB/OL].(2020-05-18)[2020-08-01].https://www.ema.europa.eu/en/committees/committee- herbal-medicinal-products-hmpc.
[10] 李秦川,陳永法,潘勤.歐盟草藥和我國中藥注冊法規體系比較研究[J].中國執業藥師,2013,10(7):48-53.
[11] European Medicines Agency. Herbal medicines:regulatory and scientific support[EB/OL].(2018-09-17)[2020- 08-01]. https://www.ema.europa.eu/en/human-regulatory/herbal-products/herbal-medicines-regulatory-scientific- support.
[12] European Medicines Agency. Herbal medicinal products:scientific guidelines[EB/OL]. (2020-05-13) [2020-08- 01]. https://www.ema.europa.eu/en/human-regulatory/research-development/scientific-guidelines/multidisciplinary/ herbal-medicinal-products-scientific-guidelines.
[13] 國家中醫藥管理局.中藥注冊管理補充規定[EB/OL].(2008-01-09)[2020-08-01]. http://www.satcm.gov.cn/fajiansi/gongzuodongtai/2018-03-24/2286.html.
[14] 全國人民代表大會.中華人民共和國中醫藥法[EB/OL].(2016-12-25)[2020-08-01].http://www.npc.gov.cn/zgr- dw/npc/xinwen/2016-12/25/content_2004972.htm.
[15] 朱友平.歐盟植物藥注冊法規和質量技術要求和中藥國際化新藥開發[J].中國中藥雜志,2017,42(11):2187- 2192.
[16] 鄭文忠,鄧紅,林華慶,等.我國傳統中藥在歐盟簡易注冊分析[J].時珍國醫國藥,2013,24(8):2010-2013.
[17] 國家中醫藥管理局.關于對“古代經典名方目錄制定的遴選范圍和遴選原則”征求意見的通知[EB/OL].(2017- 03-08)[2020-08-01]. http://www.satcm.gov.cn/kejisi/zhengcewenjian/2018-03-24/3520.html.
[18] 國家藥品監督管理局. 關于發布古代經典名方中藥復方制劑簡化注冊審批管理規定的公告[EB/OL].(2018-05- 29)[2020-08-01]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20180601163901361.html.
[19] 顏文強.歷代中藥度量衡演變考論[J].老子學刊,2016(1):137-144.
[20] CHINOU I. Monographs,list entries,public statements[J]. J Ethnopharmacol,2014. DOI:10.1016/j.jep.2014.08.033.
[21] 瞿禮萍,張曉群,熊晏,等.歐盟傳統草藥藥品法規疑難問題解析[J].中國中藥雜志,2017,42(20):4040-4044.
[22] European Medicines Agency. European Union monogra- phs and list entries[EB/OL].(2020-05-13)[2020-08- 01]. https://www.ema.europa.eu/en/human-regulatory/her- bal-products/european-union-monographs-list-entries.
[23] 國家中醫藥管理局.關于發布《古代經典名方目錄(第一批)》的通知[EB/OL].(2018-04-13)[2020-08-01].http://kjs.satcm.gov.cn/zhengcewenjian/2018-04-16/7107.html.
[24] European Parliament and Council. Directive 2004/24/EC of the European parliament and of the Council of 31 March 2004 amending,as regards traditional herbal medicinal products,Directive 2001/83/EC on the Community code relating to medicinal products for human use[EB/OL].(2004-03-31)[2020-08-01]. https://eur-lex.europa.eu/legal-content/en/TXT/?uri=CELEX:32004L0024.
[25] European Medicines Agency. Guideline on non-clinical documentation in applications for marketing authorization / registration of well-established and traditional her- bal medicinal products[EB/OL].(2019-02-25) [2020-08- 01]. https://www.ema.europa.eu/en/documents/scientific- guideline/guideline-non-clinical-documentation-applications-marketing-authorisation/registration-well-established- traditional-herbal-medicinal-products-revision-1_en.pdf.
[26] 鄒文俊,瞿禮萍,葉祖光,等.歐盟傳統草藥專論述評[J].中國中藥雜志,2011,36(23):3386-3388.
[27] 楊洪軍,黃璐琦.經典名方的研發:中醫藥傳承發展的突破口之一[J].中國現代中藥,2018,20(7):775-779.
[28] 施錚,陳仁壽,李陸杰,等.經典名方研發的幾個關鍵問題芻議[J].南京中醫藥大學學報,2019,35(4):366-369.
[29] 瞿禮萍,曾潔,黃倩倩,等.歐盟草藥藥品監管模式對中國中藥注冊管理的啟示[J].世界科學技術:中醫藥現代化,2020,22(2):434-440.
(收稿日期:2020-08-13 修回日期:2020-10-02)
(編輯:劉明偉)

