皮膚填充物聯合局部熱療在乳腺癌改良根治術后放療中的效果探討
丁學鋒 李紅生 嚴曉花 溫鵬軍 謝洪霞 魏旭升
乳腺癌作為女性群體最為常見的一種惡性腫瘤,嚴重威脅廣大女性患者的身心健康。近年來,乳腺癌發病率仍逐年呈增長趨勢,目前全球范圍內約有130 萬左右乳腺癌患者,每年新發患者也在不斷增加[1]。研究表明,婦女乳腺癌在我國惡性腫瘤發病率中位居首位,并以每年3%~4%的速度遞增[2]。早期乳腺癌患者即使接受了手術及規范的治療,復發轉移率仍可高達30%~40%[3]。我國女性乳腺癌的發病年齡為45~54 歲,即為圍絕經期前后的婦女,比歐美國家要提前10 年左右[4],因此加強高危人群健康教育、及時診斷和干預尤為必要。目前,乳腺癌術后胸壁、區域淋巴結復發率較為常見,其中胸壁復發比例最高,是影響乳腺癌患者術后生存率的重要因素。根據循證醫學觀念,美國臨床腫瘤學會(ASCO)將乳腺癌術后胸壁放療作為A級證據推薦[5]。熱療是利用熱的生物效應進行腫瘤治療。研究表明,熱療對腫瘤具有直接殺傷作用,同時與放化療也均有很好的協同作用[6]。除此之外,局部熱療還具有安全可靠、價格低廉等的特點[7-9]。在乳腺癌放療過程中,為保證胸壁照射野輻射劑量的均勻與準確,常需要組織等效填充材料填充組織缺失處,或進行劑量補償。然而,目前對皮膚填充物的相關報道卻相當有限,對皮膚填充物的劑量、時間也尚無統一認知[10]。本文對2014 年2 月~2019 年2 月本院192 例乳腺癌患者的臨床資料進行分析,旨在探究皮膚填充物聯合局部熱療在乳腺癌患者改良根治術后放療中的應用效果,以此為乳腺癌患者選擇合理的治療模式、改善患者預后提供理論。
1 資料與方法
1.1 一般資料 收集2014 年2 月~2019 年2 月本院192 例行乳腺癌改良根治術的乳腺癌患者,年齡45~75 歲,平均年齡(52.84±8.72)歲;其中Ⅱ期83 例、Ⅲ期109 例。根據治療方案不同將患者分為對照組和觀察組,各96 例。對照組平均年齡(55.96±8.23)歲;其中Ⅱ期46 例、Ⅲ期50 例。觀察組平均年齡(56.14±7.83)歲;其中Ⅱ期48 例、Ⅲ期48 例。兩組患者一般資料比較差異無統計學意義(P>0.05),具有可比性。見表1。
表1 兩組患者的一般資料比較[,n(%)]

表1 兩組患者的一般資料比較[,n(%)]
注:兩組比較,P>0.05;Her-2:人表皮生長因子受體-2
1.2 納入及排除標準 納入標準:①所有患者符合乳腺癌診療指南標準[4];②僅患有單側乳腺腫瘤;③患者被診斷為原發性Ⅱ或Ⅲ期乳腺癌患者;④所有患者均經超聲、X 線乳房攝影及活檢確診;⑤符合放療指征,T3以上或腋窩淋巴結轉移≥4 枚;⑥手術前均簽署知情同意書。排除標準:①1 年之前接受過化療或放療者;②合并有其他嚴重心、腦、腎等內臟器官的功能障礙或嚴重并發癥者;③熱療處皮膚破潰者;④合并免疫系統疾病者;⑤資料不全者。
1.3 方法 兩組患者術后均行5 周的三維適形放療(3D-CRT)及局部熱療,放療每周5 次,2 Gy/次,放射劑量均為50 Gy。患者仰臥于三維適形治療專用的碳纖維板乳腺托架上,制作真空墊體位固定袋,用立體定向系統在CT 下定位,掃描層厚5 mm,掃描范圍包括整個胸部。模擬CT 圖像經網絡系統傳送至治療計劃系統(topslane venus),放療醫師進行靶區勾畫,物理師評估計劃并與醫生共同確認。模擬定位機下拍片驗證靶區位置后選用6MV-X 線,采用2 野照射。局部熱療每周進行2 次,60 min/次,熱療使用HG-2000 體外高頻熱療機(珠海和佳醫療設備有限公司),熱療溫度控制在42~43℃,根據患者舒適度適當調整。對照組患者放療時不使用皮膚填充物,觀察組患者放療時(2/3 程)使用皮膚填充物,厚度0.5 cm,材料為聚苯乙烯。
1.4 觀察指標及判定標準 對比兩組患者治療前后炎癥因子和腫瘤標記物水平,靶區平均劑量與均勻性指數,不良反應發生情況和復發轉移情況、生存情況。血清炎癥因子包括IL-2、IL-4、TNF-α。腫瘤標志物包括CEA、AFP、CA15-3。不良反應包括放射性肺損傷、放射性皮膚損傷、放射性心臟損傷。放射性損傷分級標準:乳腺癌患者放療皮膚反應程度按美國腫瘤放療協作組(RTOG)分級標準[11]。乳腺癌患者急性放射性肺損傷及心臟損傷均參照RTOG 分級標準[12]。靶區劑量使用RGD-3A 熱釋光劑量儀(北京康科洛電子有限公司產品)測定,計算平均劑量及劑量均勻性指數。對所有患者進行隨訪,隨訪截止時間2019 年12 月,記錄隨訪期間復發轉移及生存情況。繪制Kaplan-Meier 曲線分析兩組患者生存情況。復發情況包括胸壁局部復發、區域復發及遠處轉移。
1.5 統計學方法 采用SPSS22.0 統計學軟件進行數據統計分析。計量資料以均數±標準差()表示,采用t 檢驗;計數資料以率(%)表示,采用χ2檢驗;Kaplan-Meier 曲線分析兩組患者生存時間,生存差異的比較采用Log-rank 檢驗。P<0.05 表示差異具有統計學意義。
2 結果
2.1 兩組患者治療前后炎癥因子和腫瘤標記物水平比較 治療前,兩組L-2、IL-4、TNF-α 及CEA、AFP、CA15-3水平比較,差異無統計學意義(P>0.05);治療后,兩組IL-2、IL-4、TNF-α 水平均高于治療前,CEA、AFP、CA15-3 水平均低于治療前,差異有統計學意義(P<0.05);治療后,觀察組TNF-α 水平高于對照組,CEA、AFP、CA15-3 水平低于對照組,差異具有統計學意義(P<0.05)。見表2。
2.2 兩組患者靶區平均劑量與均勻性指數比較 觀察組靶區平均劑量高于對照組,均勻性指數低于對照組,差異具有統計學意義(P<0.05)。見表3。
2.3 兩組患者不良反應發生情況 及復發轉移情況比較 兩組放射性肺損傷、放射性皮膚損傷及放射性心臟損傷發生率比較,差異均無統計學意義(P>0.05)。見表4。隨訪期間,觀察組胸壁局部復發率及遠處轉移率均顯著低于對照組,差異有統計學意義(P<0.05),兩組區域復發率比較,差異無統計學意義(P>0.05)。見表5。
2.4 兩組患者生存情況比較 對照組死亡率為22.92%(22/96),平均生存期為(28.59±0.73)個月;觀察組死亡率為10.42%(10/96),平均生存期為(38.38±0.76)個月;觀察組死亡率明顯低于對照組,平均生存期長于對照組,差異有統計學意義(χ2/t=5.097、91.025,P<0.05)。見圖1。
表2 兩組患者治療前后炎癥因子和腫瘤標記物水平比較()
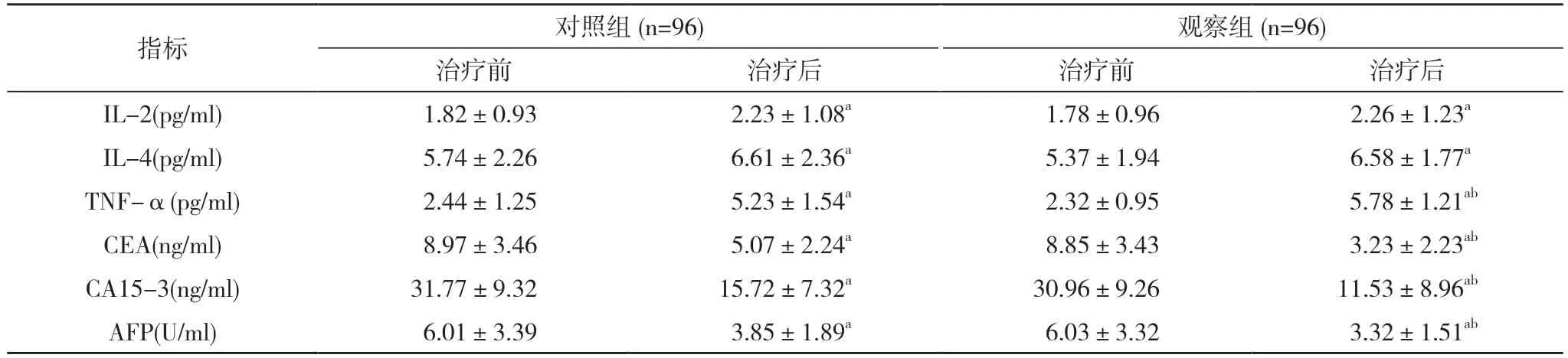
表2 兩組患者治療前后炎癥因子和腫瘤標記物水平比較()
注:與治療前比較,aP<0.05;與對照組比較,bP<0.05
表3 兩組患者靶區平均劑量與均勻性指數比較()

表3 兩組患者靶區平均劑量與均勻性指數比較()
注:與對照組比較,aP<0.05

表4 兩組患者不良反應發生情況比較[n(%)]
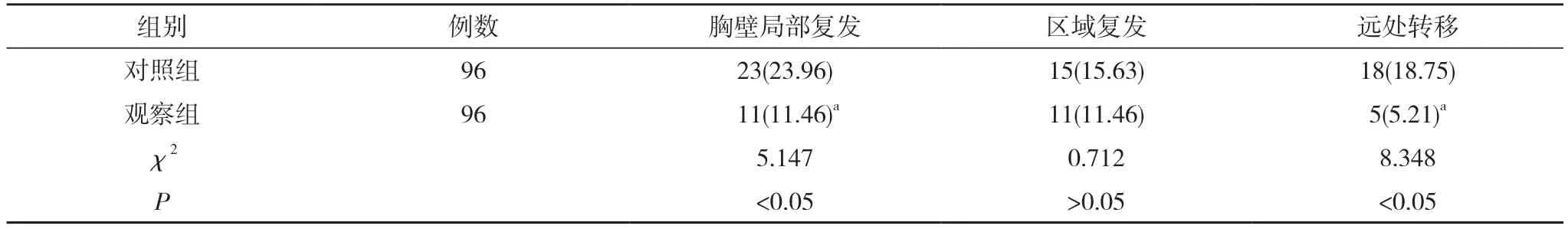
表5 兩組患者復發轉移情況比較[n(%)]

圖1 兩組乳腺癌患者Kaplan-Meier 生存曲線
3 討論
近年來,隨著社會工業化的加快以及空氣污染,我國乳腺癌發病率呈逐年上升趨勢,嚴重威脅著廣大婦女的身心健康。乳腺癌術后復發,尤其胸壁復發是乳腺癌治療失敗以及影響患者預后和生活質量的主要原因之一。作為一種全身性疾病,乳腺癌復發及預后的影響因素眾多,根據患者的具體情況選擇個體化治療方案尤為必要[13]。研究表明,胸壁放療可有效降低局部復發率,消滅殘存的病灶;也可有效降低術后隱匿病灶遠處轉移,從而提高生存率[14]。目前,國際上雖對乳腺癌術后放療治療已達成了共識,但對適應證、部位及技術仍有爭議[15]。乳腺癌改良根治術后胸壁放療照射技術如單純電子線照射、電子線混合線照以及3D-CRT 調強放療(IMRT)等仍無統一標準,若表面不加等效填充物以上照射技術均無法滿足皮膚劑量的要求[16]。然而,世界范圍內使用皮膚填充物的認知和使用率也差別很大,美國、澳大利亞、法國、意大利醫生皮膚填充物使用率分別有 82%、65%、8%、2%,而我國改良根治術后放療填充物使用率也從2014 年的35.4%下降到19.3%[17,18]。關于皮膚填充物對放療效果的影響鮮有報道。
本研究對乳腺癌改良根治術的乳腺癌患者采用3D-CRT 照射技術聯合局部熱療,分析乳腺癌患者有無使用皮膚填充物的臨床療效及長期預后。對照組放療過程未使用皮膚填充物,觀察組放療過程使用皮膚填充物。鑒于胸壁形狀不規則、厚薄不均,使用皮膚填充物可有效降低劑量建成效應,提高皮膚和瘢痕區劑量,本研究中觀察組患者全程統一使用0.5 cm 填充物提高表面劑量。相關研究中從劑量學證實了填充物的有效性,填充物厚度大致0.3~3.0 cm 不等,未加填充、0.5 cm 填充、1.0 cm 填充3 種情況下均表面劑量分別為處方劑量的65%、97%、103%[19,20]。眾多研究表明,使用填充物雖可提高皮膚表面劑量,但在一定程度上加重了皮膚反應。本研究中,對放療后的不良反應進行了統計,結果表明,兩組患者放射性肺損傷、放射性皮膚損傷、放射性心臟損傷發生率比較差異無統計學意義(P>0.05),這與陳軍剛等[21]的研究一致。不同的是,相關研究為放療后半程加1.0 cm 皮膚填充物,復發反應兩組間也無區別。本研究中,隨訪期間,觀察組胸壁局部復發率及遠處轉移率均顯著低于對照組,差異有統計學意義(P<0.05);而遠處轉移的患者很大一部分來自胸壁局部復發的患者。分析其原因,一方面是2/3 程使用0.5 cm 皮膚填充物,兩組患者還均給予了局部熱療。觀察組靶區平均劑量高于對照組,均勻性指數低于對照組,差異具有統計學意義(P<0.05)。另一方面也可能是納入的患者不同導致的結果,來本院就診的均為酒泉當地患者,也可能與當地生活習慣密切相關,這也是下一步研究的方向。楊思原等[22]的研究表明,胸壁表面墊0.5 cm 厚的等效填充物既可使靶區劑量分布更加均勻,又進一步降低了心肺的受照劑量,也有力的支持了作者的結論。結果提示乳腺癌術后皮膚填充物聯合熱放療不增加不良反應,且復發率低;胸壁局部復發的患者仍要關注身體變化預防遠處轉移。
在抗腫瘤過程中血清炎癥因子IL-2、IL-4、TNF-α 發揮著巨大的作用[23]。研究表明,熱療與低劑量輻射均能改善乳腺癌患者免疫功能,調節炎癥因子水平[24]。本研究結果表明,治療后,兩組IL-2、IL-4、TNF-α 水平均高于治療前,CEA、AFP、CA15-3 水平均低于治療前,差異有統計學意義(P<0.05);治療后,觀察組TNF-α 水平高于對照組,CEA、AFP、CA15-3 水平低于對照組,差異具有統計學意義(P<0.05)。結果提示皮膚填充物聯合熱放療可明顯改善乳腺癌患者炎癥因子水平,具有較好的抗腫瘤效果,而皮膚填充物具有增強效應,具體機制有待進一步研究。本次研究為臨床應用皮膚填充物聯合熱放療治療乳腺癌提供了理論依據。此外,還分析了隨訪期間兩組患者的生存率,結果表明,觀察組死亡率明顯低于對照組,平均生存期長于對照組,差異有統計學意義(P<0.05)。具體機制仍需進一步探索。雖然本研究填補了術后乳腺癌患者皮膚填充物聯合熱放療的空白,仍有很大局限性。本研究為單中心研究、未對比不同皮膚填充物的厚度、時間限定、不同熱療時間對療效的影響,這也是今后的研究方向。
總之,皮膚填充物聯合局部熱療在乳腺癌患者改良根治術后放療中具有較好的療效,靶區平均劑量高,分布更加均勻,可有效改善炎癥因子和腫瘤標記物水平,長期隨訪復發轉移率和死亡率低,值得臨床推廣。

