基于超支化聚醚的納米級超聲造影劑
李 婕, 黃 平, 王 琮, 楊少玲, 周永豐
(1. 上海交通大學化學化工學院,金屬基復合材料國家重點實驗室,上海 200240;2. 上海交通大學附屬第六人民醫院南院,上海 201499)
超聲成像[1-2]由于其無創性、低輻射、實時監測以及經濟實惠的優點被廣泛應用于器官、肌肉或者血流體系的檢查診斷中。超聲造影劑(UCA)[3]作為一種可以顯著增強超聲信號的試劑對于輔助超聲成像進行精準診斷具有重要的意義。典型的UCA 是一種由不同種類的殼材料包裹氣體形成的微氣泡,氣體是一種很強的聲波散射體,所以導致UCA 與周圍組織的聲阻抗值差異很大,表現在圖像上為超聲波回聲信號的增強,圖像對比度的增加。UCA 在器官內部結構的顯影成像和血流動力學的評估等領域[4]廣泛應用,如心腔中心內膜邊緣的增強成像[5]、心肌組織血流灌注的實時顯示[6]以及新生微血管生成的檢測診斷[7]等。
腫瘤組織在生長期間需要大量的新生血管來為快速分裂的細胞提供營養,腫瘤血管和正常血管的差異在于其血管內皮間隙會擴張增大,在血管壁上形成380~780 nm 的小孔[8]。常規的UCA 尺寸一般為微米級(2~8 μm),例如臨床上最常用的造影劑Sonovue,由于尺寸的限制,其不能滲透腫瘤組織的脈管系統到達相應的靶點發揮診斷或治療的功效。因此,開發出一種可以滲透到腫瘤組織血管間隙的納米級UCA 具有十分重要的意義。近年來人們開發出了一系列不同種類的納米級UCA,并將其應用于腫瘤組織的成像和治療中[9-12],其中基于磷脂分子的納米級UCA 因其較好的造影性能和良好的生物相容性得到了廣泛應用。Yin等[9]使用薄膜水化-聲振空化法、通過離心后處理得到了尺寸為(381.7 ± 36.9) nm的納米級磷脂UCA,并將其作為載體負載藥物分子到達腫瘤部位,結合低頻超聲有效地抑制了腫瘤的生長。Zhou 等[10]使用薄膜水化-機械振蕩法制備了磷脂UCA 微泡,靜置分離得到了尺寸為(635.5 ± 25.4) nm 的納米級造影劑,并將其運用到腫瘤靶向診斷中。然而,大多數基于磷脂小分子制備的UCA 尺寸分布由微米級到納米級不等,需要通過重力作用[10]、離心[8,9,13]、過濾[14]等方法來梯度分離大尺寸的微米級氣泡和小尺寸的納米級氣泡,步驟復雜,產率較低。此外,由于受限于小分子特性,磷脂類UCA 的穩定性不佳,難以滿足需求。因此,迫切需要開發出一類制備簡單、穩定性好、造影性能優良的納米級UCA。
超支化聚合物具有優異的自組裝行為,可以形成包括管、囊泡在內的多種形態的組裝體[15-17],且組裝形貌易于調控。超支化聚合物因其組裝形貌多樣化、官能團豐富易修飾等優點在生物醫學領域具有廣泛的應用[18],如藥物輸送[19]、生物成像[20,21]、基因轉染[22]等。本文使用以超支化聚3-乙基-3-羥甲基環氧丁烷(HBPO)為疏水核,聚乙二醇(PEO)為親水性鏈段的雙親性超支化聚醚(HSP)作為殼材料制備了一系列UCA。HSP 由疏水的超支化聚醚核HBPO 和親水的PEO 臂組成。本文利用HBPO 核的疏水作用,制備了內部填充六氟化硫(SF6)氣體,外部包裹著HSP 的超聲造影劑(HSP-UCA)。通過改變PEO 鏈段的長度,HSP 可以在水中組裝成尺寸從100 nm 到100 μm 不等的囊泡[18],因此同樣地可以通過改變PEO 鏈段長度來控制HSP-UCA 的尺寸。當PEO 的臂長為10 時,HSP-UCA 尺寸為517.3 nm,造影劑懸液中SF6體積分數為9.12 × 10-3,體外超聲半衰期為3~5 min,且穩定性和濃度都較高。所得的納米級HSP10-UCA 經兔耳緣靜脈注射后可在心臟內觀察到較好的灌注效果,表明其具有良好的造影效果。
1 實驗部分
1.1 原料和試劑
三羥甲基丙烷(TMP):純度99%,北京百靈威科技有限公司;碳酸二乙酯(DEC):純度99%,Adamas 試劑公司;三氟化硼乙醚絡合物(BF3·OEt2):w(BF3) = 48%,Adamas 試劑公司;碳酸鉀(K2CO3):純度>99%,Greagent 試劑公司;環氧乙烷(EO):純度>99%,Adamas 試劑公司;六氟化硫(SF6)氣體:純度99.9%,上海偉創標準氣體有限公司;無水乙醇、二氯甲烷等有機溶劑均購自國藥化學試劑有限公司;磷酸緩沖液(PBS):購自生工生物工程(上海)股份有限公司(pH 7.4)。沒有特別說明的生物化學品,未經處理直接使用。
1.2 測試與表征
核磁共振波譜儀(德國布魯克公司AVANCE Ⅲ HD 型400MHz):取10 mg 樣品溶于0.5 mL 氘代二甲基亞砜(DMSO)中進行一維氫譜測試;透射電子顯微鏡(美國FEI 公司Talos F200X 型):用移液槍取10 μL 造影劑溶液(0.5 mg/mL)滴于銅網上,室溫下自然干燥后進行測試;凝膠滲透色譜儀(日本東曹株式會社HLC-8320GPC 型):取10 mg 樣品溶于2 mL 二甲基甲酰胺(DMF)中測試,以DMF 為流動相,流速為0.6 mL/min,標樣為PEO;動態光散射儀(英國 Malvern 公司ZS90 型)。
1.3 HSP 的合成
HSP 的合成參考文獻[15, 23]。首先在500 mL 三頸燒瓶中裝上恒壓滴液漏斗,加料前反復抽真空和通氮氣,明火烘烤以除盡水分和空氣。然后將3-乙基-3 羥甲基環氧丁烷(EHO)單體(11.6 mL, 0.1 mol)置于恒壓滴液漏斗中,將約100 mL 干燥的CH2Cl2通過膠管連接口注射到燒瓶中,待反應體系溫度降到0 ℃后,將6.4 mL BF3·OEt2(0.05 mol)注射到溶液中,然后快速滴加EHO 單體。在0 ℃以下,強烈攪拌下反應24 h。隨后將1 mol EO 單體加入到恒壓漏斗中,并快速滴加到上述反應體系中,繼續反應24 h 后加入水終止反應,粗產物采用正己烷沉淀后再用水透析,冷凍干燥后得到無色黏稠狀HSP。通過控制EO 的量(0.3,0.5,1.0 mol)分別合成了PEO 臂長為3,5,10 的HSP,分別命名為HSP3、HSP5、HSP10。
1.4 HSP-UCA 的制備
采用聲振空化法,首先取200 mg 不同臂長的HSP 加入到10 mL PBS 中,攪拌使其溶解自組裝形成雙分子層,在向溶液中通入2 min 的SF6氣體(10 mL/min)后,邊使用超聲破碎儀施加強超聲邊通入SF6氣體,在強超聲作用下水中會形成較多的負壓核,SF6氣體會在這個過程中被包裹到其中,此時氣液界面存在著很強的界面張力,雙親性大分子HSP 解離擴散到氣液界面來穩定氣液界面,形成由超支化聚合物包裹SF6氣體的單層氣泡。使用超聲破碎儀以最大輸出功率超聲3 min,得到乳白色HSP-UCA 懸液,靜置后上層為不穩定氣泡,下層為HSP-UCA。其中,HSP10-UCA 的尺寸為517.3 nm。本文主要針對HSP10-UCA 進行性能及超聲成像研究。
1.5 GC-MS 定性定量測定HSP10-UCA 中SF6 的氣體體積分數
通過氣相色譜-質譜聯用儀(GC-MS,美國Agilent 7890A-5975C 型)來定性、定量測定HSP10-UCA 懸液中SF6氣體濃度。選用GC-MS 的選擇離子監測模式(SIM)測定微泡中氣體的成分,通過繪制SF6氣體標準曲線測定微泡懸液中SF6的體積分數。首先采用N2作為稀釋氣體配制一系列體積分數梯度的SF6標準氣體(5 ×10-3,10 × 10-3,20 × 10-3,30 × 10-3,100 × 10-3)繪制標準曲線。吸取1 mL 待測微泡樣品加入到20 mL 頂空瓶中,超聲處理30 min 后加熱至70 ℃,保持3 h 使微泡破裂完全釋放出SF6氣體后,吸取一定體積的氣體進樣,根據流出曲線峰面積計算得到SF6氣體的體積分數。
1.6 HSP10-UCA 體外超聲成像效果評價
使用多模式小動物超聲/光聲成像系統(美國Fujifilm VisualSonics VEVO LAZR-X 型)進行納米級HSP10-UCA 體外超聲成像測試,采集MX550S 探頭在B 模式下的圖像,頻率為40 MHz,增益值為30 dB。首先將脫氣水加入到立方體水槽中,將超聲探頭浸沒于液面下捕獲圖像作為空白對照。隨后將HSP10-UCA 依次加入加到水槽中,按照同樣的方法捕獲圖像,每個樣品至少采集3 張圖片,為了觀察樣品體外超聲穩定性,本文采集了其在連續的超聲輻照下不同時間點(0,3,5,10,20,30 min)的超聲圖像。
1.7 HSP10-UCA 體內超聲成像效果評價
納米級HSP10-UCA 體內超聲成像測試使用超聲成像儀(美國GE VividE9 型)的9L 探頭進行,超聲探頭頻率為3 MHz,機械指數MI = 0.15,在Contrast 模式下進行圖像采集,所有的圖像采集均采用如上相同的參數。選用新西蘭大白兔(約2.5 kg)為實驗動物模型,用w = 10%的水合氯醛麻醉劑(3~3.5 mL/kg)腹腔注射麻醉兔子后固定在兔床上,剃去心臟部位的兔毛后通過耳緣靜脈建立外周靜脈通道。首先對沒有注射HSP10-UCA 之前的兔心臟進行超聲檢查,記錄初始狀態的空白圖像,接著注射1 mL HSP10-UCA 懸浮液并立即用1 mL生理鹽水沖洗試管,觀察HSP10-UCA 在心臟內的灌注情況。
2 結果與討論
2.1 不同PEO 臂長的HSP 的合成及表征
超支化聚醚HSP 的合成路線如圖1 所示,通過兩步陽離子開環聚合得到了HSP。圖2 是HSP 的1H-NMR譜圖,從圖中可以看出,化學位移在0.8 處的峰(峰a)對應于HBPO 核中―CH2―CH3中甲基的質子峰,1.3 處的峰(峰b)對應于HBPO 核中―CH2―CH3中亞甲基的質子峰,3.1 處的峰(峰c)對應于HBPO 核主鏈中―CH2―O―CH2-亞甲基的質子峰,3.4(峰d)處的峰對應于HBPO 核中―CH2―OH 中亞甲基的質子峰,3.5~3.8 的峰(峰e, f, g)對應于PEO 親水段中和醚氧相連的―O―CH2―上亞甲基的質子峰。通過PEO 鏈段中亞甲基峰的峰面積和HBPO 中甲基峰面積的比值計算得到超支化聚合物的臂長(RA/C),根據文獻[15]計算得到圖2 中HSP 共聚物樣品的RA/C= 10。通過改變EO 的加入量可得到不同RA/C的HSP 樣品,所得結果列于表1 中。
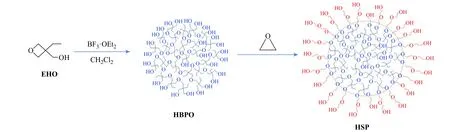
圖 1 超支化聚醚HSP 的合成路線Fig. 1 Synthetic route of hyperbranched polyether
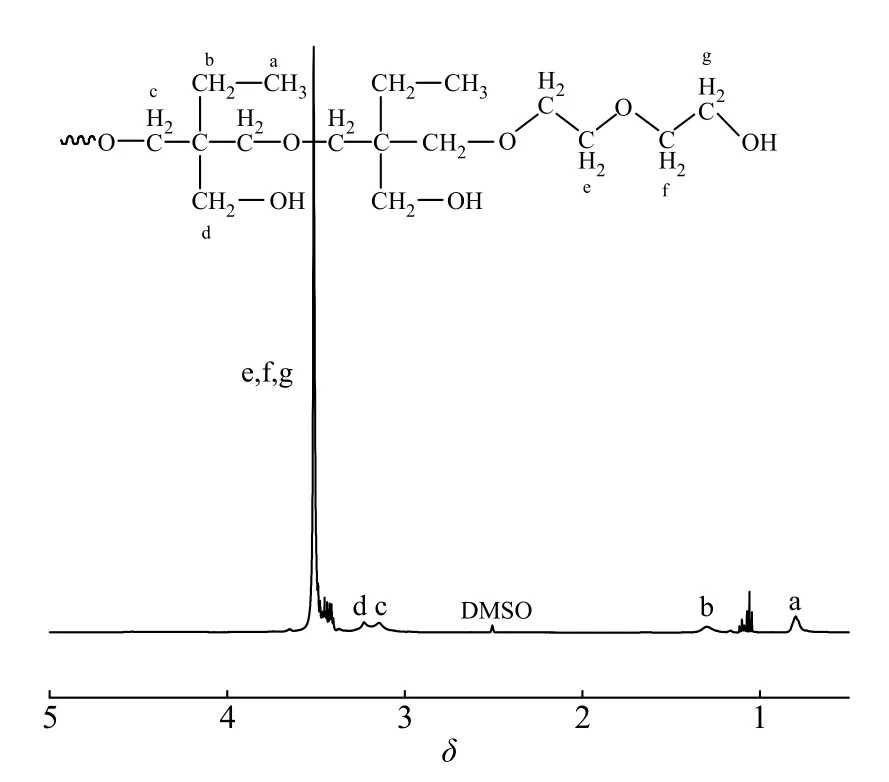
圖 2 HSP 的1H-NMR 譜圖Fig. 2 1H-NMR spectrum of HSP

表 1 HSP 樣品的表征Table 1 Characterizations of HSP samples
2.2 HSP-UCA 體外造影效果評價
圖3 為純水和不同PEO 臂長的HSP-UCA 的體外超聲造影圖。從圖中可以看出隨著PEO 臂長的增長,HSP-UCA 造影劑濃度逐漸增加。HSP3-UCA 造影劑濃度較低,視野中只可見到為數不多的造影劑,說明該造影劑穩定性較差。HSP10-UCA 造影劑濃度最高,視野中可見密集的造影劑,穩定性較好。推測臂長對造影劑穩定性的影響和對囊泡穩定性影響相似,PEO 親水鏈段越長,其在水中形成的水合層越致密,造影劑在水中的穩定性也越好。
2.3 HSP10-UCA 粒徑、形貌的表征

圖 3 HSP-UCA 的體外超聲造影圖Fig. 3 in vitro Ultrasound images of HSP-UCA
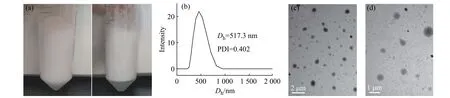
圖 4 HSP10-UCA 的宏觀照片(a),DLS 曲線(b)和TEM 圖(c,d)Fig. 4 Photos (a), DLS curve (b) and TEM images (c, d) of HSP10-UCA
圖4 為HSP10-UCA 的宏觀照片,DLS 曲線和TEM 圖。如圖4(a)所示,微泡懸液為乳白色,靜置后上層為不穩定氣泡,下層為納米級造影劑。DLS 測定出該造影劑的平均粒徑為517.3 nm,如圖4(b)所示,與圖4(c,d)的TEM 結果相吻合,從TEM 圖中可以看出造影劑的粒徑均在500 nm 左右,證明本文成功地制備了納米級HSP10-UCA。
2.4 HSP10-UCA 的體外造影效果評價
圖5 為HSP10-UCA 的體外造影效果隨時間衰減的圖像。由于造影效果和造影劑的粒徑成正比,所以從圖中可以看到相較于一般的微米級UCA,納米級HSP10-UCA 體外造影圖像的超聲信號強度要稍微弱一些。當體外超聲時間為3 min 時,還有較多肉眼可見的造影劑存在;當超聲時間達到5 min 時,造影劑數量大幅減少,由此可推測體外造影的半衰期大約為3~5 min;當體外超聲時間達到30 min 時,造影劑幾乎全部破裂。

圖 5 HSP10-UCA 體外造影的時間衰減圖像Fig. 5 in vitro Ultrasound images of HSP10-UCA for different durations
2.5 HSP10-UCA 的體內造影效果評價
圖6 為HSP10-UCA 在兔心臟內的超聲造影圖。從圖6(a)可見,在注射HSP10-UCA 之前,心臟內部的回聲信號值很低,其內部的結構也無法通過超聲成像觀察到,當靜脈注射HSP10-UCA 納米級超聲造影劑之后,心臟迅速得到了灌注,可見其內部的房室結構,平均造影時長為50~60 s,表明HSP10-UCA 具備一定的體內造影成像的能力。使用GC-MS 測定了造影劑中SF6氣體濃度,SIM 模式下可捕獲樣品較強的吸收峰,表明了造影劑中包覆了一定量的SF6氣體,將峰面積代入SF6標準曲線(y = 153 942.111 87x - 1.13 × 106,R2=0.994 46)中,計算得到造影劑懸液中SF6氣體的體積分數為9.12 × 10-3。
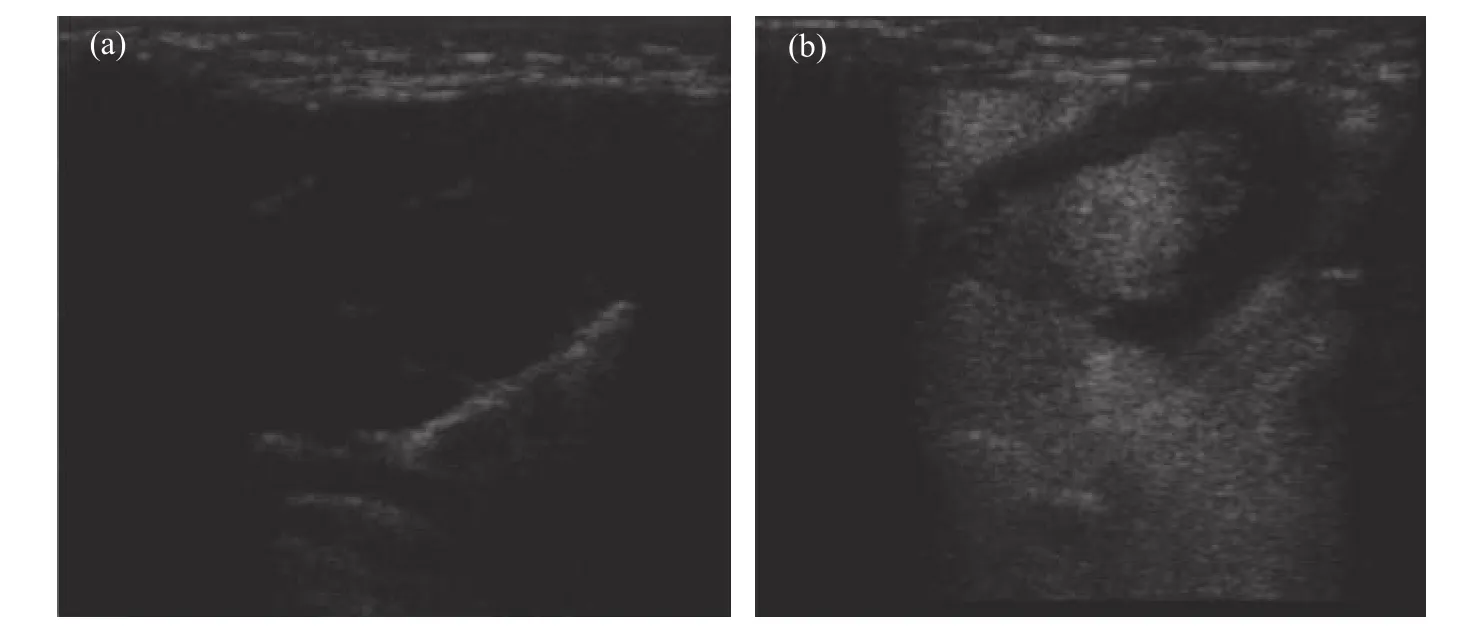
圖 6 兔心臟在注射HSP10-UCA 納米級超聲造影劑之前(a)和之后(b)的超聲圖像Fig. 6 in vivo Ultrasound images of rabbit heart before (a) and after (b) HSP10-UCA injection
3 結 論
(1)合成了不同PEO 臂長的超支化聚合物HSP,隨著PEO 鏈的增長,造影劑的穩定性逐漸增加,濃度也逐漸增加。
(2)HSP10-UCA 平均粒徑為517.3 nm,SF6氣體的體積分數9.12 × 10-3,其體外超聲造影半衰期為3~5 min,兔心臟超聲造影平均造影時間50~60 s,組織灌注效果良好。

