德國小蠊Bla g 5基因表達、純化及生物信息學分析
季樹宇,歐陽春艷,曹 會,鐘永浩,楊禮騰,劉曉宇
德國小蠊,屬蜚蠊目姬蠊科,為蜚蠊目中分布最為廣泛、與人類生活最為密切的一類醫學昆蟲,廣泛分布于全球熱帶、亞熱帶、溫帶中低海拔濕潤地區[1],在我國大部分省市均有廣泛分布。其排泄物、分泌物、尸體及皮蛻通過吸入途徑可引起I型超敏反應,進而誘發過敏性哮喘、過敏性鼻炎和過敏性皮炎等疾病[2-3],據季文霞等人的調查顯示四川綿陽地區吸入性過敏原陽性結果前五位的分別是蟑螂、粉塵螨、屋塵螨、藜、大豚草[4],由此可見,蟑螂為重要吸入性過敏原疾病之一,其陽性率高達42.2%。李春林等人在海南對500例過敏性疾病患者,采用皮膚點刺試驗及鼻黏膜激發試驗,其中皮膚點刺試驗陽性率為66.20%,而鼻黏膜激發試驗陽性率為100%[5]。國內對德國小蠊過敏原Bla g 5尚未見報道,故本研究通過基因重組技術將德國小蠊主要過敏原Bla g 5基因導入大腸桿菌,通過純化最終得到純度較高的重組蛋白,為臨床診斷過敏性疾病試劑研發、精準脫敏治療提供實驗依據。
1 材料與方法
1.1 材料、試劑、儀器
1.1.1表達載體與菌種E.coli感受態細胞Rosetta(DE3)及載體pET-32a(+)均由深圳大學醫學院過敏反應與免疫學研究所保存。
1.1.2血清 過敏患者由深圳市龍崗耳鼻喉醫院提供,血清采集均獲得供血者知情同意。對20 例過敏性哮喘和過敏性鼻炎患者行靜脈穿刺,采血 5 mL,分裝后低溫-80℃保存。
1.1.3主要試劑 限制性核酸內切酶BamHI、XhoI,Taq DNA聚合酶,T4 DNA連接酶均購自日本TaKaRa 公司;Ni-NTA柱填料購自廣州佰路生物科技有限公司;辣根過氧化物酶(HRP)標記小鼠抗人IgE Fc端二抗購自深圳市華爾康生物科技有限公司。
1.1.4主要儀器材料 體視顯微鏡購自深圳市富途銳科技有限公司;超凈工作臺購自新加坡藝思高科技有限公司;低溫高速離心機購自德國Eppendorf公司;水流抽氣泵購自日本東京理化;PCR儀,蛋白純化儀均購自美國BIO-RAD公司;超聲波破碎儀購自美國Sonics公司;低溫搖床購自上海智城分析儀器制造有限公司;凝膠成像系統購自廣州迅益生物科技有限公司。
1.2 實驗方法
1.2.1德國小蠊總RNA提取 取本實驗室飼養的德國小蠊20 只(成蟲), 液氮中均勻研磨蟲體后,用Qiagen 公司試劑盒進行總 RNA 的提取。
1.2.2設計引物 從UniProt導出Bla g 5序列(登錄ID為O18598)利用Primer Premier設計上、下游引物,使引物退火溫度在50 ℃~70 ℃之間,且上下引物間退火溫度不超過5 ℃,引物設計完成后交托上海生工生物技術股份有限公司進行合成。
1.2.3對目的基因進行RT-PCR擴增 以德國小蠊總RNA為模板進行逆轉錄合成cDNA,以cDNA為模板進行目標基因擴增,PCR擴增體系為:ddH2O 11.78 μL、25 mmol/L MgCl21.4 μL、25 μmol/L dNTP 0.16 μL、5 U/L Taq polymerase 0.16 μL、2 μmol/L primer 2.5 μL、40 ng/μL cDNA 2 μL、10X PCR buffer 2 μL;擴增條件:為94 ℃預變性3 min、94 ℃變性1 min、60 ℃退火1 min、72 ℃延伸1.5 min,循環35次,最后一次72 ℃延長至10 min,瓊脂糖凝膠電泳鑒定PCR產物,并將少量PCR產物送至上海生工生物技術股份有限公司進行測序。
1.2.4基因表達載體構建 將序列正確的PCR產物與pET-28a(+)載體進行HindIII和XhoI雙酶切,通過T4連接酶催化DNA 5′-P末端與3′-OH末端之間的磷酸二酯鍵結合,成功構建基因表達載體,以CaCl2法將載體轉入感受態細胞Rosetta(DE3),以含卡那霉素的LB平板培養質粒轉化后的大腸桿菌,用無菌牙簽挑取單克隆菌落接種至5 mL LB培養基中,經37 ℃、200 r/min培養至對數生長期,離心集菌后提取質粒,經雙酶切鑒定該載體是否正確連接目的基因。
1.2.5利用重組大腸桿菌表達目的蛋白 將成功轉入目的基因的大腸桿菌為工程菌進一步擴大培養,以IPTG(異丙基-β-D-硫代半乳糖苷)在37 ℃誘導4 h以及在16 ℃環境下誘導12 h,誘導完成后在低溫4 ℃條件下以10 000 r/min速度離心并收集菌體,加入磷酸鹽緩沖液(Phosphate Buffered Saline)重懸,超聲破碎儀進行破碎,超聲破碎所得菌液進行低溫超速離心10 000 r/min 30 min,傾倒法分離上清與沉淀,分別取誘導前全菌重懸液、低溫誘導上清、低溫誘導沉淀重懸液、高溫誘導上清、高溫誘導沉淀重懸液60 μL,分別各自加入20 μL 4x loading buffer,99 ℃恒溫水浴鍋加熱9 min,經短暫離心后取5 μL樣品進行聚乙烯酰胺凝膠電泳(SDS-PAGE),電泳完畢后立即用考馬斯亮藍R-250(Coomassie brilliant blue R-250),凝膠成像儀中觀察。
1.2.6金屬螯合離子層析法純化目的蛋白 將上述剩余菌體進行純化,硫酸鎳(Nickel sulfate)沖柱,ddH2O沖柱,平衡緩沖液buffer A沖柱(500 mmol/L Sodium chloride,50 mmol/L Tris,pH8.0),柱體積buffer A洗脫未結合雜蛋白,buffer B(50 mmol/L Tris,15非特異性蛋白,buffer C沖柱洗特異性蛋白,取少量純化進行SDS-page電泳分析。
1.2.7重組蛋白Western blot分析 取純化蛋白樣SDS-PAGE電泳將蛋白轉移到經甲醇活化的PVDF膜上,轉膜完成后以TBST洗PVDF膜多次,加入5%脫脂奶粉封閉1 h,以20例過敏患者混合血清為一抗在4 ℃恒溫條件下孵育過夜。加入Mouse Anti-Human IgE Fc-HRP為二抗,TBST洗膜去除未結合的二抗。ECL超敏發光試劑,在化學發光成像儀觀察顯色反應。
1.2.8Bla g 5的生物信息學分析 從GenBank中下載Bla g 5氨基酸序列(GenBank ID為U92412),通過SWISS-MODEL預測Bla g 5蛋白三維結構;通過DNA Star-LaserGene系統預測Bla g 5理化性質、二級結構、親水性、表面可及性、抗原指數。并利用Pblast搜索Bla g 5的同源序列,并從檢索結果中人工挑選出與Bla g 5同源的非冗余序列,對挑選出來的序列使用Clustal W 2.1進行多序列比對,為保證系統發生樹的可靠性,本研究中同時采用NJ法、ML法兩種方法建樹,在構建NJ樹之前計算pairwise Jukes-Cantor(JC)平均距離,(該值大于1時數據集不適合使用NJ法構建系統發生樹),替代模型選擇p-distance model,空位處理選擇pairwise deletion。在構建ML樹之前先預測最適合數據集的進化模型。NJ法與ML法均采用Bootstrap method進行檢驗,檢驗次數為500次,且建樹過程均在MEGA-X中進行。
2 結 果
2.1Blag5基因表達載體的構建 將Blag5基因連接至pET-28a(+)載體,以限制酶BamHI、XhoI雙酶切鑒定其為陽性,其核酸在瓊脂糖電泳與Bla g 5 cDNA長度基本一致,pET-28a(+)-Bla g 5表達載體構建成功(圖1)。

M:DNA Marker;1:pET-28a Blag 5 質粒雙酶切后片段
2.2重組Bla g 5表達及純化 工程菌Rosetta(DE3)經IPTG誘導表達及純化后,其表達產物經SDS-PAGE可見25 kDa處有明顯條帶,與預期分子量接近,由此得到部分可溶性重組蛋白(圖2)。重組蛋白大量表達后經Ni柱純化,純化蛋白經SDS-PAGE電泳結果顯示在分子量25 kDa處可見明顯條帶(圖3)。

M:Protein marker;1:誘導前; 2:37 ℃誘導全菌液; 3:37 ℃誘導上清;4:37 ℃誘導沉淀;5:16 ℃誘導全菌液;6:16 ℃誘導上清; 7.16 ℃誘導沉淀

圖3 重組Bla g 5蛋白在大腸桿菌中的誘導表達及純化
2.3重組Bla g 5的免疫原性鑒定 以20例過敏患者血清混合為一抗,以Mouse Anti-Human IgE Fc-HRP為二抗,血清特異性反應為陽性,而健康對照者血清反應為陰性(圖4)。

M:Protein marker; 1:Bla g 5重組蛋白
2.4 Bla g 5 生物信息學分析
2.4.1SWISS-MODLE同源建模 GMQE值為0.99(GMQE為全局模型質量評估,其置信度范圍為 0~1,越接近1,模型可信度越高)、QMEAN值為-0.24,提示預測可信度較高(其置信度范圍應該-4~0,越接近0,模型可信度越高),同源建模提示Bla g 5為具有同源二聚體結構的谷胱甘肽-S-轉移酶(圖5)。
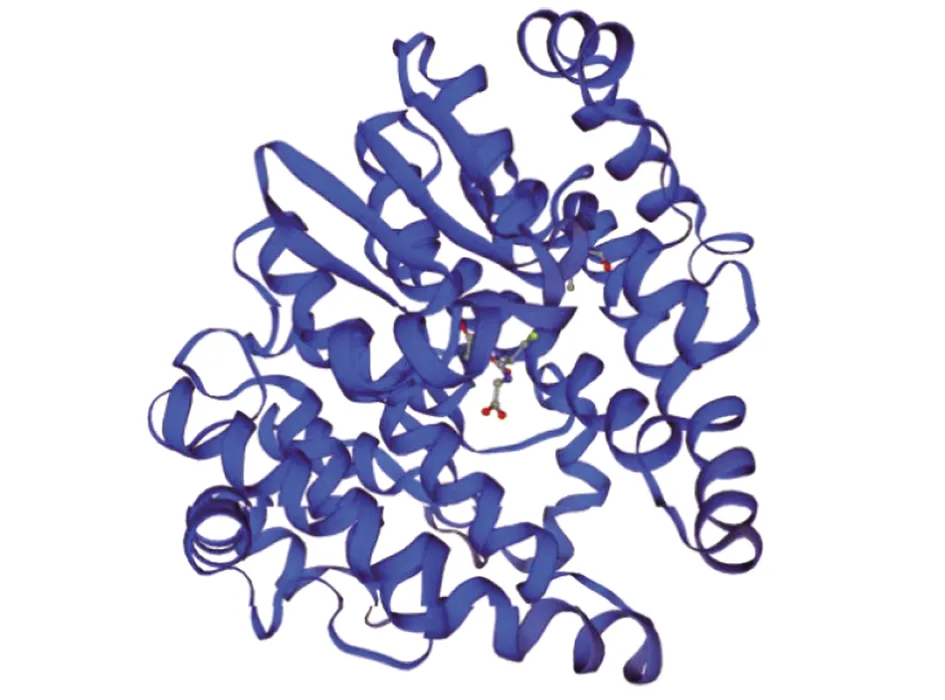
圖5 Bla g 5的三維結構預測
2.4.2Bla g 5的理化性質預測 采用EditSeq對德國小蠊Bla g 5理化性質進行分析顯示其理論分子量為22 947.21道爾頓,其理論等電點為6.620,組成Bla g 5的200個氨基酸中有28個強堿性氨基酸,29個強酸性氨基酸;71個疏水性氨基酸,42個親水性氨基酸。
2.4.3Bla g 5二級結構預測 蛋白質二級結構主要包括α螺旋、β折疊、轉角(Turn)、無規則卷曲(Coil)等。應用DNA Star Protean軟件提供的模塊,采用Garnier-Robson法預測Bla g 5二級結構,其共含200個氨基酸,二級結構以α螺旋為主,并伴有相當量的β折疊、Turn、Coil,結構較為復雜(圖6)。
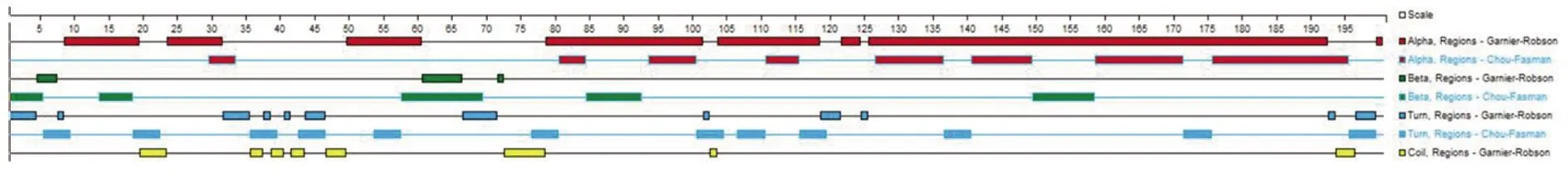
圖6 Bla g5的二級結構預測
2.4.4Bla g 5親水性預測 過敏原親水性與過敏原表位相關性較高,蛋白質親水性越高,親水性區域暴露在表面更易形成抗原表位的可能性越大。應用DNA Star Protean軟件提供的模塊,采用Kyte-Doolittle 法預測Bla g 5親水性,其親水區域約占總序列的57%(圖7)。

圖7 Bla g 5的親水性預測
2.4.5Bla g 5可塑性預測 一般來說,蛋白構象可塑性越強,越易形成抗原表位,應用DNA Star Protean軟件提供的模塊,采用Karplus-Schul 法預測Bla g 5可塑性,其可塑性區域占48%,提示Bla g 5可塑性較好,易形成抗原表位(圖8)。

圖8 Bla g5的可塑性預測
2.4.6Bla g 5抗原性預測 抗原性預測基于已研究透徹的蛋白質,抗原指數越高則說明該氨基酸在抗原區出現的頻率越高,應用DNA Slar Prolean軟件提供的模塊,采用Jameson-Wolf 法預測Bla g 5抗原性(圖9)。

圖9 Bla g5的抗原性預測
2.4.7Bla g 5表面可及性預測 表面可及性代表蛋白質氨基酸殘基被其他分子接觸到的可能性,表面可及性越高越易形成抗原表位。應用DNA Slar Prolean軟件提供的模塊,采用Plot-Emini法預測Bla g5表面可及性,其表面可及性平均值為1.3(圖 10),提示Bla g 5蛋白易形成抗原表位。

圖10 Bla g5的表面可及性預測
2.4.8Bla g 5同源性分析 為了確定Bla g 5與同源序列之間的關系,我們利用pblast進行同源性搜索,并從檢索結果中挑選出14條與Bla g 5同源的非冗余序列(表1)。在構建NJ樹之前計算得pairwise Jukes-Cantor(JC)平均距離為0.38,表明數據集適合使用NJ法,最終得到NJ樹如圖11。在構建ML樹之前,根據BIC標準選擇最佳進化模型為LG+G(Lgmodel+Gamma distributed)最終得到ML樹如圖12。系統發生樹結果顯示,我們所選取的14個物種中與德國小蠊(Blattellagermanica)親緣關系最近的是柑橘木虱(Diaphorinacitri),具有典型的谷胱甘肽硫轉移酶(GST)特征。
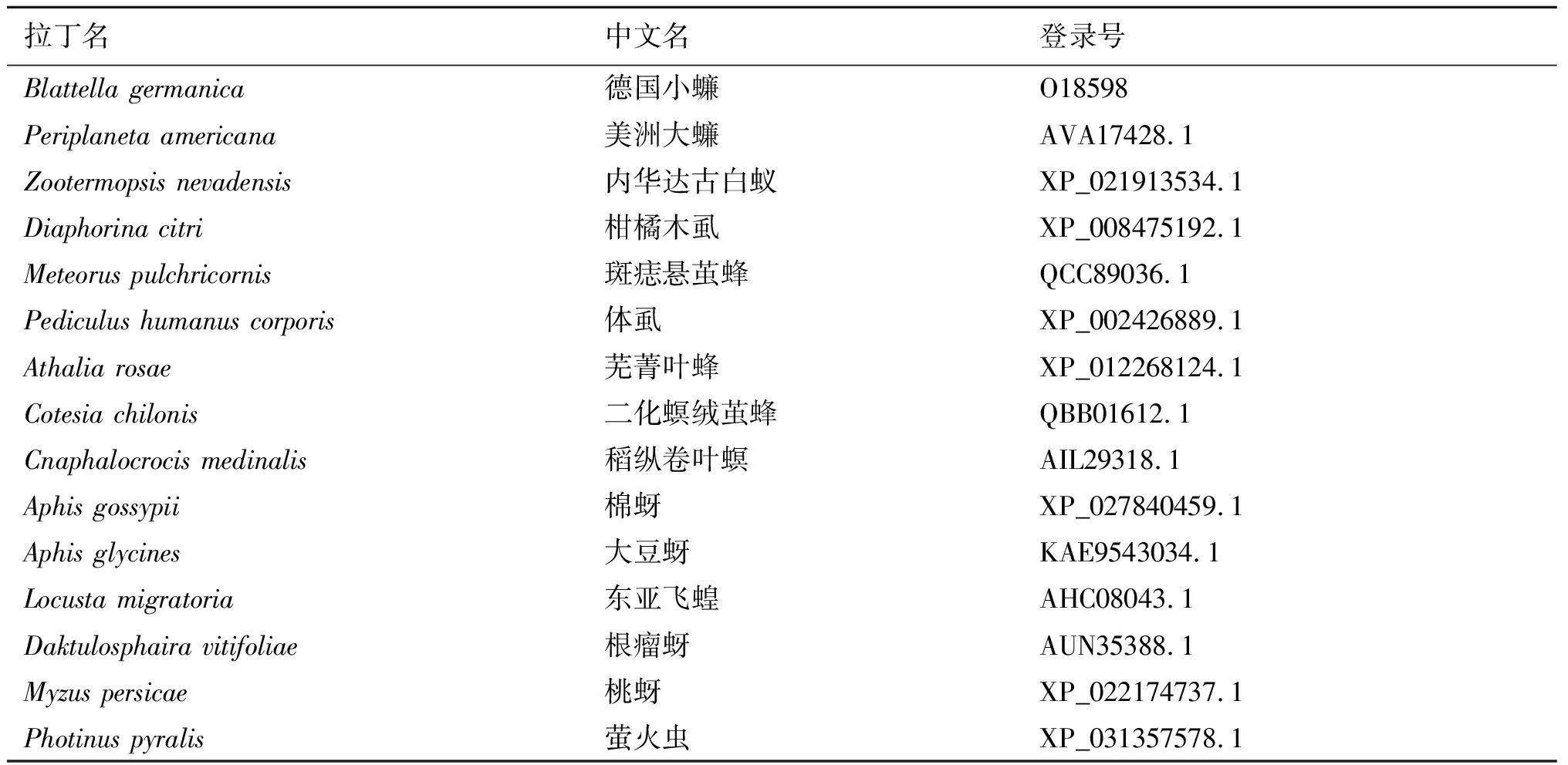
表1 Bla g 5同源序列
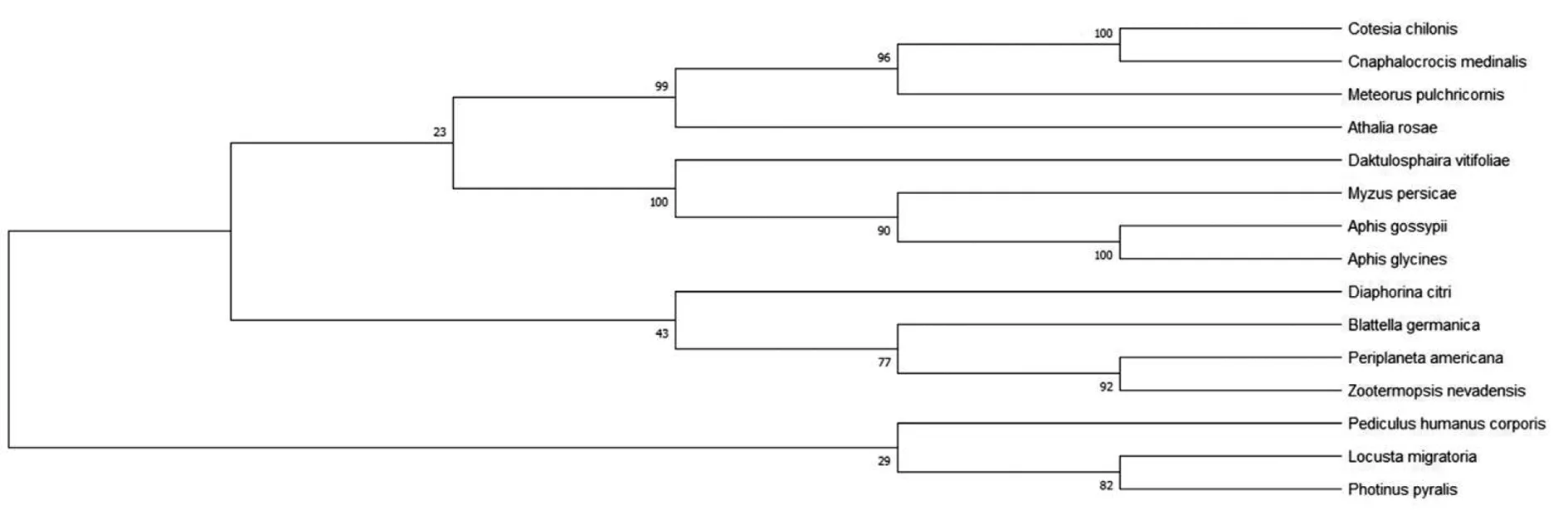
圖11 Bla g 5系統進化樹分析(NJ法)

注:本實驗只旨在找出與Bla g 5進化距離最近的序列,進而推測Bla g 5的生物學性質,因而不需要引進外類群以確定誰是誰的祖先。
3 討 論
德國小蠊(Blattellagermanica)是世界性家居衛生害蟲之一,其繁殖能力強,德國小蠊從卵孵化到性成熟需15~30 d,且德國小蠊單個卵莢中所含卵數量大于其他蜚蠊目,雌蟲可攜帶卵莢直至若蟲孵化,避免了外界不利環境對德國小蠊幼蟲的影響。由于其高繁殖潛力,其對殺蟲劑的抗藥性也越來越強[6-7],種種因素導致德國小蠊成為人類棲息地最常見害蟲之一。
研究表明德國小蠊皮屑脫落物及排泄物和分泌物可誘導Ig E介導的I型超敏反應[8],吸入可累及皮膚、呼吸道、胃腸道,引起蕁麻疹、鼻炎哮喘等過敏反應性疾病,L.Karla Arruda等人指出Bla g 5 本質為德國小蠊谷胱甘肽轉移酶(GST)[9],昆蟲GST被認為在蟑螂攝入的食物和其他物質的解毒過程中起著重要的生理作用。昆蟲體內GST產量的上調與對殺蟲劑(特別是有機磷)的抗藥性有關。長時間使用殺蟲劑以控制過敏患者家中的蟑螂種群可能會導致GST表達增加和患者對環境過敏原不同程度暴露。這些治療方法對蟑螂過敏原水平的影響尚不清楚。L.Karla Arruda等人的研究顯示,殺蟲劑治療可能會增加GST過敏原的暴露,這反過來可能會導致過敏癥狀的風險增加[9]。與其他昆蟲GST相反,德國小蠊GST對CDNB(1-氯-2,4二硝基苯)底物的活性很低。這意味著德國小蠊GST對CDNB以外的底物有更高的親和力(即德國小蠊GST具有不同尋常的底物特異性),或者德國小蠊會產生一種比Bla g 5變應原對CDNB特異性更高的GST同工酶。Kyoung-jin Jeong通過覆蓋Bla g 5的1-175個氨基酸的3個肽片段來確定IgE表位區域,這3個肽片段沒有表現出IgE反應性。該結果表明,Blag 5的表位位于176和201之間的C端區域[10]。Kyoung-jin Jeong猜測Blag 5在C末端區域可能會產生類似果蠅GST的域間裂隙結構,從而構成構象表位[10]。
我國臨床流行病學調查顯示蟑螂抗原皮膚點刺試驗陽性率12.7%~79%[11],考慮到生物多樣性,不同地區的生物其基因序列和氨基酸序列有一定差異,導致其免疫原性有所不同,為了提高我國過敏性疾病診斷的特異性和治療療效,因盡可能使用本地化過敏原。本實驗研究的Blag5基因序列全長1 140 bp,編碼Bla g 5蛋白共計200個氨基酸,通過基因重組技術將德國小蠊主要過敏原Blag5基因導入大腸埃希氏菌,通過純化最終得到高純度的Bla g 5重組蛋白,可應用于臨床德國小蠊過敏的特應性診斷[11]。特異性免疫治療(SIT)是目前認為最為有效的脫敏療法,即通過對過敏者注射過敏原,誘導患者產生過敏反應,并逐漸增加劑量達到增強患者對其耐受,最終達到脫敏的目的[12],但目前臨床上廣泛使用的仍然是蟑螂粗提液,粗提液中含大量非致敏成分,其具有特異性差、穩定性差、治療周期長、易產生不良反應等缺陷[13],而重組Bla g 5蛋白可用于標準化疫苗生產,從而避免蟑螂浸出液種種缺陷[14]。本研究通過SWISS-MODLE、DNAstar等生物信息學工具對Bla g 5的三維結構、二級結構、親水性、表面可及性、抗原指數等理化性質進行預測,為德國小蠊過敏原的結構和功能的進一步研究提供了理論依據[13]。
利益沖突:無

