長鏈非編碼RNA調控心肌細胞肥大的研究進展
崔藝萌,陳 瑜,張 騰
心肌細胞肥大是心肌肥厚的主要病理學基礎[1],是一種由心臟壓力負荷過重或心肌損傷引起的代償性或失代償性病理改變[2],而心肌肥厚作為肥厚性心肌病、高血壓心臟病和缺血性心臟病等心血管疾病的共同病理改變,已成為誘發心力衰竭的一個重要因素[3-4]。心肌細胞是心臟損傷的直接靶細胞,可能成為心臟疾病治療的重要潛在靶點之一。相關研究顯示,非編碼RNA(non-coding RNAs,ncRNAs)在心肌細胞肥大過程中具有重要的調控作用[5],但調控心肌細胞肥大的相關機制需進一步研究。
ncRNAs是一類不編碼蛋白質但具有重要生物學功能的RNA分子,覆蓋98%以上的人類基因組[6]。根據ncRNAs長度分為微小RNA(microRNAs,miRNAs)、長鏈非編碼RNA(long non-coding RNAs,lncRNAs)和環狀RNA(circular RNAs,circRNAs)。近年來,關于心肌細胞肥大的研究越來越多,但相關分子調控機制尚未明確。現綜述lncRNAs調控心肌細胞肥大的研究進展。
1 lncRNAs概述
lncRNAs是一種不具備編碼蛋白質能力的內源性RNA分子,通常長度>200個核苷酸,多數情況下不編碼蛋白質,是ncRNAs中廣泛的亞群,通過轉錄前、轉錄及轉錄后水平和翻譯水平在生理病理過程中發揮調控作用。過去的幾十年,miRNAs結構和功能被廣泛研究,而lncRNAs相較于miRNAs,具有較低的保守性,調控基因形式多樣,導致人們對lncRNAs認識及研究受到較大的限制。
根據染色體與編碼基因的相對位置將lncRNAs分為以下幾類:反義型(antisense lncRNAs)、內含子型(intronic lncRNAs)、反向型(divergent lncRNAs)、基因間型(intergenic lncRNAs)、啟動子上游型(promoter upstream lncRNAs)、啟動子型(promoter-associated lncRNAs)、轉錄起始位點型(transcription start site-associated lncRNAs)[7-8]。根據分子作用機制將其分為4種類型[9]。①調控下游基因轉錄(signals):作為轉錄活性的分子信號或指示劑,lncRNAs表達可對相關基因進行空間和時間地調控。②分子阻斷劑(decoys):作為分子阻斷劑,lncRNAs與轉錄因子或其他蛋白結合從而阻斷分子作用或信號通路,進而調控下游基因轉錄。另一種阻斷機制是通過競爭性內源RNA(competitive endogenous RNAs,ceRNAs)機制,作為miRNAs的分子海綿,以競爭性方式結合miRNAs,進而影響miRNAs對下游靶基因的調控。③lncRNAs與蛋白結合(guides):lncRNAs與蛋白結合指導核糖體蛋白復合物定位至特定目標。④中心平臺(scaffolds):作為“中心平臺”,多個相關轉錄因子均可結合在lncRNAs分子上,多條信號通路同時被激活,實現不同信號通路之間的信息交流。
lncRNAs上的互補位點使他們能識別并結合到mRNA、miRNAs甚至其他lncRNAs,并作為調節高度特異性的傳感器。lncRNAs可折疊為復雜的二級結構,與多種蛋白質結合。這種結構決定lncRNAs調控的多樣性,通過多種途徑在轉錄前、轉錄及轉錄后和翻譯水平調控基因的表達[10-11]。最初lncRNAs認為是“進化垃圾”,相關研究證據表明其具有調控心臟相關分子機制的能力,可參與心臟發育至成熟階段的一系列疾病[12],成為參與調控心肌細胞部分生理及病理過程的關鍵因子。
2 心肌細胞肥大相關過程
病理性心肌細胞肥大分為代償性肥大和失代償性肥大,當肥厚性應激作用持續存在時,心肌細胞從代償性肥大轉變為失代償性肥大,影響心臟收縮功能。心肌細胞肥大過程中,心肌細胞形態、大小及功能改變,表現為心肌細胞體積增大、蛋白合成總量增加及胎兒基因重新表達,這種變化在心肌細胞代償性肥大過程中發揮著重要的保護作用[13],而在心肌細胞失代償期這些病理改變進一步加重心力衰竭發生,并成為心肌細胞肥大的相關評價指標。這一病理過程可能存在能量代謝障礙[14]、氧化應激、炎癥、鈣離子失調[15]及細胞凋亡與衰老[16]等相關機制參與,同時受到多種復雜信號通路調控[17]。相關研究表明,參與調控心肌細胞肥大的主要信號通路包括絲裂原活化蛋白激酶MAPK信號通路、CaN-NFAT信號通路、PI3K-AKT/PKB-mTOR信號通路及染色質重塑的去乙酰化酶信號通路等[18]。lncRNAs可直接或間接激活這些信號通路,但具體調控機制尚未明確。
3 心肌細胞肥大相關lncRNAs
在心肌肥大病理過程中lncRNAs通過轉錄前、轉錄及轉錄后和翻譯水平調控相關基因的表達,在該病理過程中發揮主要作用。詳見圖1。
3.1 轉錄前水平調控 染色質重塑是染色質結構的動態修飾,其中組蛋白修飾、DNA修飾等參與調控染色質的重塑過程。這些結構變化是影響基因轉錄的關鍵因素之一。有研究表明,lncRNAs通過直接與組蛋白和DNA修飾酶相互作用的共價修飾和依賴ATP調控染色質重塑的非共價調控參與染色質的重塑過程[19]。
3.1.1 共價修飾 基因組功能在染色質水平上受到表觀遺傳修飾的高度調控,其中組蛋白賴氨酸甲基化和乙酰化對調控基因組結構、基因組穩定性和基因表達關鍵蛋白復合物的聚集至關重要[20]。多梳抑制性復合體2(polycomb repressive complex 2,PRC2)具有組蛋白甲基轉移酶活性,主要作用于賴氨酸27上的組蛋白H3甲基化(histone H3 lysine 27 methylation,H3K27me3)[21]。PRC2作為lncRNAs的已知分子靶點[22],在心肌肥厚發生發展中發揮重要的調節作用。Wang等[23]研究發現,心肌肥厚相關表觀遺傳調節因子(cardiac-hypertrophy-associated epigenetic regulator,Chaer),可能通過直接與PRC2催化亞基相互作用,抑制心肌肥大相關基因啟動子區組蛋白H3K27甲基化,促進心肌細胞肥大。Xing等[24]研究證實,肌鈣蛋白可誘導心肌細胞肥大,促進胎兒基因表達。有研究發現,編碼調控心臟收縮蛋白Myh7基因位點上肌球蛋白重鏈RNA轉錄本lncRNA Mhrt與肌鈣蛋白有直接靶向關系,并在心肌細胞肥大過程中形成一個循環調控[25]。一方面,lncRNA Mhrt通過影響組蛋白去乙酰化酶5(histone deacetylase 5,HDAC5)對肌鈣蛋白的去乙酰化作用抑制心肌細胞肥大;另一方面,肌鈣蛋白通過與lncRNA Mhrt啟動子上的兩個結合位點結合直接激活lncRNA Mhrt轉錄,在心肌細胞肥大病理過程中發揮重要作用。
3.1.2 ATP依賴的非共價調控 lncRNA Mhrt作為染色質重塑的一個例子,在病理重塑中可抑制心肌細胞肥大。有研究表明,一種“lncRNAs-染色質”相互作用機制可能導致心力衰竭發生[26]。Brg1是一種被壓力激活的色素重塑因子,導致異常基因的表達和心肌病的發生。該研究明確了一種具有心臟保護作用的lncRNA Mhrt,定義了一種新型針對ATP依賴性染色質重塑因子的靶向機制,lncRNA Mhrt通過拮抗Brg1表達抑制心肌細胞肥大。從新的角度揭示了lncRNAs與染色質的相互作用機制,其在心肌肥厚和心力衰竭過程中起到的重要作用,并為lncRNAs與染色質的相互作用建立了新型模式。
3.2 轉錄及轉錄后水平調控 lncRNAs可在轉錄水平通過順式作用元件如(啟動子、增強子、沉默子和絕緣子)調控轉錄起始的DNA序列。Viereck等[27]通過全基因組lncRNA表達譜分析研究發現,心肌營養相關轉錄本(cardiac hypertrophy-associated transcript,Chast)是促進心肌細胞肥大的lncRNA。lncRNA Chast在主動脈縮窄手術小鼠、主動脈瓣狹窄病人和肥大刺激下人胚胎干細胞來源的心肌細胞表達均顯著上調,可能通過順式作用負向調控自噬因子Plekhm1表達,進而抑制心肌細胞自噬并促進心肌細胞肥大,該研究表明促肥大轉錄因子NFAT與編碼lncRNA Chast基因位點結合,促進lncRNA Chast表達。詳見圖1、圖2。
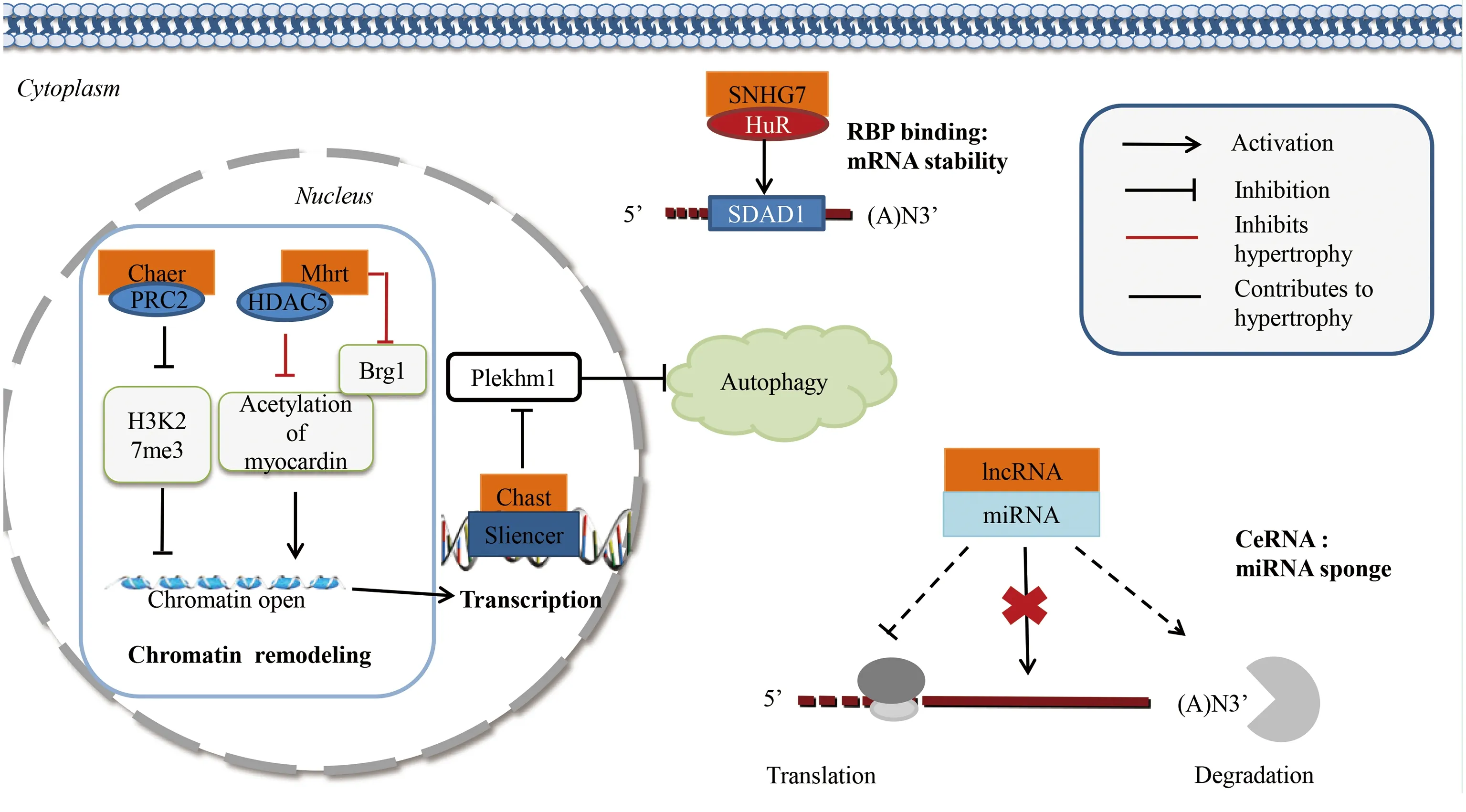
圖1 心肌細胞肥大與lncRNAs (① PRC2:polycomb repressive complex 2,多梳抑制性復合體2;②Me3:histone methylation,組蛋白三甲基化;③HDAC5:histone deacetylase 5,組蛋白去乙酰化酶5;④RBP:RNA binding protein,RNA結合蛋白)
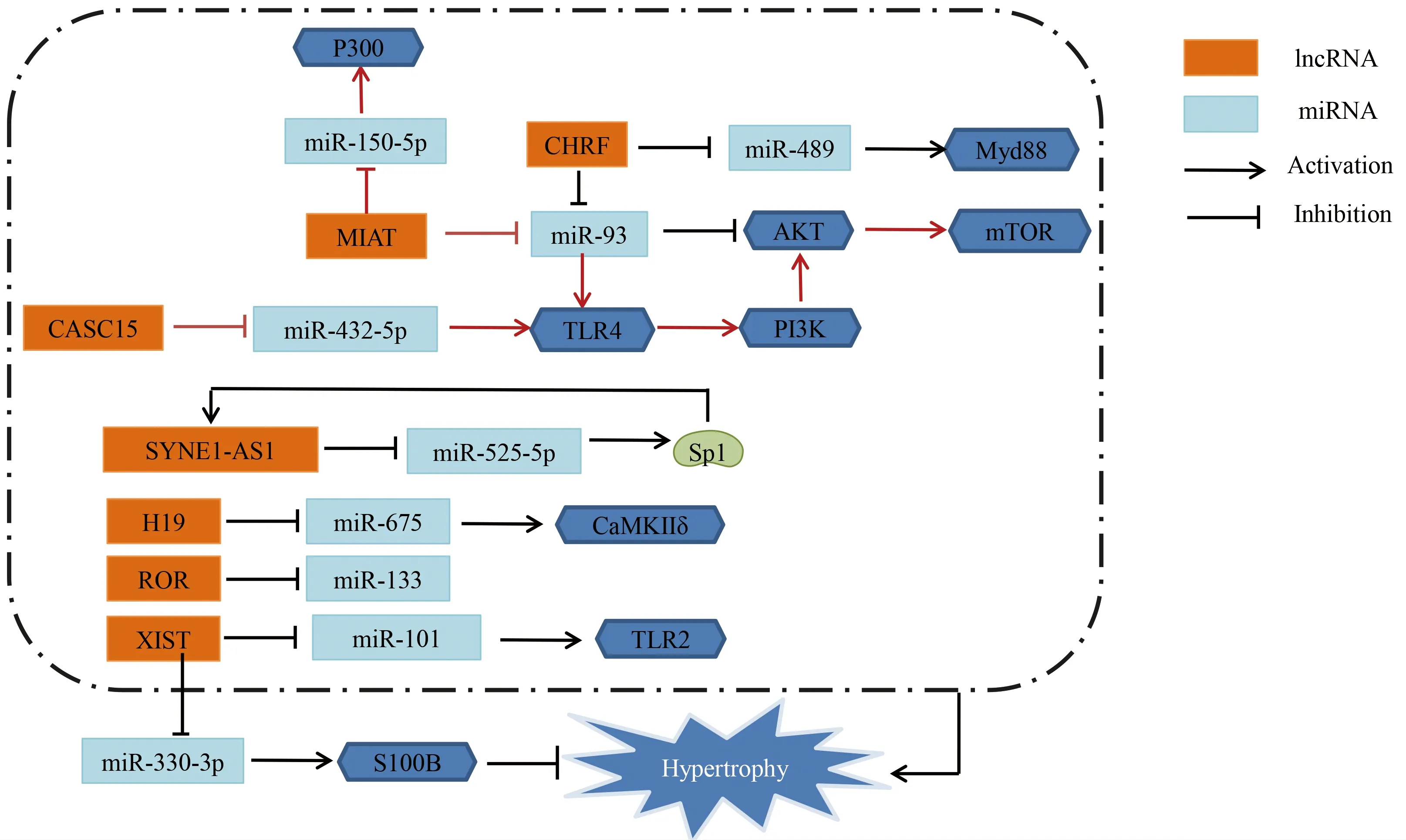
圖2 ceRNA機制
lncRNAs在轉錄后水平通過與RNA結合蛋白(RNA binding protein,RBP)相互作用調控mRNA穩定性。RBP在細胞質中與單鏈或雙鏈RNA結合,穩定mRNA表達。lncRNA SNHG7已明確為人類癌癥中的致癌基因[28-29],SDAD1在幾種癌癥中證實具有促癌作用[30-31]。有研究發現,lncRNA SNHG7和SDAD1在血管緊張素Ⅱ(AngⅡ)誘導的原代乳鼠心肌細胞肥大模型中表達上調,證實了lncRNA SNHG7可能通過與RNA結合蛋白HuR相互作用進而穩定SDAD1 mRNA表達,促進心肌肥大,作為促心肌細胞肥大的一個新型調控因子[32]。
3.3 翻譯水平調控 CeRNA機制是一種RNA之間的調控機制,包含生物體內復雜的轉錄調控網絡中除miRNAs外的眾多RNA分子,包括mRNA、lncRNAs、circRNAs等,均存在與miRNAs結合的位點,在細胞中起到miRNAs海綿的作用,進而解除miRNAs對靶基因的抑制作用[33]。
3.3.1 促心肌細胞肥大 已有研究表明,心臟肥厚相關因子(CHRF)作為miR-489的分子海綿,抑制miR-489表達,進而上調其下游靶點Myd88的表達促進心肌細胞肥大[34]。Myd88作為核轉錄因子-κB(NF-κB)的下游效應因子,Myd88敲除不僅可減緩心肌細胞肥大,還可減輕心肌纖維化和心臟相關炎癥反應。新近研究表明,miR-93通過上調Akt3表達水平抑制心肌細胞肥大,而lncRNA CHRF可作為miR-93分子海綿,通過調控miR-93/Akt3軸促進心肌細胞肥大[35]。Liu等[36]研究發現,miR-675過表達可抑制心肌細胞肥大。lncRNA H19可競爭性結合miR-675,下調心肌細胞miR-675的表達,該研究證實CaMKⅡδ是miR-675直接的下游靶點,提示lncRNA H19可能靶向miR-675上調CaMKⅡδ的表達促進心肌細胞肥大。lncRNA ROR通過負向調控miR-133表達促進心肌細胞肥大[37]。
相關研究發現,lncRNA心肌梗死相關轉錄本(MIAT)沉默導致ISO誘導的心肌細胞心房利鈉肽(atrial natriuretic peptide,ANP)表達下調,顯著上調miR-150表達,從而降低原代乳鼠心肌細胞P300表達[38]。lncRNA MIAT促心肌細胞肥大可能通過lncRNA MIAT/miR-150-5p軸靶向P300發揮作用。有文獻報道,AngⅡ誘導的體外心肌細胞肥大模型中lncRNA MIAT表達上調,而miR-93表達下調,lncRNA MIAT作為miR-93的分子海綿抑制心肌細胞miR-93表達,進而上調miR-93靶點toll樣受體4(toll-like receptor 4,TLR4)表達[39]。lncRNA MIAT可能通過miR-93/TLR4軸激活PI3K/Akt/mTOR信號通路促進AngⅡ誘導心肌細胞肥大的病理進程。Toll樣受體作為心肌細胞肥大進程的重要靶點之一,受到多分子調控作用。Li等[40]研究表明,lncRNA CASC15被轉錄因子VDR激活,通過競爭性結合miR-432-5p上調TLR4表達從而誘導心肌細胞肥大。
Wang等[41]研究發現,lncRNA SYNE1反義RNA1(SYNE1-AS1)敲除可減輕心肌細胞肥大表型,其作用機制可能通過作為miR-525-5p的分子海綿正向調控Sp1轉錄因子(Sp1 transcription factor,Sp1)表達促進心肌細胞肥大。Sp1能激活lncRNAs SYNE1-AS1轉錄。因此,lncRNA SYNE1-AS1促心肌細胞肥大的機制可能通過miR-525-5p/Sp1軸及Sp1和lncRNA SYNE1-AS1形成反饋調節機制進行動發揮作用。
3.3.2 雙向調節作用 Xiao等[42]研究發現,在PE誘導的體外心肌肥大模型和TAC誘導的體內心肌肥厚模型中,lncRNA XIST表達均顯著升高。采用熒光素酶報告基因測定法和RNA免疫沉淀法研究XIST、miR-101、toll樣受體2(toll-like receptor 2,TLR2)之間的靶向關系;結果表明,TLR2是miR-101的下游靶點,lncRNA XIST直接靶向結合miR-101。結果證實lncRNA XIST促心肌細胞肥大作用可能是通過靶向miR-101進而調控TLR2表達實現的。有研究表明,lncRNA XIST過表達可能減緩心肌肥厚進程,其主要作用機制是lncRNA XIST通過與miR-330-3p的互補位點結合促進S100B表達,從而發揮對心肌細胞肥大的保護作用[43]。
4 小 結
目前研究發現lncRNAs有很多不同的分子機制,但關于lncRNAs的研究處于初級階段,現階段研究多數以ceRNAs機制對其功能進行闡釋。lncRNAs作為近年來的研究熱點,一是與編碼蛋白基因相比,lncRNAs具有較低的保守性,研究lncRNAs技術和方法需進一步改進;二是根據lncRNAs結構特點,lncRNAs作用靶點廣泛,調控機制復雜,仍需進一步探索。關于lncRNAs功能及其調控網絡的研究,不僅在揭示心肌細胞肥大的復雜機制中發揮重要作用,還可能為心臟疾病的治療提供新的潛在靶點。

