NEK2低表達與胃癌進展及不良預后密切相關
葛 晨,朱征海,張曉鑫,程 杰,周 英,許紫鵬,張銀超*
(1.無錫市錫山人民醫院普外科,江蘇 無錫 214000;2.無錫市人民醫院普外科,江蘇 無錫 214000)
胃癌(gastric cancer,GC)是全球最常見的惡性腫瘤之一,我國是胃癌高發的國家[1-2]。胃癌早期往往無癥狀或僅有輕微癥狀,容易被忽視,當臨床癥狀典型時,多已屬中晚期,錯過了最佳的治療機會。盡管近年來,手術方式、放化療、靶向治療以免疫治療等治療方式得到飛速發展,胃癌患者5年生存率仍只有40%[3]。 因此,尋找早期診斷的生物標志物、預后判斷指標以及藥物治療的有效靶點尤為重要。
中心體相關蛋白激酶2(NIMA-related expressed kinase 2, NEK2)是NEKs家族的一員,是一種絲氨酸-色氨酸激酶,與細胞周期G2/M期的中心體分裂密切相關[4-5]。研究表明,NEK2不僅能通過調節中心體間接調控細胞分裂,還能通過作用于染色質直接參與細胞分裂[6- 7]。NEK2的異常表達導致中心體分離障礙,中心體異常和非整倍體的出現,使細胞惡化,最終導致腫瘤發生[8]。而且,NEK2過表達能激活多個腫瘤相關信號通路和ATP結合盒轉運蛋白,從而促進腫瘤增殖、侵襲和耐藥[9]。已有研究發現NEK2在多種腫瘤中異常表達,如:乳腺癌、結腸癌、肝癌、前列腺癌等。NEK2異常表達與腫瘤分化程度、TNM分期、淋巴結轉移以及患者不良預后密切相關。目前NEK2在胃癌組織中的表達情況鮮有報道。
本研究旨在通過免疫組化方法明確NEK2在胃癌組織中的表達情況,探討NEK2表達與臨床病理特征以及預后的關系。本研究的開展為NEK2基因功能及胃癌研究提供思路。
1 資料和方法
1.1 臨床資料
收集無錫市錫山人民醫院2006年至2009年間76例胃癌患者的癌及癌旁組織,并且具有完備的病理資料和隨訪信息。所有標本均經病理診斷為胃癌,同時患者術前未接受任何放化療,術后根據診療規范進行化療。樣本收集前均通過無錫市錫山人民醫院倫理委員會批準及患者知情同意。術后每三個月隨訪一次,隨訪時間為0-101月,對在本院治療和復查的病人進行詳細登記,其余病人進行電話隨訪。
1.2 主要試劑
Envision免疫組織化學檢測試劑盒購自上海今邁生物科技有限公司,NEK2兔抗人單克隆抗體購自上海信裕科技有限公司,DAB酶底物顯色試劑盒購自福建邁新有限公司,磷酸鹽緩沖液(PBS) 、牛血清白蛋白(BSA)、3 %H202溶液 等購自碧云天生物科技有限公司。
1.3 免疫組化檢測
常規石蠟切片二甲苯脫蠟, 梯度濃度酒精脫水。用3%H2O2200ml浸泡10min,抗原修復液修復2次,滴加5% BSA封閉液,室溫放置35min。滴加適量的NEK2一抗,4℃過夜。用PBS洗4次,滴加二抗,37℃下放置35min,用PBS洗滌4次。根據試劑盒說明,配制顯色液。顯色完后水洗,滴加蘇木素染液,浸染2min,然后水洗,無水乙醇脫水,二甲苯中透明。
1.4 結果判讀
免疫組化的結果根據染色強度和表達比例來綜合判定。本研究由兩位專業的病理醫師來判讀,當出現結果不一致時經商議決定。表達強度:每張切片上觀察5個高倍視野(×400),無色為0分,淡黃色為1分,棕黃色為2分,棕褐色為3分。積分綜合計量:每種陽性強度對應的值×該強度細胞的百分比,即1×弱陽性百分比+2×中等陽性百分比+3×強陽性百分比。按照積分綜合計量中位值分為高表達組和低表達組。
1.5 數據下載
登錄GEO數據庫網站(https://www.ncbi.nlm.nih.gov/geo/),在GEO數據集中搜索并下載GSE84437的芯片數據及對應的臨床樣本信息。根據患者的樣本編號、隨訪時間及生存狀態是否完成,共獲得434位胃癌患者的數據。
1.6 統計分析
應用SPSS 23.0統計軟件處理分析數據。配對差值非參數檢驗(Wilcoxon符號秩和檢驗)比較胃癌組織和癌旁組織中NEK2蛋白的表達差異;用四格表卡方檢驗以及Fisher精確檢驗分析NEK2蛋白表達與臨床指標的關系;用Kaplan-Meier法和Logrank檢驗分析各變量與預后的關系,應用多因素COX比例風險模型評估對生存影響的獨立因素。P<0.05為差異有統計學意義。
2 結 果
2.1 NEK2蛋白在胃癌組織及癌旁組織中的表達
在胃癌及癌旁組織中,NEK2蛋白主要在細胞質中表達,呈棕黃色(圖1)。通過秩和檢驗發現,NEK2蛋白在胃癌組織中的表達明顯低于癌旁組織(Z=-4.333,P=0.000,圖2)。根據積分綜合計量中位值,胃癌組織中NEK2蛋白高表達組37例,低表達組39例(表1)。

表1 NEK2表達與胃癌患者臨床病理特征的關系
2.2 NEK2表達與胃癌臨床病理特征的關系
從表1我們看出,NEK2的表達與性別、年齡,浸潤深度、淋巴結轉移、M分期、TNM分期、腫瘤直徑以及腫瘤位置無關(表1)。有趣的是,我們通過亞組分析發現,在非胃竇部胃癌中,NEK2低表達與淋巴結轉移(P=0.041)、TNM分期(P=0.004)呈負相關,但是與性別、年齡,浸潤深度、遠處轉移、腫瘤直徑無相關性(表2)。
2.3 NEK2表達與胃癌患者預后的關系
我們采用Kaplan-Meier法繪制生存曲線,并采用Logrank檢驗分析來研究NEK2表達與胃癌患者預后的關系。NEK2低表達組總生存率明顯低于NEK2高表達,且結果具有統計學差異(P=0.022,圖3)。為了進一步驗證NEK2表達在胃癌患者預后的影響,我們從GEO數據庫下載GSE84437數據,并采用Kaplan-Meier及Log-rank檢驗進行,再次證實NEK2低表達組較NEK2高表達組的總生存率低(P=0.027,圖 4)。而且我們對影響腫瘤預后的因素進行COX多因素分析,結果顯示腫瘤直徑(P=0.033)以及N E K 2 表達(P=0.0 4 6)是胃癌預后的獨立影響因素(表3)。
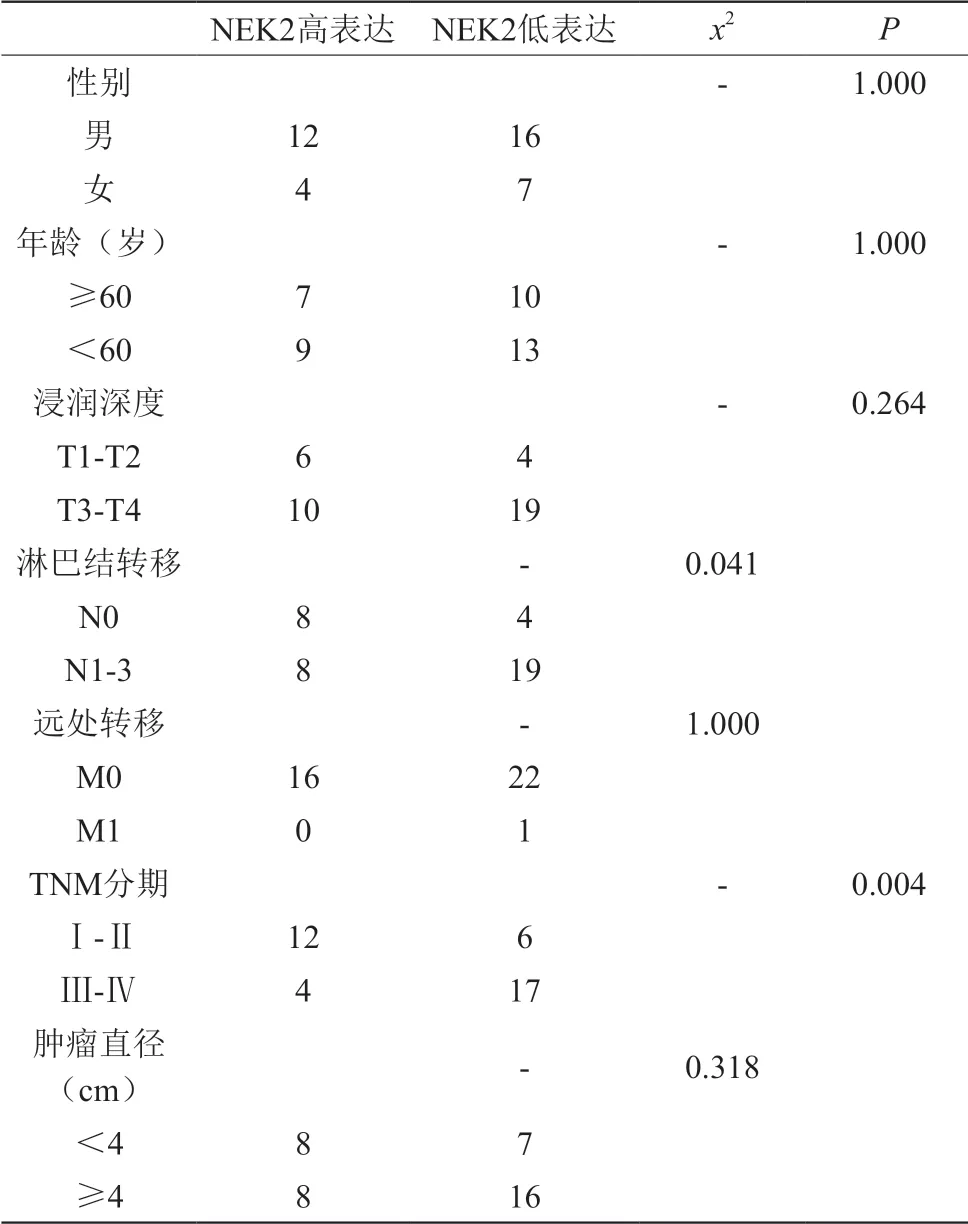
表2 NEK2表達與非胃竇部胃癌患者臨床病理特征的關系
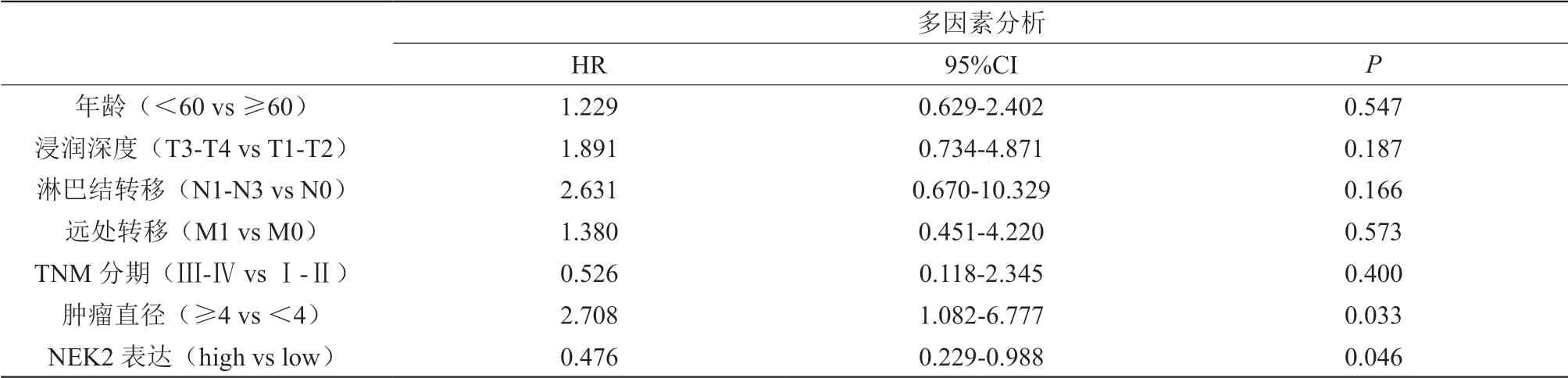
表3 單因素與多因素Cox風險回歸分析對胃癌患者總體生存獨立因子的檢驗
3 討 論
胃癌是全球最常見的惡性腫瘤之一,嚴重危害人類健康。目前針對胃癌早期診斷、預后判斷及靶向治療方面開展了大量的研究,但臨床轉化的標志物少之又少,因此,亟需進一步研究。本研究系統地分析了NEK2在76例胃癌患者組織中的表達情況,探討了NEK2的表達與臨床病理特征以及預后的關系。已有研究表明,NEK2在多種腫瘤中呈高表達,而且NEK2高表達提示不良預后。但是,在我們的研究中發現,NEK2在胃癌組織較癌旁組織中低表達(P=0.000)。同時,在非胃竇部胃癌中,NEK2的表達與淋巴結轉移(P=0.041)、TNM分期(P=0.004)呈負相關。此外,Kaplan-Meier法分析結果顯示,NEK2低表達預示不良預后(P=0.022),而且這一結果在GSE84437(P=0.027)中得到進一步證實。COX多因素分析結果提示,腫瘤直徑(P=0.033)以及NEK2表達(P=0.046)是預后良好的獨立影響因素。
NEK2是細胞周期G2期的關鍵蛋白,調控染色質的分離。細胞周期紊亂是腫瘤細胞的特征之一,異常的細胞周期促進腫瘤的增殖[10- 11]。異常表達的NKE2可引起中心體不穩定及非整倍體的出現,誘發細胞癌變。研究表明,NEK2通過MAPK信號通路調控肝癌細胞增殖、凋亡[12]。NEK2過表達促進乳腺癌細胞增殖,下調NEK2表達影響中心體分裂過程,導致非整倍體的出現,同時增加半胱天冬酶3切割,增加抑癌蛋白Rb的活性,降低組蛋白H3的活性,抑制腫瘤生長[13]。抗細胞凋亡是NEK2介導的細胞周期紊亂帶來的另一個的結果。在骨髓瘤體內和體外模型中發現,NEK2抑制導致切割的腺苷二磷酸核糖聚合酶表達增高,同時活化半胱天冬酶3/8/9[14]。這些結果提示NEK2有可能通過影響細胞周期來調控胃癌的發生、發展。
NEK2的表達與腫瘤轉移以及耐藥亦密切相關。NEK2過表達能上調β調連接蛋白的表達以及核內蓄積,激活β活連接蛋白信號通路,促進肺癌、多發性骨髓瘤的轉移。NEK2活化蘇氨酸激酶/核轉錄因子及基質金屬蛋白酶促進腫瘤轉移,活化的IL-8協同氨酸激酶/核轉錄因子通路促進血管生成,同時上調ATP結合盒轉運家族蛋白10表達,增強腫瘤耐藥[15]。我們的研究發現在非胃竇部胃癌中,NEK2的表達與淋巴轉移呈負相關。這一結果提示我們,NEK2可能通過影響胃癌轉移相關通路發揮作用。
綜上所述,NEK2在胃癌組織中低表達,在非胃竇部胃癌中與淋巴結轉移、TNM分期呈負相關。NEK2低表達與胃癌患者不良預后顯著相關,且是獨立的影響因素,有可能成為胃癌預后判斷指標之一。而進一步研究NEK2在胃癌發生、發展中的機制,將為NKE2作為臨床靶向藥物開發的潛在靶點提供思路和理論基礎。
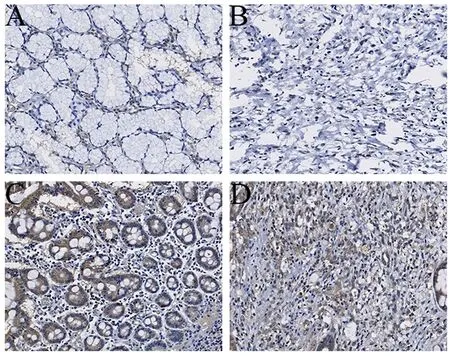
圖1 免疫組化檢測NEK2在胃癌和癌旁組織中的表達(×200)。A、C為癌旁組織,B、D為癌組織,A、B為NEK2低表達,C,D為NEK2高表達

圖2 NEK2在胃癌和癌旁組織中表達積分的秩次評分
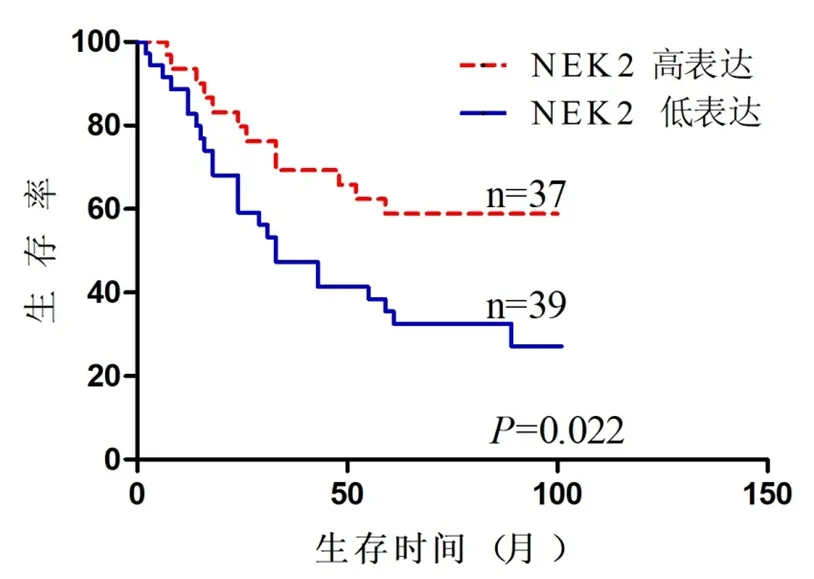
圖3 NEK2表達與胃癌患者總生存的關系

圖4 GSE84437中NEK2表達與胃癌患者總生存的關系

