多發性骨髓瘤患者外周血淋巴細胞計數單核細胞計數淋巴細胞與單核細胞比值與患者預后的關系
蒙 沙,張 楊,岳 溪,李 健
(四川大學華西醫院血液科,四川 成都 610041)
多發性骨髓瘤(multiple myeloma,MM)是繼淋巴瘤后第二常見血液系統腫瘤,以單克隆漿細胞異常增殖為主要特征,臨床表現為骨骼破壞、貧血、高粘滯綜合征、腎功能減低等癥狀。MM的預后較差,盡管針對該病的新藥相繼泛起,但因疾病異質性較大,在臨床表現、治療效果及預后方面均有較大差異。目前對于MM患者預后評估主要采用DS分期及ISS分期,近年來的研究表明,細胞遺傳學因素也是影響預后的關鍵[1]。外周血淋巴細胞計數(absolute lymphocyte count,ALC)、單核細胞計數(absolute monocyte count,AMC)是反應機體免疫狀態的指標,研究表明,在霍奇金淋巴瘤等血液系統疾病中,預后較差的患者多表現為外周血ALC水平的降低[2];在結直腸癌、腎癌等實體腫瘤疾病方面,也有研究報道AMC、ALC與預后的關系[3]。目前國內針對ALC、AMC、淋巴細胞與單核細胞比值(ALC/AMC ratio,LMR)與MM預后的關系仍處于早期研究階段,仍尚待更大樣本研究證實。本研究對我院收治的115例初診MM患者的臨床資料、隨訪資料進行分析,探討ALC、AMC及LMR對預后的預測價值,旨在為MM患者預后的評估提供依據。現報道如下。
1 資料與方法
1.1一般資料:選擇2016年3月至2019年8月我院收治的115例初診MM患者作為研究對象。納入標準:符合《中國多發性骨髓瘤診治指南(2015年修訂)》標準,包括癥狀性MM及無癥狀MM,癥狀性MM標準為骨髓單克隆漿細胞比例≥10%和(或)組織活檢存在漿細胞瘤,血清和(或)尿液中檢出克隆M蛋白,伴有相關器官或組織損害;無癥狀MM為M蛋白≥30g/L和(或)骨髓克隆性漿細胞比例≥10%,無相關器官或組織損傷[4];初治患者;臨床資料完整,對本研究知情并簽署同意書。排除標準:合并其他惡性腫瘤者;既往接受放化療治療者。
1.2方法:資料收集:查閱患者病例,收集患者性別、年齡、M蛋白分型、DS分期、ISS分期、貧血情況、骨質破壞情況、骨髓漿細胞比例、血紅蛋白(Hemoglobin,Hb)、乳酸脫氫酶(lactate dehydrogenase,LDH)、β2-微球蛋白(β2-microglobulin,β2-MG)、血肌酐水平、ALC、AMC、LMR等臨床資料。隨訪及預后:對患者進行隨訪,隨訪主要為門診及電話隨訪,總生存時間(over survival,OS)為患者初診確診至全因性死亡時間。

2 結 果
2.1入組患者一般資料:115例MM患者中男性65例,女性50例,年齡38~78歲,中位年齡59歲;M蛋白分型:IgG型62例,IgA型30例,輕鏈型23例;DS分期:Ⅰ期20例,Ⅱ期21例,Ⅲ期74例;ISS分期:Ⅰ期25例,Ⅱ期37例,IV期53例;骨髓漿細胞比例:≤30%者68例,>30%者47例;Hb≤110g/L者52例,>110g/L者63例;LDH≤245U/L者75例,>245U/L者40例;β2-MG≤5.5mg/L者77例,>5.5mg/L者38例。
2.2外周血ALC、AMC、LMR與臨床病理特征的關系:115例MM患者外周血ALC為(0.22~13.48)×109L-1,平均(1.77±0.45)×109L-1;外周血AMC為(0.01~0.98)×109L-1,平均(0.45±0.12)×109L-1;外周血LMR為1.18~12.74,平均4.74±0.85。分別采用外周血ALC、AMC、LMR中位值將患者分為高ALC組(≥1.74×109L-1,58例)及低ALC組(<1.74×109L-1,57例)、高AMC組(>0.65×109L-1,57例)及低AMC組(≤0.65×109L-1,58例)、高LMR組(≥3.85,58例)及低LMR組(<3.85,57例),經比較,高ALC組及低ALC組、高AMC組及低AMC組Hb、LDH、β2-MG等資料比較差異具統計學意義(P<0.05);高LMR組、低LMR組患者Hb、β2-MG比較差異具統計學意義(P<0.05)。詳見表1。
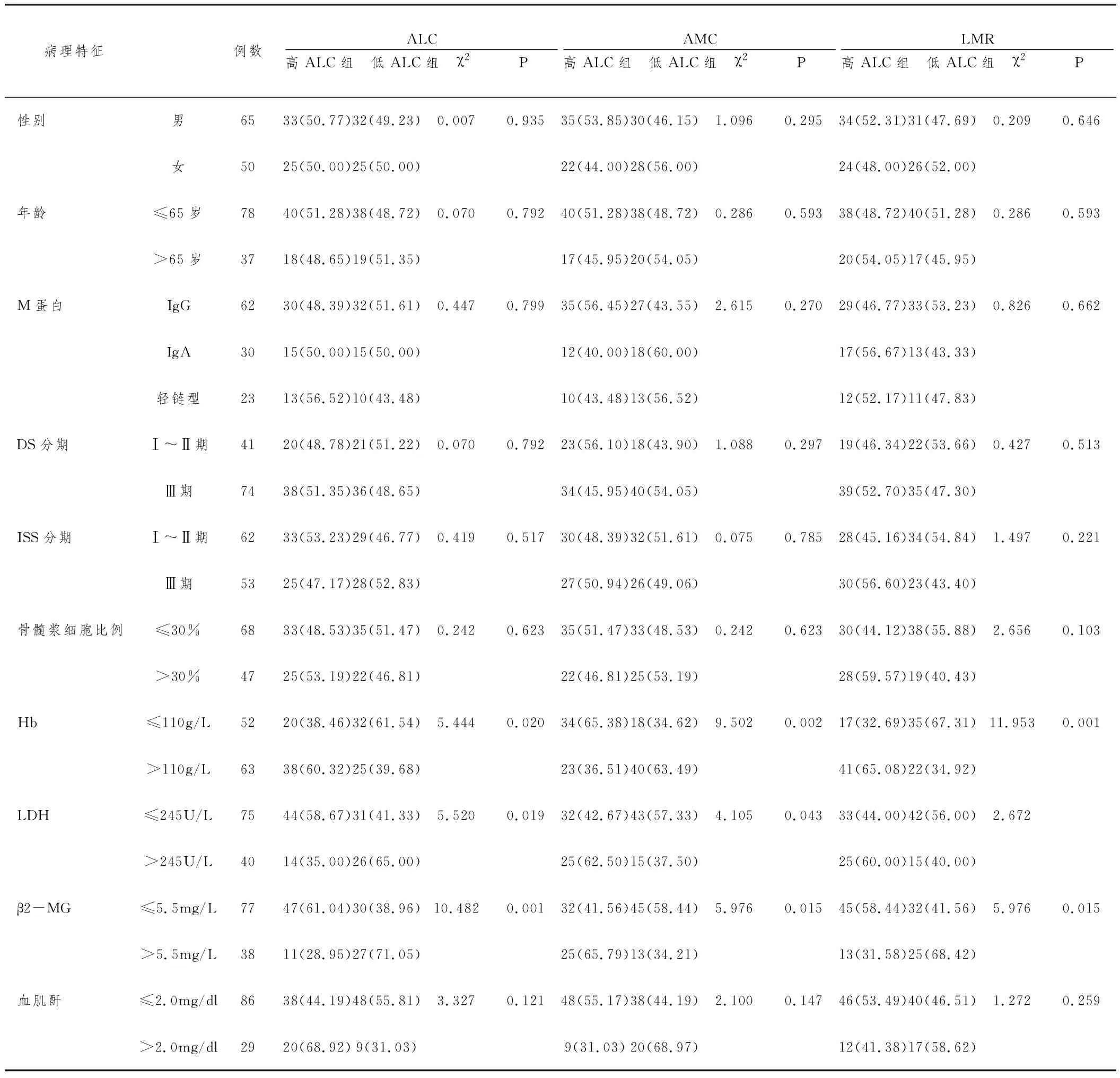
表1 外周血ALC AMC LMR與臨床病理特征的關系
2.3不同ALC、AMC、LMR水平患者預后情況分析:入組患者均獲得隨訪,隨訪截止時間為2020年7月,隨訪時間為8~52個月,繪制MM患者預后的Kaplan-Meier生存曲線,高ALC組、低AMC組、高LMR組患者總生存率顯著高于低ALC組、高AMC組、低LMR組(Log rank χ2分別為4.225、4.897、4.074,P<0.05)。詳見圖1、2、3。

圖1 高ALC組及低ALC組MM患者OS的Kaplan-Meier生存曲線

表2 初治MM患者預后Cox單因素分析
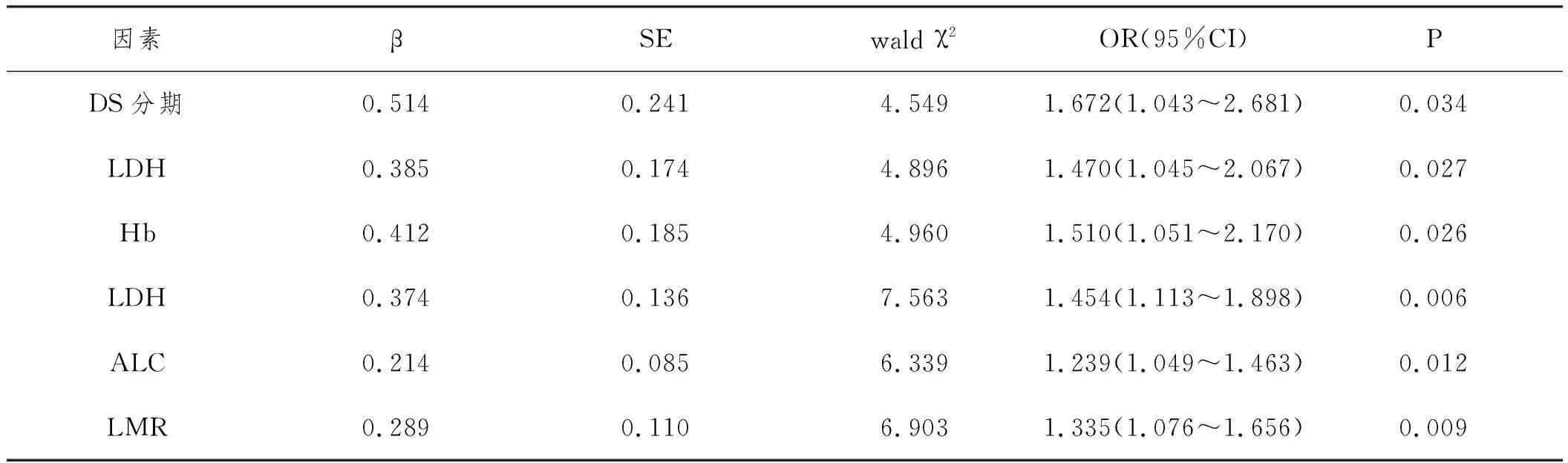
表3 初治MM患者預后Cox多因素分析
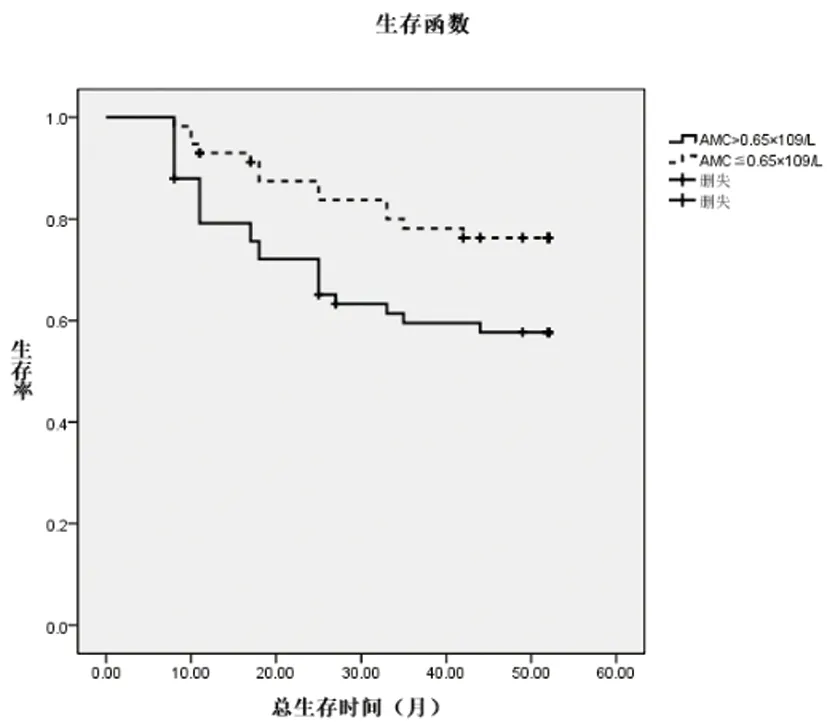
圖2 高AMC組及低AMC組MM患者OS的Kaplan-Meier生存曲線
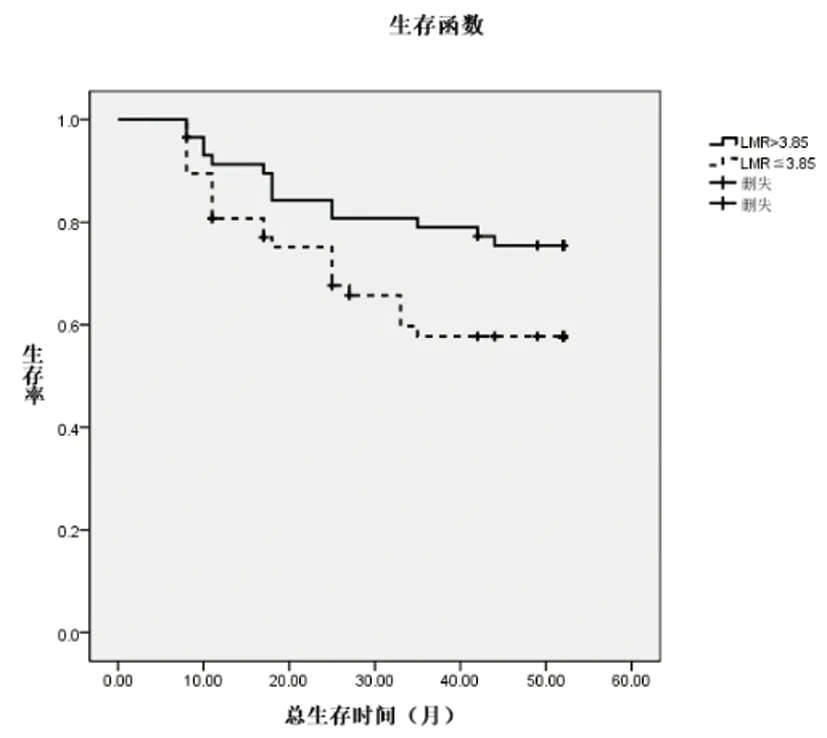
圖3 高LMR組及低LMR組MM患者OS的Kaplan-Meier生存曲線
2.4初治MM患者預后的多因素分析:以總生存時間作為自變量,以性別(1=男,2=女)、年齡(1=≤65歲,2=>65歲)、DS分期(1=Ⅰ~Ⅱ期,2=Ⅲ期)、ISS分期(1=Ⅰ~Ⅱ期,2=Ⅲ期)、骨髓漿細胞比例(1=≤30%,2=>30%)、Hb(1=>110g/L,2=≤110g/L)、LDH(1=≤245U/L,2=>245U/L)、β2-MG(1=≤5.5mg/L,2=>5.5mg/L)、血肌酐(1=≤2.0mg/dl,2=>2.0mg/dl)、ALC(1=≥1.74×109L-1,2=<1.74×109L-1)、AMC(1=≤0.65×109L-1,2=>0.65×109L-1)、LMR(1=>3.85,2=≤3.85)作為自變量,Cox單因素分析示,DS分期、LDH、Hb、β2-MG、ALC、AMC、LMR是初治MM患者預后不良的影響因素;將單因素分析有統計學意義的變量納入多因素分析,DS分期Ⅲ期、LDH>245U/L、Hb≤110g/L、ALC≤0.65×109L-1、LMR≤3.85是初治MM患者預后不良的獨立危險因素(P<0.05)。詳見表2、表3。
3 討 論
現有研究證實,惡性腫瘤發生發展過程可伴有局部或全身免疫微環境的改變,炎癥反應可導致大量白細胞聚集并發生凋亡,影響宿主抗腫瘤免疫應答作用,有利于腫瘤細胞大量增殖[5],淋巴細胞、單核細胞作為機體重要免疫細胞,在腫瘤生長、發展過程中也發揮重要地位,分析其與臨床資料、預后的關系有助于臨床病情及預后評估。本研究結果顯示,不同外周血ALC、AMC水平患者血清Hb、LDH、β2-MG等臨床參數存在一定差異,提示MM患者機體ALC、AMC等免疫狀態與病程、身體狀態等指標相關。既往已有多個研究證實腫瘤免疫微環境與病情進展密切相關:杜德曉等[6]人研究證實術前LMR與胃癌患者臨床分期、淋巴結轉移相關,是淋巴結轉移的獨立影響因素;國外一項研究也證實ALC、LMR與乳腺癌分期等臨床參數相關[7];本研究與前人研究結果類似。MM患者預后存在一定異質性,這一過程受多種因素影響。本研究結果顯示,低ALC、高AMC、低LMR患者預后較差,多因素分析也提示在校正其他因素后,低ALC、LMR是MM患者預后不良的獨立影響因素。既往有部分研究開展了ALC、AMC、LMR水平與MM患者預后的相關性研究:井瑤瑤等[8]納入的一項研究發現,LMR≤3.11的患者生存時間明顯縮短,預后相對較差;李涵等[9]研究證實,高ALC(≥1.24×109L-1)、低AMC(≤0.60×109L-1)、高LMR(>3.90)MM患者5年OS、無進展生存期均明顯延長,本研究所選取的截點值雖與前人存在一定差異,但也證實ALC、AMC、LMR水平與MM患者預后存在一定程度相關。
分析ALC、AMC、LMR與臨床參數、預后相關的原因,可能為一方面機體免疫狀態反映機體對抗腫瘤細胞增殖、擴散的能力,ALC、LMR較低的患者抗腫瘤免疫應答效應被抑制,腫瘤細胞惡性增殖活動加快,預后不佳;另一方面,淋巴細胞作為適應性免疫效應細胞,其功能被抑制也預示著機體對細菌、病毒等的抵抗能力減低,患者極易出現感染等其他影響患者預后的疾病,國內一項研究表明,較低的淋巴細胞計數是MM患者化療后發生醫院感染的獨立危險因素,也是增加患者死亡率的重要因素[10];另外,機體免疫功能也與化療后毒副反應發生率相關,這些毒副反應一方面降低治療效果,也可影響患者化療依從性,進一步降低預后。
綜上,MM患者ALC、AMC、LMR水平與臨床參數及預后相關,這些指標獲取較為便利、廉價,臨床可根據指標初步評估及預測患者預后,指導臨床治療。本研究存在一定局限性,本研究樣本量較少,隨訪時間較短,且缺少部分患者遺傳學資料,因此較難明確ALC、AMC、LMR水平與遺傳學異常的關系,未來仍有待進一步擴大樣本量、完善遠期隨訪資料進行驗證。

