復(fù)配精油納米乳霧化處理對(duì)馬鈴薯發(fā)芽的抑制作用及機(jī)理探討
李子和,夏泆斌,張忠,畢陽,喬彩紅,李斌山,WILLIAM OYOM
(甘肅農(nóng)業(yè)大學(xué) 食品科學(xué)與工程學(xué)院, 甘肅 蘭州,730000)
馬鈴薯作為全球四大糧食作物之一,其在貯藏期間會(huì)進(jìn)入休眠狀態(tài)。休眠是植物通過進(jìn)入生長暫停狀態(tài)來應(yīng)對(duì)外界脅迫的一種生理反應(yīng)[1]。當(dāng)馬鈴薯的休眠被打破時(shí)其芽就會(huì)萌發(fā)。傳統(tǒng)控制馬鈴薯在貯藏期間發(fā)芽的主要方法是使用化學(xué)抑制劑。氯苯胺靈(3-chlorophenyl carbamicacid,CIPC)是馬鈴薯貯藏中最有效的芽抑制劑,已經(jīng)使用了40多年[2]。然而,大量濫用包括CIPC在內(nèi)的合成化學(xué)抑制劑會(huì)對(duì)環(huán)境造成許多問題,并影響到其他生物[3]。因此人們對(duì)尋找新的安全高效的馬鈴薯發(fā)芽抑制劑越來越感興趣。植物精油已被證明可以抑制馬鈴薯塊莖的發(fā)芽。薄荷精油可以抑制不同品種馬鈴薯塊莖的發(fā)芽[4],并較CIPC處理能夠使馬鈴薯塊莖保有更高的水分,降低塊莖的失重率[5];薄荷精油的主要成分薄荷醇,已被研制為有效的馬鈴薯發(fā)芽抑制劑[6];添加迷迭香精油還更多保留了馬鈴薯塊莖中的抗壞血酸和總多酚,從而維持了其抗氧化活性[7];香茅精油可以抑制馬鈴薯的發(fā)芽,讓其在10 ℃以下存放60 d而不發(fā)芽[8]。
直接使用精油來抑制馬鈴薯發(fā)芽需要較高劑量才能達(dá)到預(yù)期效果,這會(huì)導(dǎo)致塊莖感官品質(zhì)降低,增加塊莖處理成本。精油具有不穩(wěn)定性、高疏水性和揮發(fā)性等特點(diǎn)。因此,許多研究對(duì)于精油在微膠囊、微球、納米乳、脂質(zhì)體等多種分散體系中的包合性進(jìn)行了評(píng)價(jià),旨在提高精油的分散性,通過緩釋降低揮發(fā)損失,提高其生物效能[9]。崔婷的研究發(fā)現(xiàn)以白芨多糖作為壁材包埋的桂花精油保持了原有的抗氧化活性并與壁材產(chǎn)生協(xié)同作用[10];任婧楠等發(fā)現(xiàn)使用甜橙精油制成的納米乳液對(duì)于多種細(xì)菌具有良好的抑制作用[11]。活性氧代謝是控制馬鈴薯塊莖休眠與發(fā)芽的一個(gè)重要因素。
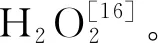
“隴薯7號(hào)”馬鈴薯塊莖是晚熟品種,其休眠期長達(dá)4個(gè)月[22],出于控制實(shí)驗(yàn)周期的目的,我們選用貯藏在10 ℃條件下120 d的“隴薯7號(hào)”商品薯[23]進(jìn)行實(shí)驗(yàn)。為了控制精油抑芽處理的成本,本試驗(yàn)將4種傘形科植物精油進(jìn)行復(fù)配制備出復(fù)配精油納米乳,并選用霧化的方式對(duì)馬鈴薯塊莖進(jìn)行處理,探究復(fù)配精油納米乳(mixed essential oil nanoemulsion,MEON)處理對(duì)馬鈴薯塊莖抑芽的影響,從氧化抗氧化內(nèi)穩(wěn)態(tài)平衡維持的角度探討其抑制發(fā)芽的機(jī)理,對(duì)馬鈴薯塊莖的發(fā)芽率、失重率、H2O2含量進(jìn)行測定,并對(duì)關(guān)鍵抗氧化物質(zhì)和酶活的變化進(jìn)行了評(píng)價(jià),找到一種新的天然馬鈴薯塊莖抑芽劑。
1 材料與方法
1.1 試驗(yàn)材料
4種傘形科植物種子孜然(CuminumcyminumL.)、芫荽(CoriandrumsativumL.)、葛縷子(Carumcarvi)和蒔蘿(AnethumgraveolensL.)分別產(chǎn)自甘肅省酒泉市玉門飲馬農(nóng)場、甘肅省酒泉市玉門飲馬農(nóng)場、山東省山東省萊蕪市金簍種植專業(yè)合作社和山東省萊蕪市正香園香辛料種植專業(yè)合作社。
供試馬鈴薯‘隴薯7號(hào)’由甘肅省定西市愛蘭馬鈴薯種業(yè)有限責(zé)任公司香泉基地提供,采收當(dāng)天運(yùn)回實(shí)驗(yàn)室,4 ℃冷庫貯藏至第二年春季實(shí)驗(yàn)待用。
1.2 方法
1.2.1 精油的提取及復(fù)配
采用水蒸餾法提取精油。將不同原料分別用高效植物樣品粉碎機(jī)粉碎。物料粉與蒸餾水按1∶10的料液比加入,蒸餾3 h停止加熱。油水分離收集精油并用無水硫酸鈉干燥,4 ℃保存。復(fù)配精油按照本實(shí)驗(yàn)室的方法分別用孜然精油58.3%、芫荽精油14.1%、蒔蘿精油23.7%、葛縷子精油3.9%進(jìn)行復(fù)配。
1.2.2 超聲波法制備復(fù)配精油納米乳
在室溫下,用去離子水制備不同質(zhì)量分?jǐn)?shù)的Tween80,將Tween80與復(fù)配精油以8∶1的比例混合,在45 ℃下用磁力攪拌器以2 000 r/min混合2 min至均勻,形成粗乳液。使用超聲波細(xì)胞破碎儀對(duì)粗乳進(jìn)行20 min的超聲均質(zhì)。在均質(zhì)過程中,將乳劑置于冰中,防止超聲過熱破壞乳液。
1.2.3 復(fù)配精油納米乳對(duì)馬鈴薯塊莖的霧化處理
參照李永才等[24]的方法并稍作修改進(jìn)行發(fā)芽實(shí)驗(yàn)。選取4 ℃條件下貯藏4個(gè)月待用的“隴薯7號(hào)”馬鈴薯塊莖,在10 g/L的次氯酸鈉溶液中浸泡5 min進(jìn)行消毒,無菌水沖洗3次,晾干。處理組用3.5、7 μL/mL的納米乳霧化處理10 min,對(duì)照組用無菌水霧化處理10 min。每組處理12個(gè)塊莖,實(shí)驗(yàn)重復(fù)3次。將處理好的馬鈴薯放置在適宜的發(fā)芽條件下(溫度20 ℃,避光,相對(duì)濕度90%)[12,25]進(jìn)行貯藏,于第10天觀察其發(fā)芽情況,具有至少一個(gè)長于3 mm的芽的塊莖被認(rèn)為是發(fā)芽馬鈴薯塊莖。
測定指標(biāo):
(1) 發(fā)芽率的測定:按芽眼數(shù)計(jì)算,如公式(1)所示:

(1)
(2) 失重率的測定:采用差量法,如公式(2)所示:

(2)
1.2.4 馬鈴薯芽眼部位取樣
選擇健康、新鮮的馬鈴薯塊莖,在1%的次氯酸鈉溶液中浸泡5 min進(jìn)行消毒,無菌水沖洗3次,晾干,12個(gè)為一組放置在10 L的密閉保鮮盒中。處理組在室溫下用3.5、7 μL/mL納米乳熏蒸處理10 min,對(duì)照組用無菌水熏蒸處理10 min。每個(gè)處理組12個(gè)塊莖,實(shí)驗(yàn)重復(fù)3次。于處理后第0天、第3天、第6天和第9天取馬鈴薯芽眼部位組織3 g。用錫箔紙包裝后液氮冷凍并在-80 ℃貯藏待用。
1.2.5 芽眼部位H2O2含量的測定
H2O2含量的測定參考PROCHAZKOVA等[26]的方法并修改。H2O2含量的測定是通過鈦-過氧化氫絡(luò)合物的形成進(jìn)行評(píng)估的。將2 g塊莖組織粉末與預(yù)冷丙酮混勻,提取10 min,在4 ℃,8 000×g條件下離心30 min。取出1 mL的上清液,先后加入100 μL 20% TiCl4(溶于體積分?jǐn)?shù)37%濃HCl)和100 μL濃氨水,均質(zhì)10 min,繼續(xù)離心10 min,保留沉淀,將沉淀用預(yù)冷丙酮洗滌3次,最后用2.0 mL 1 mmol/L H2SO4溶液進(jìn)行溶解,在410 nm處測定溶液的OD值。通過標(biāo)準(zhǔn)曲線計(jì)算出H2O2的含量,以mmol/g表示。
1.2.6 關(guān)鍵抗氧化相關(guān)酶活的測定
SOD活性的測定參考PROCHAZKOVA等[26]的方法并改進(jìn)。取2 g塊莖組織粉末于50 mmol/L磷酸緩沖液中提取10 min,在4 ℃條件下,8 000×g離心30 min,取上清液用于SOD活性的測定。酶活測定體系包括:1.5 mL 50 mmol/L磷酸緩沖溶液(pH 7.8),200 μL 100 mmol/L的蛋氨酸,100 μmol/L EDTA-Na2,750 μmol/L的氮藍(lán)四唑,200 μL的粗酶液,100 μL的核黃素。對(duì)照以緩沖溶液代替酶液,在15 000 lx日光燈下反應(yīng)結(jié)束后于560 nm處分別測定吸光度值。以每克鮮重抑制氮藍(lán)四唑光化還原的50%為一個(gè)酶活性單位來表示SOD的活性。
CAT活性的測定參考FAN等[27]方法并修改。取2 g塊莖組織粉末,加入5 mL 0.1 mol/L磷酸緩沖液(pH 7.5,含有5 mmol/L二硫蘇糖醇和20 g/L PVPP),振蕩混勻,冰浴條件浸提10 min,于4 ℃、8 000×g的條件下離心30 min,取上清液測定CAT活性。酶活反應(yīng)體系包括:2 mL 10 mmol/L H2O2(用50 mmol/L pH 7.5的磷酸緩沖液配制)和100 μL粗酶液。在240 nm處測定反應(yīng)體系120 s內(nèi)的吸光值變化。CAT活性以U/g FW來表示。
PPO活性的測定參照NETSANET等[28]的方法并改進(jìn)。反應(yīng)體系由2 mL 50 mmol/L的醋酸緩沖溶液(pH 5.5)、200 μL酶液和0.6 mL 1 mol/L鄰苯二酚溶液組成。從加入酶液啟動(dòng)反應(yīng)1 min后,開始記錄每秒鐘反應(yīng)體系在420 nm的吸光度值,連續(xù)測定2 min。以每分鐘ΔOD420為一個(gè)酶活單位U,即PPO酶活性表示為U/g FW。
POD活性的測定參照TEREFE等[28]的方法并改進(jìn)。反應(yīng)體系由2.6 mL 25 mmol/L愈創(chuàng)木酚溶液[用50 mmol/L醋酸緩沖液(pH5.5)配制]、0.2 mL 250 mmol/L H2O2溶液和0.4 mL酶液組成。加酶液啟動(dòng)反應(yīng)后1 min開始記錄每秒鐘反應(yīng)體系在470 nm的吸光度值,連續(xù)測定2 min。以每分鐘ΔOD470為一個(gè)酶活單位U,即POD酶活性表示為U/g FW。
1.2.7 關(guān)鍵抗氧化物質(zhì)的測定
氧化型谷胱甘肽(glutathione disulfide,GSSG)含量的測定參照王立梅等[29]的方法進(jìn)行,氧化型谷胱甘肽(glutathione disulfide,GSSG)含量采用試劑盒2-VP法測量,GSSG的含量表示為μmol/g FW。
還原性谷胱甘肽(reduced glutathione,GSH)含量的測定參照王立梅等[29]的方法進(jìn)行,通過[5,5′-Dithiobis(2-nitrobenzoic acid),DTNB]與GSH反應(yīng)生成復(fù)合物,在412 nm處有特征吸收峰;其吸光度與GSH含量成正比,采用相應(yīng)試劑盒測量,GSH的含量表示為μmol/g FW。
還原型煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)的含量參考LIU等[12]的方法使用試劑盒進(jìn)行測定,NADPH在堿性條件下穩(wěn)定,0.1 mol/L HCl和0.1 mol/L NaOH可將煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)和NADPH分開。NADP可被6-磷酸葡萄糖脫氫酶還原為NADPH,NADPH通過吩嗪硫酸甲酯的遞氫作用,使氧化型噻唑藍(lán)還原為甲臜,高濃度的NaCl可使酶反應(yīng)終止,并使甲臜沉淀下來,加入體積分?jǐn)?shù)96%乙醇使之溶解,顯紫色,570 nm下檢測吸光值,吸光值的高低與NADP和NADPH的含量高低成正比,NADPH的含量表示為mol/g FW。
總酚含量的測定根據(jù)ISABEL等[30]的方法稍作修改,在室溫下,將100 mg樣品溶于1 mL含1%(體積分?jǐn)?shù))HCl的80%(體積分?jǐn)?shù))甲醇溶液,在設(shè)定為200 r/min的軌道搖床上萃取2 h。以1 000×g離心15 min,收集上清液用于酚類測定。酚類物質(zhì)的測定:取100 μL提取液到5 mL容量瓶中與0.75 mL FolinCiocalteu試劑(之前用蒸餾水稀釋10倍)混合,在22 ℃下靜置5 min后;向混合物中加入0.75 mL Na2CO3溶液(60 g/L),在22 ℃ 90 min后于725 nm處測定吸光值,制定沒食子酸標(biāo)準(zhǔn)曲線評(píng)估總酚含量,表示為mg/100mg FW。
總黃酮含量的測定參考鐘秋平等[31]的方法并稍作修改,將100 mg樣品溶于1 mL含1%體積分?jǐn)?shù)HCl的80%體積分?jǐn)?shù)甲醇溶液,在設(shè)定為200 r/min的軌道搖床上萃取2 h。以1 000×g離心15 min,收集上清液用于總黃酮測定。總黃酮類物質(zhì)測定:取0.5 mL提取液至10 mL離心管,加入0.2 mL 50 g/L NaNO2溶液,搖勻,常溫下反應(yīng)6 min,加入0.2 mL 100 g/L Al(NO3)3溶液,常溫下反應(yīng)6 min,加入40 g/L NaOH溶液2 mL,常溫下反應(yīng)15 min,蒸餾水定容至5 mL。以乙醇為對(duì)照,測定在510 nm處的OD值,表示為mg/100mg FW。
1.2.8 數(shù)據(jù)統(tǒng)計(jì)
本實(shí)驗(yàn)采用Origin 2017和SPSS 19.0統(tǒng)計(jì)分析軟件進(jìn)行數(shù)據(jù)統(tǒng)計(jì)處理并作圖。
2 結(jié)果與分析
2.1 復(fù)配精油納米乳熏蒸抑制馬鈴薯發(fā)芽
不同濃度的復(fù)配精油納米乳處理馬鈴薯,馬鈴薯的發(fā)芽率有明顯變化而失重率沒有顯著變化。可見復(fù)配精油納米乳處理可以抑制馬鈴薯的發(fā)芽,并且塊莖對(duì)復(fù)配精油納米乳有濃度依賴性,當(dāng)濃度為3.5 μL/mL和7.0 μL/mL時(shí)發(fā)芽率為37.7%和26.6%,相比對(duì)照組發(fā)芽率53.3%有明顯降低,表明馬鈴薯塊莖對(duì)復(fù)配精油納米乳具有濃度依賴性且不同濃度的復(fù)配精油納米乳對(duì)于抑制馬鈴薯塊莖發(fā)芽都具有抑制作用(圖1)。
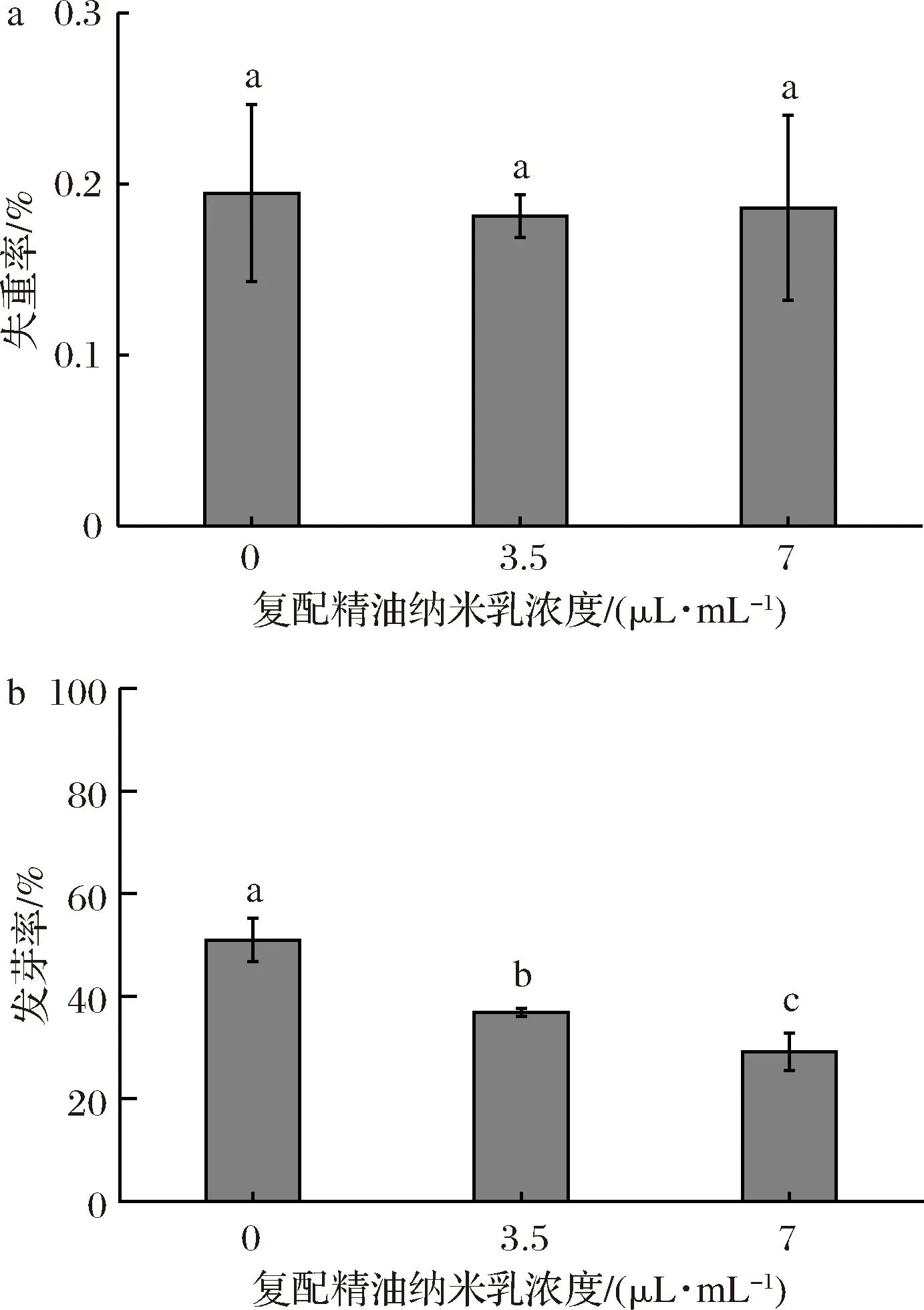
a-失重率;b-發(fā)芽率
2.2 復(fù)配精油納米乳霧化降低了馬鈴薯芽眼部位的H2O2含量
復(fù)配精油納米乳處理的馬鈴薯塊莖芽眼部位H2O2含量有明顯的變化。對(duì)照組和處理組呈現(xiàn)出先下降后上升的趨勢,在0 d時(shí)對(duì)照組和處理組沒有顯著差異,在3 d時(shí)3.5 μL/mL復(fù)配精油納米乳處理的H2O2含量是對(duì)照組2.07倍,7.0 μL/mL復(fù)配精油納米乳處理的H2O2含量事對(duì)照組的2.96倍,而在9 d時(shí)2個(gè)處理組的H2O2含量分別低于對(duì)照組19%和31.7%。MOHAMMED等[14]發(fā)現(xiàn)H2O2的提高能夠縮短休眠時(shí)間,馬鈴薯休眠時(shí)H2O2含量會(huì)有短暫顯著的增加,促進(jìn)馬鈴薯發(fā)芽,本實(shí)驗(yàn)中處理組的H2O2含量明顯低于對(duì)照組的H2O2含量,這會(huì)有助于延長馬鈴薯塊莖的休眠時(shí)間且抑制馬鈴薯塊莖的發(fā)芽(圖2)。
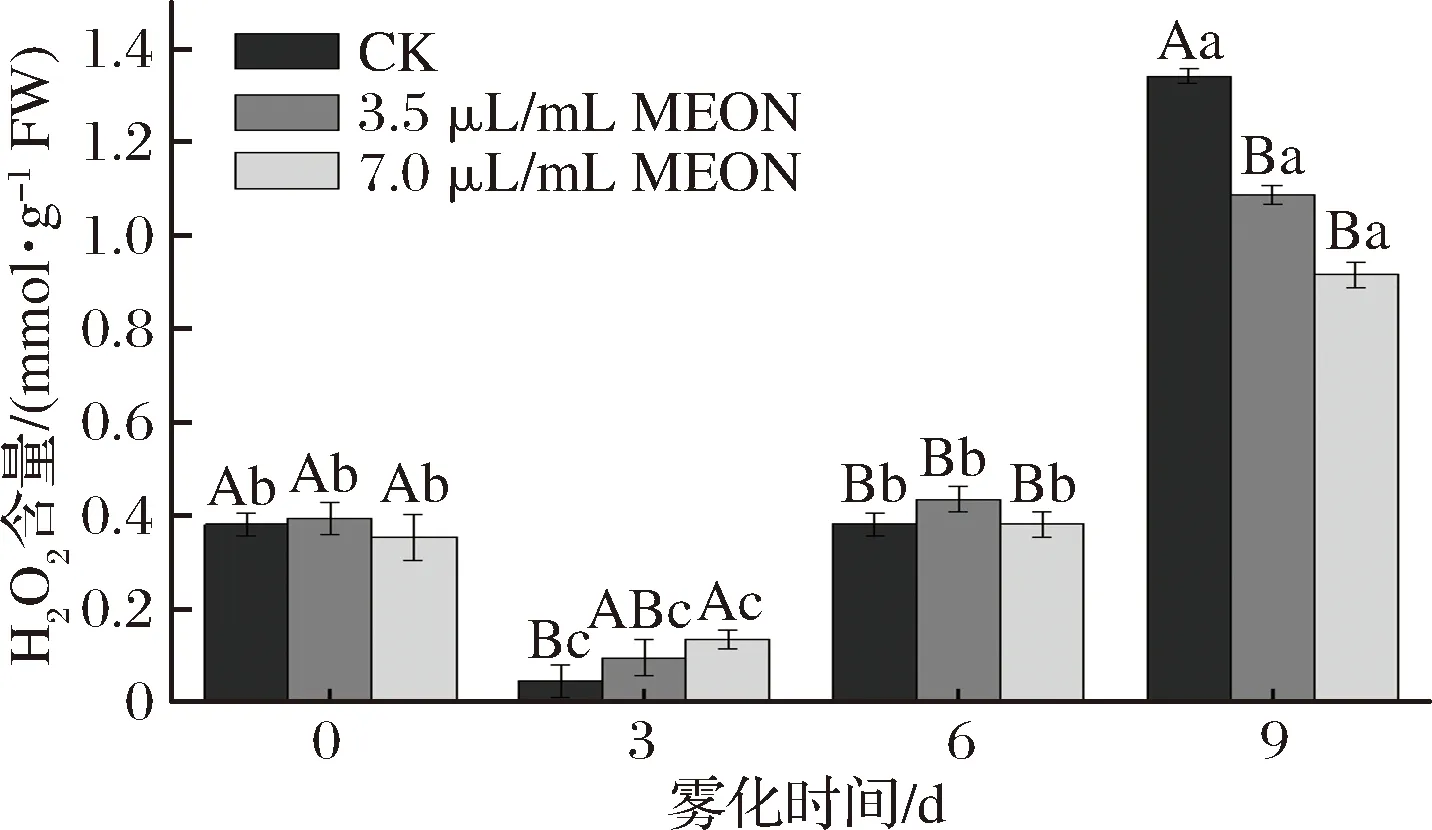
圖2 納米乳霧化改變馬鈴薯芽眼部位的H2O2含量
2.3 復(fù)配精油納米乳霧化改變了馬鈴薯芽眼部位關(guān)鍵抗氧化酶活性
SOD的活性呈現(xiàn)先下降后上升的趨勢,7.0 μL/mL復(fù)配精油納米乳處理能夠減緩SOD活性的降低。在3 d時(shí)2種濃度的復(fù)配精油納米乳處理的SOD活性都明顯高于對(duì)照組;在6 d時(shí)7.0 μL/mL復(fù)配精油納米乳處理組的SOD活性最高,是對(duì)照組的1.42倍。6 d后對(duì)照組和處理組皆有下降趨勢。BAKER等[15]發(fā)現(xiàn)SOD作為一種活性氧清除酶對(duì)于活性氧的積累具有抑制作用,而在本實(shí)驗(yàn)中觀察到6 d時(shí)高濃度處理組的SOD活性與對(duì)照組相比有明顯的提高,說明SOD活性的升高對(duì)塊莖的發(fā)芽有抑制作用(圖3)。
CAT的活性表現(xiàn)出先下降后上升再下降的趨勢。在6 d時(shí)處理組與對(duì)照組的CAT活性差異達(dá)到最大,3.5 μL/mL和7.0 μL/mL復(fù)配精油納米乳處理的CAT活性分表高于對(duì)照組16.5%和58.3%。MOHAMMED等[14]研究發(fā)現(xiàn)抑制CAT的活性可以減緩馬鈴薯的休眠打破,延緩馬鈴薯芽的生長,這與本實(shí)驗(yàn)所得到的結(jié)果一致,可以說明CAT活性的抑制延長了馬鈴薯塊莖的休眠時(shí)間從而抑制了馬鈴薯塊莖的發(fā)芽(圖3)。
POD的活性呈現(xiàn)先上升再下降的趨勢。在前3 d,復(fù)配精油納米乳處理組和對(duì)照組的POD活性都有所升高;在3 d時(shí)復(fù)配精油納米乳處理組和對(duì)照組的POD活性都達(dá)到峰值,7.0 μL/mL復(fù)配精油納米乳處理組的POD活性高于對(duì)照組23.1%。GRAHAM等[16]認(rèn)為POD作為一類氧化還原酶具有清除H2O2的能力,本實(shí)驗(yàn)則發(fā)現(xiàn)高濃度處理組的POD活性要高于低濃度處理組和對(duì)照組的POD活性,結(jié)果與預(yù)期一致,說明POD抑制了H2O2積累,減緩了ROS積累以抑制馬鈴薯塊莖的發(fā)芽(圖3)。
塊莖的PPO活性整體呈現(xiàn)上升的趨勢。從3 d開始7.0 μL/mL的復(fù)配精油納米乳處理組的PPO活性在3 d、6 d、9 d時(shí)分別高于對(duì)照組24.3%、29.5%、29.5%。SOLOMON等[17]認(rèn)為PPO是一種含銅金屬酶,其催化酚依賴于氧的氧化形成醌,其與氧分子的結(jié)合密切相關(guān),并通過芬頓反應(yīng)產(chǎn)生ROS。本實(shí)驗(yàn)發(fā)現(xiàn)在馬鈴薯塊莖的發(fā)芽過程中高濃度處理組的PPO活性高于低濃度處理組和對(duì)照組的PPO活性,可以說明PPO活性的提高與ROS的生成為負(fù)相關(guān)的關(guān)系,進(jìn)一步說明PPO活性的提高抑制了馬鈴薯塊莖的發(fā)芽(圖3)。

a-SOD活性;b-CAT活性;c-POD活性;d-PPO活性
2.4 復(fù)配精油納米乳提高了馬鈴薯塊莖的NADPH含量
NADPH的含量表現(xiàn)為先下降后上升的趨勢,在前3 d復(fù)配精油納米乳處理的馬鈴薯的NADPH含量與對(duì)照組無明顯差異,在6 d時(shí)3.5 μL/mL和7.0 μL/mL的復(fù)配精油納米乳處理組NADPH含量分別高于對(duì)照組10%和15.2%。并且在9 d時(shí)對(duì)照組和7.0 μL/mL處理組的NADPH的含量到達(dá)整個(gè)貯藏期的峰值,且7.0 μL/mL處理組的NADPH高于對(duì)照組16.4%。莘冰茹[21]提出NADPH是一種極為重要的核苷酸類輔酶,其作為供氫體為維持還原型谷胱甘肽穩(wěn)定有著重要作用,并且還在維持硫氧還蛋白系統(tǒng)的活性,參與細(xì)胞轉(zhuǎn)導(dǎo)和抗氧化防御中充當(dāng)重要的角色,本實(shí)驗(yàn)測得高濃度處理組的NADPH含量在6 d開始明顯高于對(duì)照組,這可能有助于GSH狀態(tài)的穩(wěn)定。GSH屬于細(xì)胞壁的次生代謝產(chǎn)物,其具有使ROS失活的作用[12],所以此實(shí)驗(yàn)結(jié)果證明NADPH含量的上升有助于抑制馬鈴薯塊莖的發(fā)芽(圖4)。
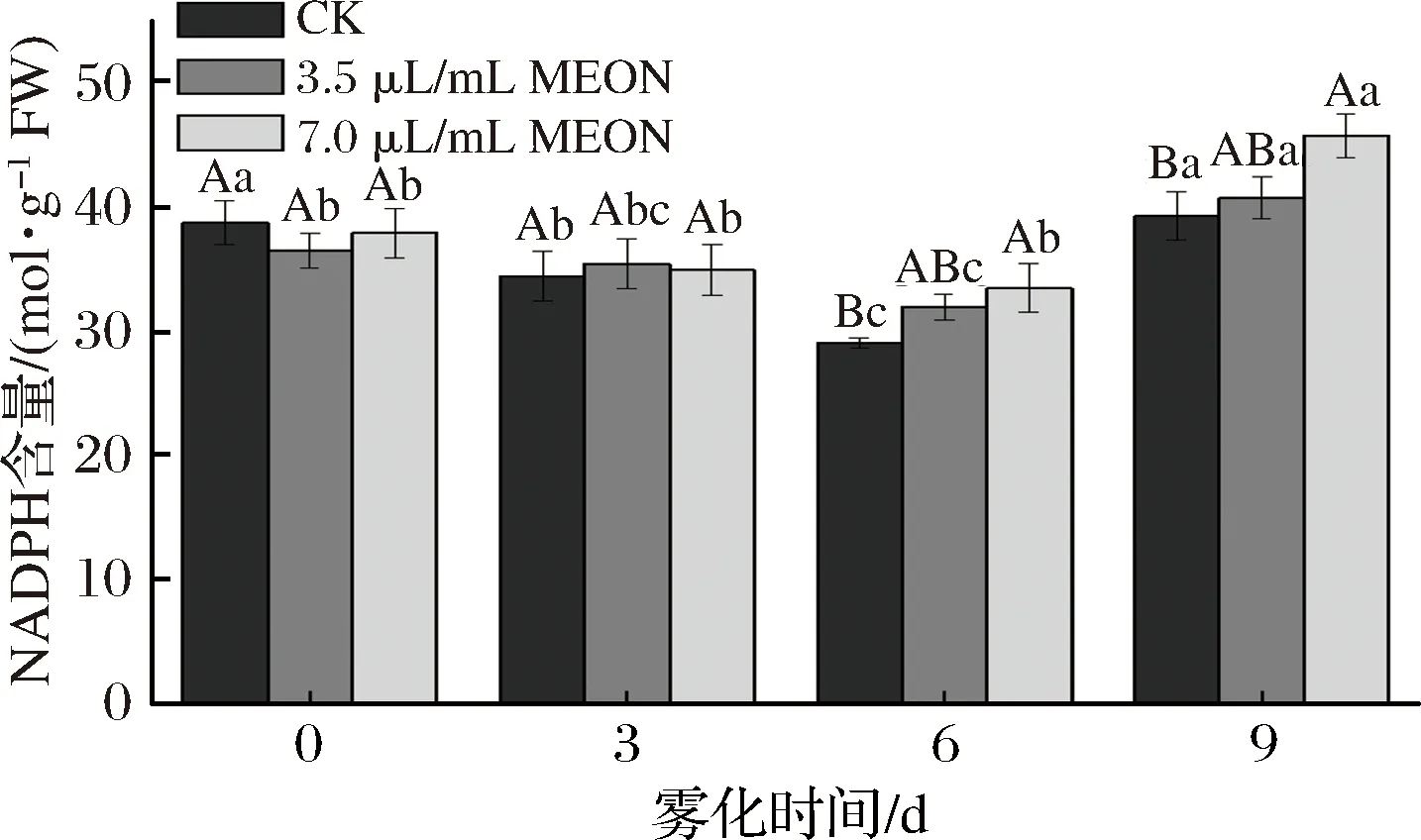
圖4 納米乳霧化干預(yù)芽眼部位的NADPH含量
2.5 復(fù)配精油納米乳降低了馬鈴薯總酚和總黃酮的含量
復(fù)配精油納米乳處理對(duì)馬鈴薯塊莖的總酚和總黃酮含量有明顯抑制。整個(gè)貯藏期間對(duì)照組總酚的含量呈現(xiàn)先上升在下降的趨勢,并且在6 d時(shí)到達(dá)峰值,對(duì)照組總酚含量高于3.5 μL/mL處理組58.2%,高于7.0 μL/mL處理組30.2%。總黃酮的含量隨時(shí)間延長呈現(xiàn)先降低后升高的趨勢,在3 d時(shí)出現(xiàn)最低值,7.0 μL/mL處理組的總黃酮含量是對(duì)照組的43%。LIU等[12]認(rèn)為總酚和總黃酮都屬于細(xì)胞壁的次生代謝產(chǎn)物,其性質(zhì)類似于GSH,由本實(shí)驗(yàn)得到的結(jié)果可以發(fā)現(xiàn)總酚和總黃酮在處理組馬鈴薯塊莖中的含量低于對(duì)照組馬鈴薯塊莖,證明了總酚和總黃酮含量的降低對(duì)于馬鈴薯塊莖發(fā)芽的抑制有正向作用(圖5)。
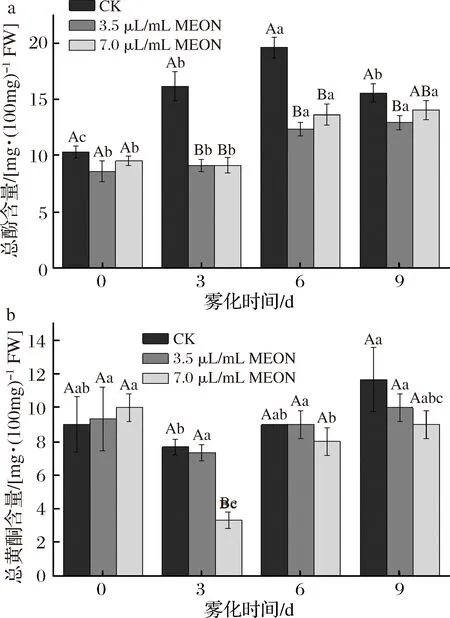
a-總酚含量;b-總黃酮含量
2.6 復(fù)配精油納米乳提高了還原型谷胱甘肽的含量
GSH的含量在整個(gè)貯藏期呈現(xiàn)先上升后穩(wěn)定的態(tài)勢,并在3 d時(shí)到達(dá)峰值,其中3.5 μL/mL復(fù)配精油納米乳處理組的GSH是對(duì)照組的1.77倍。復(fù)配精油納米乳處理對(duì)于GSSG含量的影響整體呈現(xiàn)下降態(tài)勢,從第3天開始可以看出2個(gè)濃度處理組與對(duì)照組的GSSG含量存在顯著差異,并且6 d后處理組的GSSG含量開始明顯低于對(duì)照組。這與上文中NADPH含量的實(shí)驗(yàn)以及LIU等[12]的研究結(jié)果基本一致,說明GSH含量上升抑制了ROS的生成,進(jìn)一步抑制了馬鈴薯塊莖的發(fā)芽(圖6)。

a-GSH含量;b-GSSG含量
3 結(jié)論
精油對(duì)于馬鈴薯塊莖的抑芽作用已經(jīng)得到證明,但是精油使用的高成本、感官差、時(shí)效短等缺點(diǎn)還未得到有效解決,本實(shí)驗(yàn)采用4種傘形科植物孜然、芫荽、葛縷子和蒔蘿的精油制備出的復(fù)配精油納米乳相較于精油具有更好的抑芽作用,采用霧化處理的方式有效提高了精油的利用率且降低了成本,但是對(duì)于氣味的影響尚無有效的應(yīng)對(duì)措施。4種傘形科植物孜然、芫荽、葛縷子和蒔蘿的精油制備出的復(fù)配精油納米乳具有較強(qiáng)的抑芽活性,能顯著抑制馬鈴薯的發(fā)芽,其機(jī)理可能是通過提高NADPH含量使細(xì)胞有充足的還原力,讓GSH在馬鈴薯塊莖的發(fā)芽過程中保持穩(wěn)定,并抑制了總酚和總黃酮含量來抑制ROS的活性;同時(shí)提高SOD、CAT、PPO和POD等關(guān)鍵抗氧化酶的活性,降低H2O2的含量,消除馬鈴薯塊莖中的ROS,來延長馬鈴薯塊莖的休眠時(shí)間,并使馬鈴薯芽的萌發(fā)受到抑制。但對(duì)于復(fù)配精油納米乳抑制馬鈴薯塊莖發(fā)芽的作用位點(diǎn)以及作用方式,還待進(jìn)一步研究。

