羧甲基化木聚糖的益生元作用研究
李霞,陳海鷗,韓淑芳,陸鳳瑩,周玉恒,單楊,李靜*
1(桂林理工大學 化學與生物工程學院,廣西 桂林,541006)2(廣西植物研究所,廣西 桂林,541006)3(湖南農科院農產品加工研究所,湖南 長沙,410125)
益生元是一種不易被人體消化,可改善宿主健康的有機物質,其能夠作為腸道菌群的發酵底物并選擇性刺激腸道內菌群的生長活動[1]。益生元可以刺激腸道物質運輸,增強對礦物質的吸收[2];也可改變腸道菌群結構,選擇性刺激腸道中有益菌,從而產生有益活動,如防御病原菌、改善腸炎等[3-5];益生元經過益生菌發酵利用,產生的發酵產物如短鏈脂肪酸,可增強宿主免疫[6]。此外,益生元也可通過其他間接性途徑發揮生物活性,如調理心血管疾病等[7]。
木聚糖(xylan,XY)主要來自于植物細胞壁中,是一種具有發展潛力的益生元。但木聚糖的分子質量較大,溶解度較低,功能性基團較少[8],目前主要是將其加工降解成低聚木糖或低聚果糖等[9-10]。研究表明,對木聚糖結構進行修飾,能夠提高其溶解性、表面活性及生物活性等[11]。羧甲基化是最廣泛和最常見的修飾方法之一,李和平等[12]制備的羧甲基蔗渣木聚糖熱穩定性明顯提高,且具有一定的表面活性;KONOURI等[13]探究發現對麥麩阿拉伯木聚糖的羧甲基化改性后,其理化性質發生顯著的變化。然而,有關羧甲基化木聚糖的益生元作用的研究鮮有報道。本試驗以木聚糖為原料,探索羧甲基化木聚糖(carboxymethyl xylan, CXY)對4種益生菌生長的益生元作用,對于充分利用農業食品廢渣和改善環境具有重要意義。
1 材料與方法
1.1 材料與試劑
XY,廣西植物研究所;檸檬酸氫二銨、MnSO4、乙酸鈉、2,7-二羥基萘等試劑均為國產分析純;低聚果糖(fructo digosaccharide,FOS)、牛肉浸粉、吐溫-80等試劑均為國內生物試劑。
1.2 儀器與設備
ALPHA1-2 LD型冷凍干燥機,德國Martin Christ 公司;LDZX-50KBS型立式壓力蒸汽滅菌器,上海申安醫療器械廠;LRH-250-Z型振蕩培養箱,韶關市泰宏醫療器械有限公司;IS10型傅立葉紅外光譜儀,美國Thermo Fisher公司。
1.3 實驗菌株
短乳桿菌GIM1.773(Lactobacillusbrevis)、植物乳桿菌GIM1.191(Lactobacillusplantarum)、德氏乳桿菌保加利亞亞種GIM1.155[Lactobacillusdelbrueckii(sub sp.)bulgaricus]、嗜熱鏈球菌GIM1.540(Streptococcusthermophilus),實驗室保存菌種。
1.4 培養基
1.4.1 基礎培養基
德氏乳桿菌保加利亞亞種、植物乳桿菌、短乳桿菌的基礎培養基:蛋白胨10.0 g,牛肉浸粉10.0 g,酵母浸粉5.0 g,檸檬酸二胺2.0 g,K2HPO42.0 g,MnSO40.05 g,MgSO40.30 g,吐溫-80 1.0 mL,葡萄糖 15.0 g,乙酸鈉5.0 g,加熱溶解后補加蒸餾水至1 000 mL,pH=6.5,121 ℃滅菌20 min。
嗜熱鏈球菌的基礎培養基:蛋白胨5.0 g,酵母浸粉10.0 g,CaCO31.0 g,KHPO42.0 g,葡萄糖15.0 g,L-半胱氨酸0.50 g,吐溫-80 1 mL,加熱溶解后補加蒸餾水至1 000 mL,調節pH=7.0,121 ℃滅菌20 min。
1.4.2 試驗培養基
分別以CXY、XY和FOS作為唯一碳源,取代基礎培養基中的葡萄糖,其他營養成分同基礎培養基。
1.5 實驗方法
1.5.1 CXY的制備
采用NaOH-氯乙酸化學法[14]。稱取6.0 g XY,溶于100 mL異丙醇和50 mL的200 g/L NaOH溶液中,冰水浴下攪拌3 h。將30.0 g氯乙酸溶于100 mL異丙醇中,與50 mL的200 g/L NaOH溶液相混合,得到混合溶液。將混合溶液緩慢滴入反應體系中,在60 ℃下攪拌4 h,停止反應,冷卻至室溫。用1 mol/L的HCl中和,流水透析24 h。濃縮,冷凍干燥,得到CXY。
1.5.2 紅外光譜測定
取1.0 mg干燥后的樣品,與100.0 mg的KBr 參照物混合,研磨,壓片,在4 000~400 cm-1用紅外光譜儀進行紅外光譜掃描,得到紅外光譜掃描圖。
1.5.3 取代度的測定
用二次水配制0.4 mg/mL的CXY溶液,取0.25 mL 0.4 mg/mL的CXY溶液與0.25 mL 濃H2SO4混勻,125 ℃下加熱3 h,再將2 mL 2,7-二羥基萘溶液(0.1 mg/mL)加入到混合液中,充分混勻,沸水浴20 min后停止反應,冷卻至室溫,最后加入2 mL 蒸餾水,以蒸餾水為對照,測定其在520 nm 處吸收值,平行測定3組[15]。用在CaCl2中干燥過夜的乙醇酸替代多糖樣品,制作標準曲線,計算1 g多糖樣品中乙醇酸的質量,記為A,CXY取代度計算如公式(1)所示:
(1)

1.5.4 消化性研究
1.5.4.1 模擬唾液消化的測定
模擬唾液(A):0.764 g NaCl、1.491 g KCl、0.133 g CaCl2用蒸餾水定容至1 000 mL,用1 mol/L的NaHCO3將pH調至6.9。稱取α-淀粉酶0.345 g加入400 mL A中溶解,磁力攪拌20 min后過濾,濾液中再加入400 mL的A溶液混勻。分別配制1 mg/mL CXY、XY和FOS溶液,按照V(多糖溶液)∶V(模擬唾液)=1∶1添加唾液,放于37 ℃的恒溫振蕩器中反應,以模仿口腔環境。在0和0.5 h時收集樣品,煮沸5 min以滅活酶。還原糖的測定采用二硝基水楊酸方法,總糖含量的測定采用苯酚-H2SO4法。水解度計算如公式(2)所示:

(2)
式中:水解的還原糖為某時間點取樣測得的還原糖含量與最初的還原糖含量之差,mg。
1.5.4.2 模擬胃液消化的測定
緩沖溶液的配制:分別稱Na2HPO4·H2O 8.25 g;NaH2PO414.35 g;NaCl 8.00 g;KCl 0.20 g;CaCl2·2H2O 0.10 g; MgCl2·6H2O 0.18 g,用蒸餾水溶解后定容至1 000 mL。再用1 mol/L HCl溶液將緩沖液的pH值分別調至1、 2、 3。分別稱取100 mg CXY、XY和FOS添加到10.0 mL上述緩沖溶液中,37 ℃水浴6 h。在反應4 h和6 h時,各取1.0 mL樣品溶液測定其中還原糖和總糖的含量。根據公式(2)計算水解度。
1.5.4.3 模擬小腸液消化的測定
模擬小腸液(B):分別稱取5.40 g NaCl,0.65 g KCl和0.33 g CaCl2,用蒸餾水溶解后定容1 000 mL。將13 mg胰蛋白酶,100 mL胰酶溶液(質量分數7%)和200 mL膽汁鹽(質量分數4%)與100 mL B液混合,并通過1 mol/L的NaHCO3調節至pH值為7。分別配制1 mg/mL CXY、XY和FOS溶液,按照V(多糖溶液)∶V(模擬小腸液)=1∶1添加模擬小腸液,在反應4 h和6 h,各取1.0 mL樣品溶液煮沸5 min以滅活酶,然后測定其中還原糖和總糖的含量。根據公式(2)計算水解度。
1.5.5 對4種益生菌增殖的影響
根據1.4.2,配制質量濃度分別為5、10、15、20、30 g/L的CXY、XY和FOS培養基,再分別接入100 μL充分活化的菌種,在37 ℃培養48 h,取樣測定各培養液在600 nm的OD值和培養基的pH值。
根據1.4.2,配制CXY、XY和FOS質量濃度為30 g/L的培養基,接入1%充分活化的菌種懸液,在 37 ℃培養48 h。以培養時間為橫坐標,OD600 nm為縱坐標,繪制4種菌的生長曲線。
1.6 數據分析
試驗結果均表示為平均值±標準差(X±SD),采用SPSS 17.0軟件進行分析,使用Origin 17.0軟件畫圖。
2 結果與分析
2.1 CXY的紅外光譜

CXY的取代度測定結果顯示,其標準曲線的回歸方程為y=16.256x+0.002 5,R2=0.993 6,計算得到取代度為0.68。
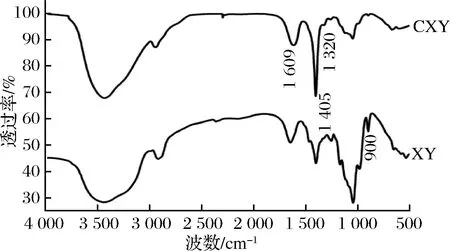
圖1 多糖的紅外光譜圖
2.2 CXY對抗消化性的影響
人體消化酶對碳水化合物的水解主要針對其中的α-糖苷鍵[17],紅外圖譜表明CXY中主要含有的是β-D糖苷鍵構型的木聚糖分子骨架,且在模擬唾液消化試驗中(表1),0.5 h后XY、CXY和FOS的水解度分別為8.49%、8.86%和5.25%,說明CXY能較好地抵抗模擬唾液的消化。
正常情況下,人體胃酸pH值為1~3,食物進入胃后停留時間為4~6 h[17-18]。多糖抵抗胃酸的水解到達大腸才能發揮益生元等作用。因此本試驗采用不同pH值的模擬胃液對XY、CXY和FOS進行水解,分析CXY作為益生元的可能性。如表1所示,在水解4 h后,pH值為1的模擬胃液中,XY、CXY和FOS的水解度達到最大值,分別為2.00%,1.49%和2.98%。在水解6 h后,pH值為1的模擬胃液中,XY、CXY和FOS的水解度達到最大值,分別為4.07%,4.16%和3.19%。CXY在模擬胃液中的水解度<5%,表明CXY在胃中有較好的穩定性,可抵抗胃液消化。試驗結果與紹興黃酒多糖[18]以及霍山石斛多糖[19]的抗消化性研究結果一致。
在模擬小腸液消化試驗中,在水解4 h后,XY、CXY和FOS的水解度分為3.15%、0.88%和1.35%。在水解6 h后,XY、CXY和FOS的水解度分為3.56%、5.82%和2.82%。CXY在模擬小腸液中的水解度<6%,表明CXY能夠抵抗小腸液消化。以上結果表明,CXY可以較好的抵抗人體消化道消化。

表1 CXY的溶解性和在模擬唾液、胃液和小腸液中的水解度 單位:%
2.3 CXY對益生菌生長的影響
2.3.1 不同濃度CXY對益生菌生長的影響
多糖對益生菌的生長情況如圖2-a~圖2-d所示,CXY對4種菌的生長均有一定的促進作用。圖2-a中,以短乳桿菌為例,在不同碳源的培養基中,CXY的增殖效果顯著大于XY組(P<0.05),且在多糖質量濃度為30 g/L時增殖效果最佳。圖2-b~圖2-d中,CXY多糖質量濃度為30 g/L時對植物乳桿菌、德氏乳桿菌保加利亞亞種和嗜熱鏈球菌的增殖效果極其顯著(P<0.01)。分析原因可能是溶解性的影響,CXY的溶解性優于XY,溶解度高的多糖更有利于益生菌消化利用,促進益生菌增殖[17]。已有研究表明多糖的水溶性和生物活性隨著羧甲基取代度的增加而增大,而多糖在水中的溶解度會影響其益生元效果[20-21]。
益生菌的生長會引起菌液pH值的變化,通過測定液體培養基的pH值,可直觀地觀察出不同菌種的生長情況。如圖2-e~圖2-h所示,隨著多糖濃度的增加,所有組的pH值均呈現下降趨勢。在質量濃度為3%時到達最小值,且pH<4.9,其中短乳桿菌組菌液pH值最低,為4.23。CXY對短乳桿菌和植物乳桿菌的產酸影響較明顯,CXY質量濃度為5~20 g/L時,兩者pH值差異顯著(P<0.05)。德氏乳桿菌保加利亞亞種和嗜熱鏈球菌的pH均有下降,但下降趨勢不明顯。結果表明CXY能夠被4種實驗益生菌利用,產生酸性代謝產物。
2.3.2 CXY對益生菌生長曲線的影響
如圖3所示,CXY對4種益生菌的生長均有促進增殖作用。短乳桿菌和嗜熱鏈球菌在CXY為唯一碳源的培養基中,培養36 h后達到最大生長量,繼續培養,OD值基本保持穩定。植物乳桿菌在分別添加FOS、CXY和XY作為唯一碳源的培養基中,均在24 h后達到最大生長量,OD值分別為1.735、1.688和1.595。在CXY試驗培養基中,德氏乳桿菌保加利亞亞種在培養24 h后,OD值達到最大值(1.632),而在XY試驗培養基中,48 h后達到最大生長量。在相同濃度下,CXY對4種益生菌生長曲線的影響與FOS的作用相似,表明CXY有良好的促進腸道益生菌增殖潛力,可作為一種潛在的益生元。
CXY對益生菌的促進作用優于XY,但沒有FOS作用效果顯著,我們推測可能有以下幾種原因:(1)一般而言,分子質量小的多糖聚合度較低,易被益生菌分解和利用,從而發揮益生元效果[22],所以低聚合度的FOS對4種益生菌的增殖效果優于XY和CXY。(2)XY在修飾改性的過程中,可能發生一定的降解導致其分子質量和聚合度降低[13,23],所以羧甲基化修飾后的XY對益生菌的增殖優于XY。(3)羧甲基化修飾后的多糖溶解度增大,能夠更好的發揮功能活性[24],因此CXY的溶解度大于XY,更易被益生菌吸收、利用和代謝。多糖對益生菌的益生元效果是由多方面因素決定的,除聚合度、分子質量和溶解度外,多糖的單糖組成、結構復雜性,以及成分純度等都會影響其益生元效果[25-26]。
3 結論
通過NaOH-氯乙酸化學法制備得到CXY,對比研究CXY對4種益生菌的增殖效果以確定其作為益生元的潛力。試驗結果表明,紅外光譜圖分析表明木聚糖羧甲基化修飾成功,CXY可以抵抗人體消化道的水解,能夠進入腸道被4種實驗益生菌利用,在質量濃度為30 g/L時,增殖效果達到最佳。CXY對4種益生菌的促進作用稍弱于FOS,但優于XY,且作用顯著。CXY對不同益生菌的增殖作用不同,可能是不同益生菌分解利用益生元的能力不同。綜上所述CXY是一種潛在的益生元。
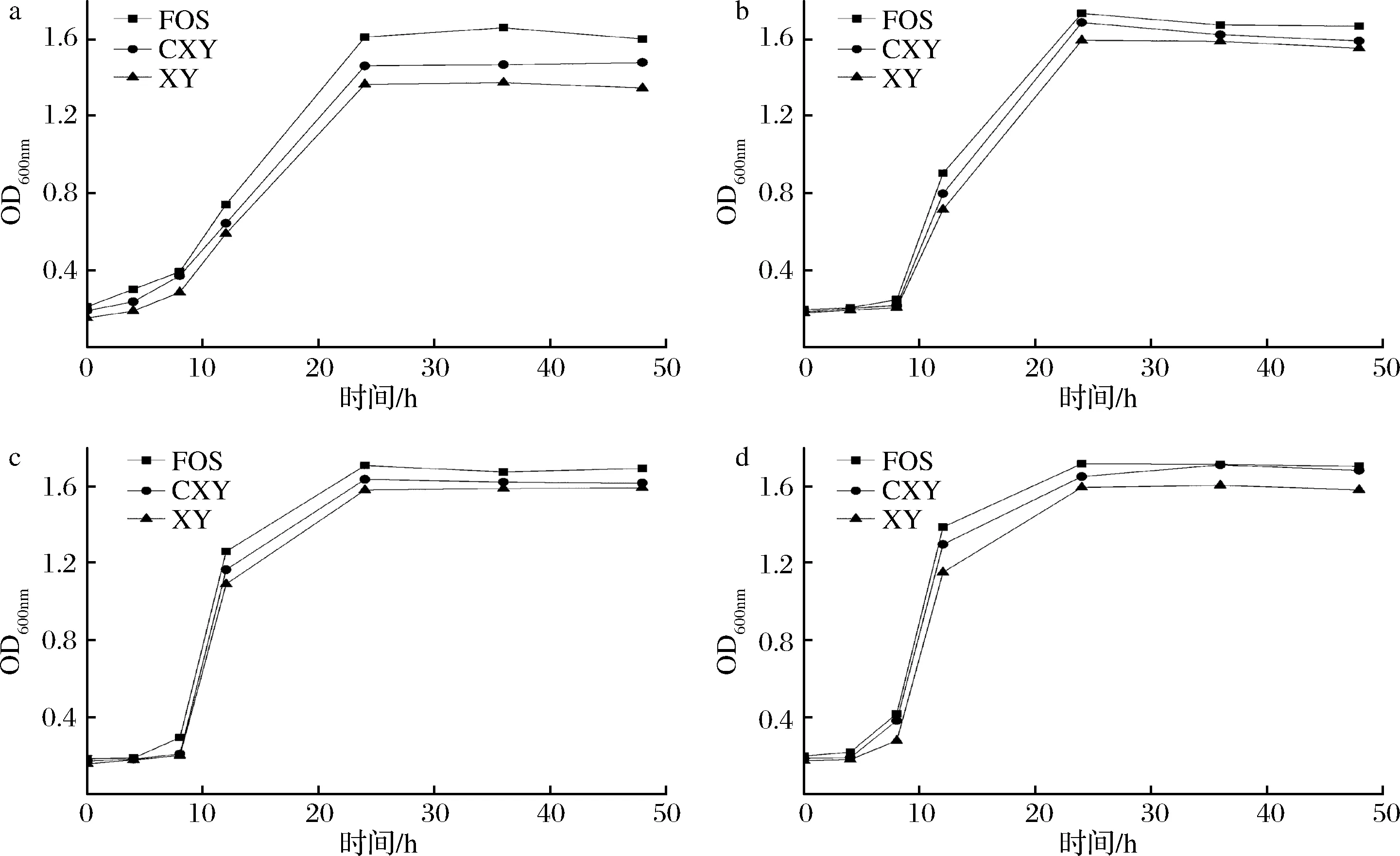
a-短乳桿菌;b-植物乳桿菌;c-德氏乳桿菌保加利亞亞種;d-嗜熱鏈球菌

