某院新生兒重癥監護病房早產兒腸外營養處方分析
孫靜,秦侃
(安徽醫科大學第三附屬醫院藥學部,合肥 230061)
新生兒重癥監護病房(neonatal intensive care unit,NICU)收治的多是病情嚴重的患兒如膿毒血癥、呼吸窘迫綜合征或者早產兒、超低出生體質量兒,出生后存在喂養不耐受、腸內營養無法滿足營養需求或者存在新生兒壞死性小腸結腸炎等胃腸道疾病需要禁食的情況,這時需要通過腸外營養(parenteral nutrition,PN)補充能量以滿足機體需求。腸外營養常被視為一種短期過渡手段,在可實施完全腸內營養之前提供營養支持。但腸內營養仍是推薦的營養方式,在患兒條件許可的情況下,要盡早開始腸內營養,當腸內營養可以滿足患兒需求時,應盡快停用腸外營養。
根據出生時胎齡分類,將胎齡(gestational age,GA)<37周的新生兒稱為早產兒。早產兒尤其是低出生體質量兒,胃腸道發育不健全,消化吸收能力較差,可能存在喂養不耐受,腸內營養不能滿足需求;早產兒進行追趕性生長,如果能量需求得不到滿足,可能導致宮外生長遲緩,尤其對神經系統等產生較大影響,如認知、行為能力受損;相反,如果營養攝入過多,也會增加患兒器官負擔,導致過度喂養,造成高血糖等[1]。對于早產兒即使饑餓1 d,損傷也是巨大的,且早產兒胃腸道功能弱,腸內營養不能很好耐受,因此國內外指南均指出早產兒出生后應及時建立腸外營養[2-3]。筆者通過分析我院NICU早產兒營養處方,了解存在的問題,以期反饋給臨床,促進NICU早產兒腸外營養的合理使用。
1 資料與方法
1.1研究對象 選取2017年8月1日—2018年8月1日入住我院NICU并使用腸外營養的早產兒,對其腸外營養方案進行收集和回顧性分析,納入標準:①出生后即入住NICU;②早產兒,即出生胎齡<37周;③入院期間使用腸外營養;排除入院時間<3 d的患兒。
1.2研究方法 采用回顧性調查,按照出生時胎齡進行分類,收集其性別、是否雙胎、分娩方式、母親是否有合并癥、出生體質量、出院體質量、腸外營養維持時間、氨基酸起始采用時刻、氨基酸起始劑量、脂肪乳起始采用時刻、脂肪乳起始劑量、體質量平均增長速度、住院時間、腸外營養組方等數據,按照《中國新生兒營養支持臨床應用指南》[2]以及國外新生兒營養相關指南和文獻進行評估分析。
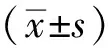
2 結果
2.1出生時基本資料 符合納入標準的早產兒共65例,總共統計腸外營養處方600張。按GA不同分為GA>34周和GA<34周兩組,分別為32和33例。
2.1.1早產兒出生時基本信息 符合納入標準的早產兒共65例,男41例(63.1%),女24例(36.9%);雙胎11例(16.9%),單胎54例(83.1%);剖宮產31例(47.7%),順產34例(52.3%);母親有并發癥者34例(52.3%),母親無并發癥者31例(47.7%);出生體質量(1.9±0.3) kg,出生身長(43.1±2.9) cm,出生頭圍(29.6±2.8) cm,出生胸圍(28.6±2.7) cm。65例使用腸外營養的患兒中,使用臍靜脈置管2例(3.1%),未用臍靜脈置管63例(96.9%)。
2.1.2GA>34周和GA<34周兩組早產兒出生時基本信息 兩組在性別、雙胎比例、分娩方式、母親合并癥比例比較差異無統計學意義;兩組在出生體質量、出生身長、出生頭圍和出生胸圍比較均差異有統計學意義(均P<0.05)。見表1。
2.2早產兒住院期間腸外營養使用情況 兩組早產兒在氨基酸起始采用時間、氨基酸起始劑量、脂肪乳起始采用時間、脂肪乳起始劑量的比較均差異無統計學意義(P>0.05)。見表2。
2.3兩組住院期間體質量增長速度、出院體質量、腸外營養維持時間、住院時間差異 兩組早產兒出院體質量差異無統計學意義,但體質量增長速度、腸外營養維持時間以及住院時間比較均差異有統計學意義(均P<0.05)。見表3。
2.4腸外營養處方的合理性 我院腸外營養的輸注途徑包括外周靜脈、經外周插入的中心靜脈導管(peripherally inserted central venous catheters,PICC)和臍靜脈,使用處方數分別為510,64,26張,早產兒常用的TPN處方藥品種類主要有如下幾種,①葡萄糖類:5%葡萄糖注射液、10%葡萄糖注射液、50%葡萄糖注射液;②脂肪乳類:20%中/長鏈脂肪乳注射液(C6-24);③氨基酸類:小兒復方氨基氨酸注射液(18AA- I);④電解質類:10%氯化鈉注射液、0.9%氯化鈉注射液、10%氯化鉀注射液;⑤維生素類:注射用維生素C 、脂溶性維生素注射液(Ⅱ)、注射用水溶性維生素、核黃素磷酸鈉。PN使用合理情況見表4。

表1 GA>34周和GA<34周兩組早產兒出生時基本信息比較

表2 GA>34周和GA<34周兩組早產兒腸外營養使用情況的比較

表3 兩組早產兒住院期間體質量增長速度、出院體質量、腸外營養維持時間以及住院天數的比較

表4 PN營養素使用情況
3 討論
3.1腸外營養輸注途徑及滲透壓 常用的腸外營養輸注途徑有兩種:外周靜脈營養(peripheral parenteral nutrition,PPN)和中心靜脈營養(central parenteral nutrition,CPN)。PPN可用于短期需要腸外營養支持的患兒,通常首選中心靜脈導管,因為相比于經外周靜脈導管給予腸外營養,中心靜脈導管如PICC可給予滲透壓更高的腸外營養溶液。使用中心靜脈導管還可增加營養素攝入量,降低更換導管的需求。PICC通常不需要全身麻醉就可以插入,并已證明對新生兒和兒童是安全的,盡管有少量和級別較弱的證據證明使用PICC置管超過14~21 d增加導管相關性血流感染[4]。
臍靜脈置管(umbilical vein catheter,UVC)是新生兒相較于嬰幼兒和成人特有的,新生兒出生3~5 d內,靜脈導管尚未閉合,經臍靜脈的插管一般可進入下腔靜脈建立靜脈通道。一項在出生體質量<1251 g的早產兒比較長期和短期使用臍靜脈置管的隨機研究中[5],長期組(臍靜脈置管28 d)104例與短期組(臍靜脈置管7~10 d后,換用PICC)106例,感染發生率、感染持續時間和其他相關并發癥均無明顯差異;有限的證據表明長期組臍靜脈置管14 d后,導管感染發生風險增加,具有潛在的臨床意義。一項關于極低出生體質量兒臍靜脈置管導致靜脈血栓發生的高危因素包括:出生的第1周,紅細胞壓積>55%是唯一顯著的、獨立相關的因素;對于極低出生體質量兒,胎齡較大的血栓發生率比胎齡小的高;臍靜脈置管時間越長,血栓的發生率越高[6]。綜上所述,臍靜脈置管多用于極低出生體質量兒,置管時間最好少于14 d。本研究65例患兒中有2例患兒使用臍靜脈置管給予腸外營養,均為極低出生體質量兒(體質量<1500 g),1例患兒臍靜脈置管14 d后改用外周靜脈,1例患兒臍靜脈置管14 d后改用中心靜脈,因此使用臍靜脈置管的人群及使用時間均是適宜的。
外周靜脈腸外營養適用于接受較低滲透濃度(通常建議≤900 mOsm·L-1)營養液的短期治療[2],高滲營養液易引起血栓性靜脈炎,對于腸外營養時間超過14 d且為高滲營養液的患者,建議使用中心靜脈置管[7]。文獻報道[8]新生兒外周靜脈導管局部并發癥發生率較高(63.15%),危險因素是感染、穿刺日體質量、氣管插管、輸注基礎計劃、使用TPN、輸血和輸注其他藥物,穿刺后48 h內發生并發癥的風險較高。對于新生兒,PPNs≤900 mOsm·L-1線性相關事件的發生率為50/每百人天數,PPNs> 900 mOsm·L-1線性相關事件的發生率為52/每百人天數[RR=1.02,95%CI(0.88,1.18)];PPN的最終滲透壓不影響線性相關事件的發生率[9]。PPN的滲透壓> 1000 mOsm·L-1比≤1000 mOsm·L-1顯著增加浸潤(17%和7%,P=0.01)和靜脈炎或浸潤的復合研究終點(45%和34%,P=0.02);多因素分析顯示,滲透壓> 1000 mOsm·L-1是發生并發癥的獨立危險因素[OR=1.67,95%CI(1.08,2.52),P=0.02][10]。當使用外周靜脈輸注腸外營養時,滲透壓應低于900 mOsm·L-1以降低靜脈血栓的發生風險[11]。600張腸外營養處方中,PICC和臍靜脈置管的腸外營養滲透壓均在合理范圍(1300~1800 mOsm·L-1)[12]之內。
綜上所述,建議使用PPN時,滲透壓應低于900 mOsm·L-1,對于新生兒如有必要應控制在1000 mOsm·L-1內,并且PPN只能在獲得中心靜脈置管或過渡至腸內喂養前暫時短期使用(<2周)。510張使用外周靜脈給予腸外營養處方中滲透壓>900 mOsm·L-1的處方298張,占49.7%。對于使用PPN處方滲透壓>900 mOsm·L-1尤其是滲透壓>1000 mOsm·L-1患兒,應密切監測,如果患兒出現靜脈炎的風險,且評估仍需繼續使用腸外營養,應建議醫生啟用CPN。
3.2氨基酸的啟動和起始劑量 因為生長發育所需,兒童比成人需要更多的必需氨基酸[12],尤其是新生兒,其肝功能不成熟,推薦選用小兒專用氨基酸注射液[12]。我院NICU使用小兒復方氨基酸注射液(18AA- I),規格為20 mL:1.348 g總氨基酸。
新生兒出生后24 h內即可應用(腎功能不全者例外),從1.5~2 g·kg-1·d-1起始[2],對于早產兒[13]應在出生后第1天開始供應氨基酸,每天至少1.5 g·kg-1,以達到合成代謝狀態,避免因子宮內連續喂養中斷而引起的代謝性休克。提供最佳的氨基酸攝入量與較低的高血糖風險有關,這可能是由于刺激胰島素分泌[14-15]。
早期給予氨基酸可增加早產兒的合成代謝和短期生長發育,但對于早產兒的長期生長發育以及神經發育的影響結果很少[13]。有文獻報道在早期或大劑量氨基酸補充后生長或發病率差異無統計學意義,在出生后24 h內開始給予氨基酸似乎是安全的,并具有良好的耐受性,可更快地達到正氮平衡[16]。
GA>34周和GA<34周兩組早產兒氨基酸的起始時間和起始劑量的差異無統計學意義,65例患兒氨基酸平均起始劑量為(1.07±0.41) g·kg-1·d-1,小于早產兒氨基酸推薦起始劑量1.5 g·kg-1·d-1(P<0.01)。在以后的臨床工作中,對于早產兒的腸外營養,除腎功能不全者,建議醫生起始劑量盡量從1.5 g·kg-1·d-1,以使患兒盡早達到正氮平衡。
3.3脂肪乳的啟動和起始劑量 脂肪乳對靜脈無刺激,可提高能量的攝入和體內氮儲存,提供必需脂肪酸。脂肪乳劑在出生后24 h內即可應用,推薦劑量從1 g·kg-1·d-1開始[2],早產兒建議采用20%中長鏈混合型脂肪乳劑。我院NICU使用中長鏈脂肪乳注射液(C6-24),規格為20%:250 mL。
文獻指出,對于極早早產兒(GA<28周),出生后2 d內使用脂肪乳耐受性好,并未出現呼吸困難、慢性肺部疾病、敗血癥、動脈導管未閉、壞死性小腸結腸炎、腦室出血、早產兒視網膜病變或者死亡[17]。早產兒早期給予脂質對氮平衡具有積極影響[17]。由于葡萄糖輸注速度不應超過兒童最大葡萄糖氧化率17.3 g·kg-1·d-1(12 mg·kg-1·min-1),使用脂質作為能量來源可以降低葡萄糖輸注速度,從而滿足總能量需求。
GA>34周和GA<34周兩組早產兒脂肪乳起始時間和起始劑量差異無統計學意義,65例患兒脂肪乳起始劑量(1.17±0.34) g·kg-1·d-1,大于早產兒脂肪乳推薦的起始劑量1 g·kg-1·d-1。對于極低出生體質量兒過高的脂肪乳(出生后即給予脂肪乳2~3 g·kg-1·d-1)可能導致高三酰甘油和高血糖,甚至需要使用胰島素進行治療[18]。因此對于新生兒尤其是早產兒的脂肪乳起始劑量最好是按照指南推薦的1 g·kg-1·d-1,最大不應超過2 g·kg-1·d-1。
3.4住院期間體質量增長速度、出院體質量、腸外營養維持時間、住院時間差異 GA>34周和GA<34周兩組患兒出生時基本情況差異無統計學意義,在體質量增長速度、腸外營養維持時間以及住院時間等方面均差異有統計學意義(P<0.05),出院體質量差異無統計學意義。這可能是因為胎齡越小,胃腸道等代謝功能越差,對于胎齡較小的新生兒需要更長的腸外營養時間和住院時間,以達到追趕式生長。GA<34周患兒腸外營養維持時間及住院時間均高于GA>34周的患兒,因此盡管兩組出生體質量比較差異有統計學意義,但最終兩組出院體質量比較差異無統計學意義。
早產兒在住院期間的生長參照正常胎兒在宮內的生長速率,平均體質量增長15 g·kg-1·d-1 [19]。GA>34周早產兒體質量增長速度(11.91±5.16) g·kg-1·d-1,GA<34周早產兒(15.96±5.8)g·kg-1·d-1,胎齡越大增長速度越慢。由于研究中很多早產兒存在混合喂養,無法獲得母乳和配方奶的準確攝入量,因此無法計算早產兒每天獲得的總能量。考慮出現這種結果可能與早產兒每天獲取能量的差異相關。另外有文獻報道妊娠期和嬰兒早期的生長速度并不是一成不變的,上述生長速度似乎僅對某些時間段是準確的[20]。通常還存在感染或喂養不耐受導致的生長緩慢時期,需要在其他時間加速生長來代償[21]。綜上所述,針對NICU的早產兒,不僅要加強GA<34周早產兒的營養,更要關注GA>34周早產兒的營養;不僅要關注早產兒在NICU中的營養管理,也要關注早產兒出院以后的營養管理,對于出院前體質量增長不滿意(<15 g·kg-1·d-1)的患兒出院后應強化營養[19]。
3.5腸外營養組方 我院腸外營養的組方種類基本符合要求,但在維生素制劑的補充上存在不規范現象。新生兒腸外營養時需補充13種維生素[2],包括4種脂溶性維生素和9種水溶性維生素,目前國內尚無小兒專用維生素制劑,臨床上一般應用成人維生素混合制劑。《維生素制劑臨床應用專家共識》[22]指出市場上脂溶性維生素注射液(I)供11歲以下兒童使用,脂溶性維生素注射液(Ⅱ)供成人和>11歲兒童使用。我院使用的脂溶性維生素注射液(Ⅱ)說明書中也指出適用于成人和>11歲兒童使用,新生兒使用屬于用藥不適宜。
62.5%患兒未使用脂溶性維生素,33.5%患兒未使用水溶性維生素。對于接受腸外營養的嬰幼兒應當腸外給予水溶性維生素和脂溶性維生素[23],由于脂溶性維生素在母體胎兒中的轉運有限,尤其是低出生體質量兒在出生時體內維生素的儲存量低,早產兒出現脂溶性維生素缺乏的風險較高,因此建議早產兒從出生的第1天起就給他們提供足夠的脂溶性維生素。也應當定時給予水溶性維生素,因為嬰幼兒體內除了維生素B12,其他水溶性維生素儲存不足,另外水溶性維生素過量后由腎臟排出,毒性較小[23]。因此我院NICU早產兒的營養處方中維生素制劑的添加存在很大問題,需要后期改進。
外周靜脈通道輸注的腸外營養,所能耐受的最高糖濃度僅12.5%,本研究中經外周靜脈輸注的510張處方中,10.2%存在糖濃度超過12.5%,糖濃度增高有產生靜脈炎的風險。
脂肪乳劑作為一種靜脈營養制劑,可提供熱量及必需脂肪酸,且無氨基酸及糖類溶液升高滲透壓的缺點。目前還不能確定早產兒安全攝入的最大脂質量,大多數研究將脂質的攝入量控制在3~4 g·kg-1·d-1 [2,17]。研究表明[17],對于嬰幼兒注入脂質量應該與脂質氧化能力相適應,兒童最大脂質氧化率為3 g·kg-1·d-1,超過代謝利用率的脂質將儲存在脂肪中,增加發生脂肪超載的風險,從而可能損傷免疫功能。在腸外營養的非蛋白熱量中通常葡萄糖供能占50%~70%,而脂肪乳供能占30%~50%,一般情況下脂肪乳供能不應超過60%[7],即糖脂比為(1~2):1。我院600張處方中糖脂比<1:1的處方80份,提示腸外營養中主要由脂肪供能,可能存在脂肪超載的風險;糖脂比>2:1的處方175張,提示腸外營養主要由糖供能,可能存在患兒能量不足或者糖濃度過高的風險。
補充氨基酸的目的是為患兒提供必需氨基酸,而不是提供能量,指南指出氮:非蛋白熱卡=1 g:(100~200)[2],熱氮比指非蛋白熱卡與氮量的比值。我院600張腸外營養處方中56張熱氮比<100:1,48張處方熱氮比>200:1。我院腸外營養處方中仍存在熱氮比不符合標準的情況。
一般要求[24]腸外營養液中一價陽離子應<150 mmol·L-1,二價陽離子應<5 mmol·L-1,本研究處方一價、二價陽離子濃度均符合要求。
腸外營養提供葡萄糖量應追求滿足能量需求與過量葡萄糖負荷風險之間的平衡,應避免攝入過多葡萄糖,因為它可能導致血糖升高、脂肪堆積和血脂升高,新生兒血糖>8 mmol·L-1會增加發病率和死亡率[25]。早產兒葡萄糖起始可以給予4~8 mg·kg-1·min-1,最大劑量不超過11~14 mg·kg-1·min-1,我院早產兒腸外營養處方糖速均低于14 mg·kg-1·min-1。
600張處方中,有9張處方使用維生素C,50張處方使用核黃素磷酸鈉。不推薦在全營養混合液(total nutrient admixture,TNA)中額外補充維生素C注射液,以免生成草酸鈣沉淀[24]。我院NICU補充葡萄糖酸鈣不通過腸外營養,而是外周靜脈單獨輸入,因此不存在維生素C和葡萄糖酸鈣發生配伍的情況,但由于新生兒腸外營養需補充多種維生素,不建議單純補充一種或兩種維生素。
我院NICU早產兒腸外營養處方仍存在一定的問題,需要與醫生進一步溝通加以解決。早產兒大多數需要進行腸外營養支持治療,作為參與NICU患兒治療的臨床藥師,需要了解腸外營養相關知識,嘗試利用信息化手段提高效率[26],審核腸外營養處方并對患兒進行監護,同時對患兒家長進行宣教,避免患兒出院后發生生長遲緩。

