微納米氣泡耦合Fe3O4催化氧化吸收煙氣中的NO
盧潔,張榮梁,李登新,許士洪,林政友
(1.東華大學(xué) 環(huán)境科學(xué)與工程學(xué)院,上海 201620;2.東華大學(xué) 國(guó)家環(huán)境保護(hù)紡織污染防治工程技術(shù)中心,上海 201620;3.同濟(jì)大學(xué) 環(huán)境科學(xué)與工程學(xué)院 污染控制與資源化研究國(guó)家重點(diǎn)實(shí)驗(yàn)室,上海 200082;4.上海污染控制與生態(tài)安全研究院,上海 200082;5.上海環(huán)安環(huán)境管理有限公司,上海 200333)
微納米氣泡因具有水中停留時(shí)間長(zhǎng)、傳質(zhì)效率高以及能產(chǎn)生羥基自由基從而具有強(qiáng)氧化性等優(yōu)點(diǎn)被廣泛應(yīng)用于各領(lǐng)域的研究[1]。Fe3O4是一種典型的過(guò)渡金屬氧化物,在催化吸附、光催化降解等領(lǐng)域都有廣泛的應(yīng)用[2-5]。Fe3O4作為高效催化劑同時(shí)具有Fe2+和Fe3+兩種價(jià)態(tài),而Fe2+和Fe3+是常用的高效離子形態(tài)催化劑,因此以Fe3O4為催化劑的研究逐漸變多[6]。本文選用Fe3O4作為催化劑,研究其耦合微納米氣液體系在各種變化條件下催化氧化吸收煙氣中的NO。并采用XRD、SEM、EDS和XPS手段對(duì)反應(yīng)前后的Fe3O4進(jìn)行了表征,研究得出Fe3O4最優(yōu)使用條件并探究其反應(yīng)機(jī)理。
1 實(shí)驗(yàn)部分
1.1 材料與儀器
四氧化三鐵、濃硫酸、亞硝酸鈉、硝酸鈉、硫酸鈉均為分析純;空氣、NO、SO2均購(gòu)于南京特種氣體有限公司。
XZCP-K-0.75型超微氣泡發(fā)生器;ICS-1100型離子色譜儀;MODEL 6010便攜式pH計(jì);Seitron C600型煙氣分析儀。
1.2 實(shí)驗(yàn)方法
微納米氣液體系發(fā)生及NO氧化與吸收裝置圖見(jiàn)圖1。
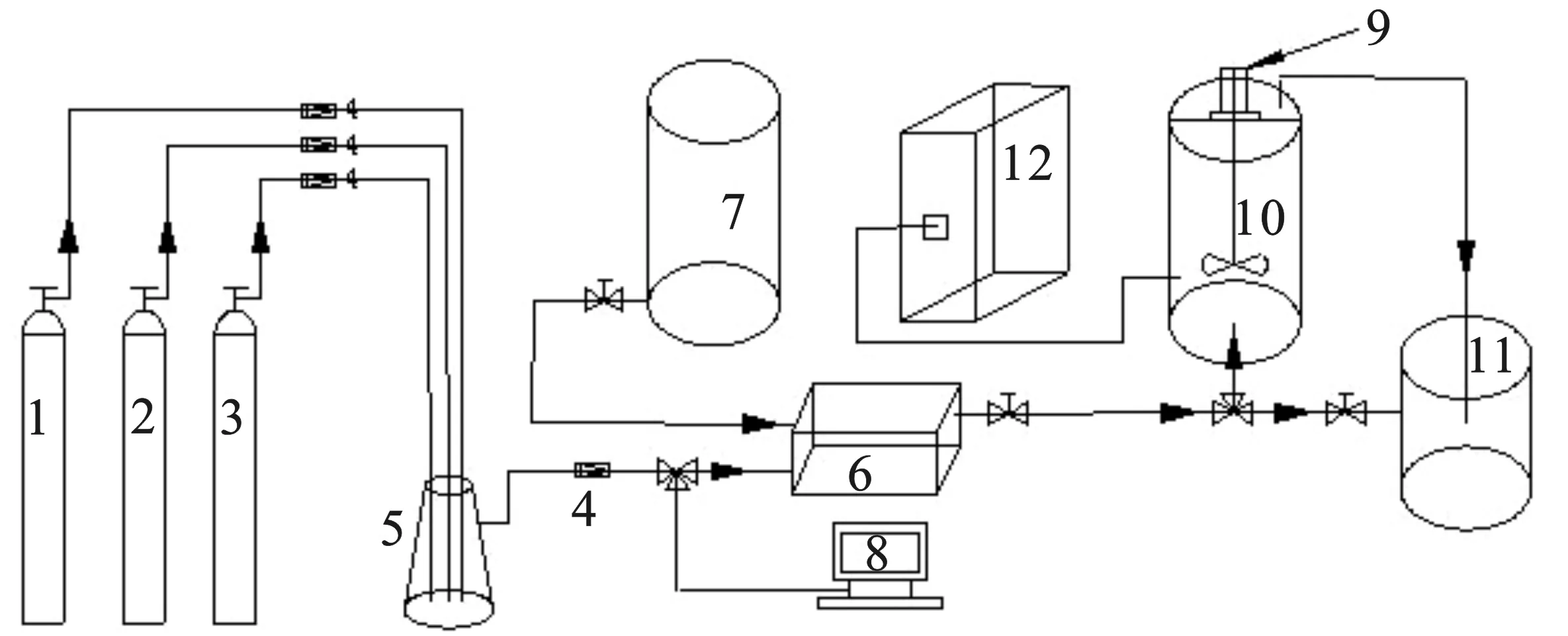
圖1 微納米氣泡耦合Fe3O4催化氧化吸收NO實(shí)驗(yàn)裝置圖Fig.1 Experimental device for NO absorption by catalyticoxidation of Fe3O4 coupled with micro-nano bubbles1.SO2鋼瓶;2.NO鋼瓶;3.空氣鋼瓶;4.氣體流量計(jì);5.氣體緩沖瓶;6.微納米氣泡發(fā)生器;7.水箱;8.煙氣分析儀;9.攪拌機(jī);10.反應(yīng)吸收塔;11.尾氣吸收塔;12.離子色譜儀

NO吸收效率計(jì)算公式(式1和式2):
(1)
(2)
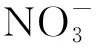
q1——進(jìn)水流量,L/min;
t——系統(tǒng)運(yùn)行時(shí)間,min;
m1——進(jìn)氣NO的質(zhì)量(以N計(jì)),mg;
cn——NO的質(zhì)量濃度,mg/L;
P1——?dú)怏w減壓后的壓力,Pa;
P0——大氣壓,Pa;
q2——?dú)怏w流量,mL/min;
t——系統(tǒng)運(yùn)行時(shí)間,min。

2 結(jié)果與討論
2.1 pH對(duì)NO吸收效率的影響
圖2是在吸收塔中加入5 g Fe3O4,設(shè)置一組不添加Fe3O4作為空白對(duì)照,其他幾組在不同pH條件下NO的脫除情況。
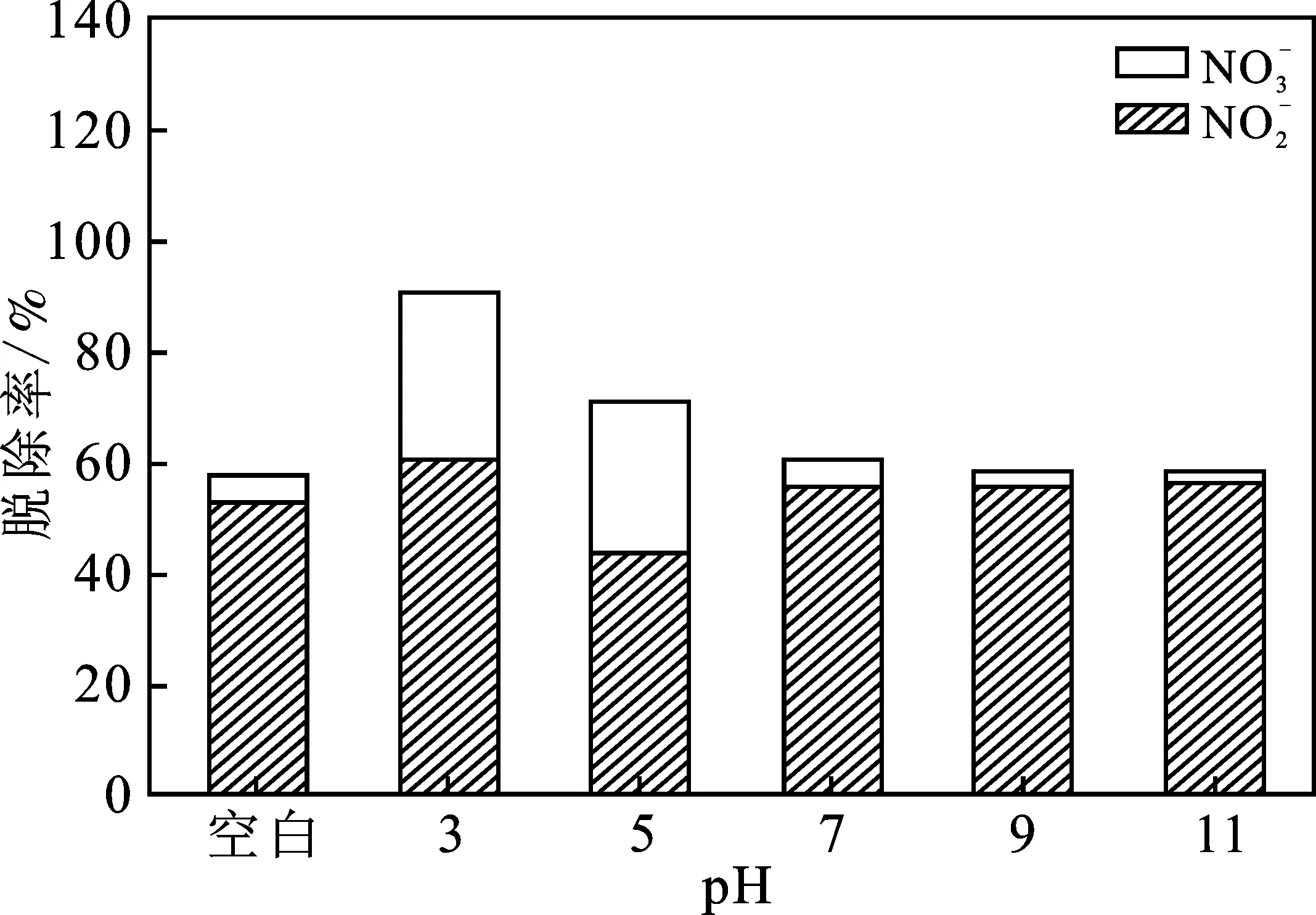
圖2 pH對(duì)NO脫除率的影響Fig.2 Effect of pH on NO removal rate
由圖2可知,隨著pH的增加,NO的脫除率逐漸降低。表1是在不同pH條件下,吸收液中Fe元素的含量。
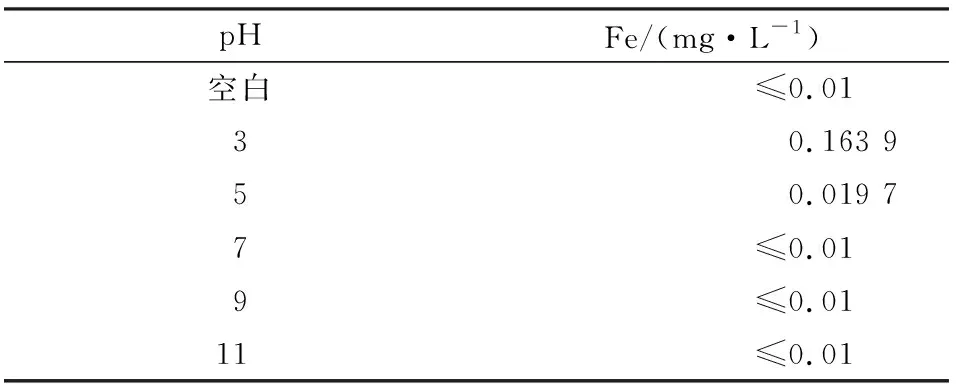
表1 不同pH條件下吸收液中Fe的含量Table 1 Fe content in absorbing solution underdifferent pH conditions
由表1可知,隨著pH的逐漸增加,吸收液中的Fe含量逐漸降低。結(jié)合圖2及表1可知,在酸性條件下,F(xiàn)e3O4在吸收液中的溶解度大,吸收液中的Fe2+和Fe3+多;由于Fe2+和Fe3+可以促進(jìn)微納米氣液體系氧化吸收NO,因此吸收液酸性越強(qiáng),NO的脫除率越高。
2.2 Fe3O4投加量對(duì)NO吸收效率的影響
圖3是在吸收液pH為3時(shí),設(shè)置一組不添加Fe3O4作為空白對(duì)照,其它實(shí)驗(yàn)中改變Fe3O4投加量條件下NO的脫除情況。
由圖3可知,隨著Fe3O4投加量增加,NO脫除率呈現(xiàn)先增加后降低的趨勢(shì),當(dāng)Fe3O4投加量為5 g時(shí),NO脫除率最高,達(dá)到了81.1%。造成此現(xiàn)象是由于初期隨著Fe3O4投加量的逐漸增加,F(xiàn)e3O4能提供的活性反應(yīng)位點(diǎn)數(shù)量逐漸增加,提高了催化微納米氣泡產(chǎn)生·OH的反應(yīng)速率[8]。而Fe3O4投加量過(guò)多時(shí),吸收液中固體顆粒物過(guò)多而影響了水質(zhì),使得微納米氣泡在水中的傳質(zhì)效率受到了影響,NO的吸收率降低。
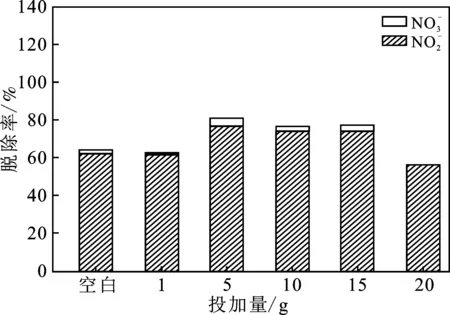
圖3 Fe3O4投加量對(duì)脫硝的影響Fig.3 Effect of Fe3O4 on denitrification
2.3 NO進(jìn)氣量對(duì)NO吸收效率的影響
圖4是在吸收塔中加入5 g Fe3O4,吸收液pH為3,在不同的NO的進(jìn)氣量條件下NO的脫除情況。
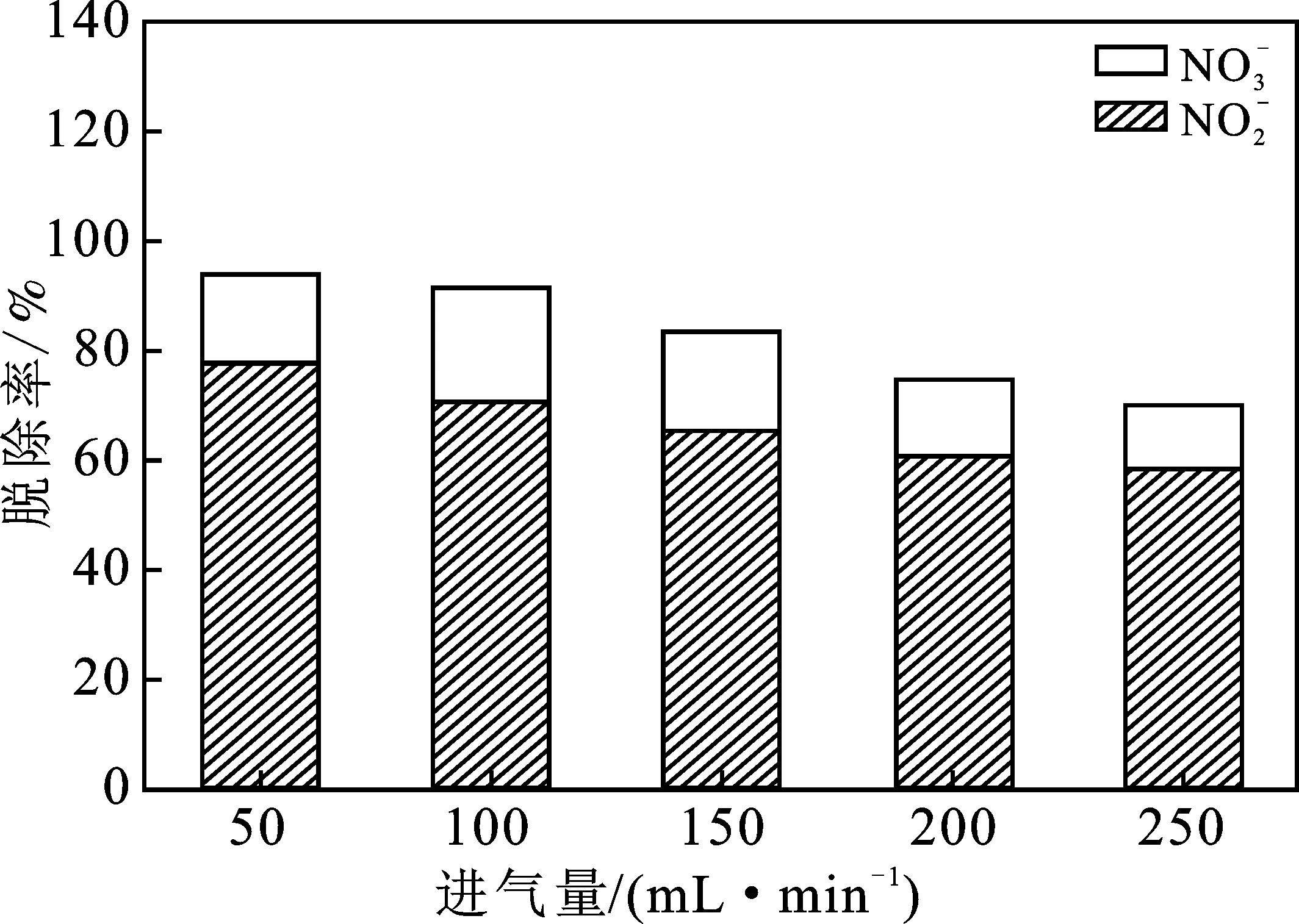
圖4 進(jìn)氣量對(duì)脫硝的影響Fig.4 Effect of flow rate on denitrification
由圖4可知,隨著NO氣體進(jìn)氣量的增加,NO的脫除率逐漸降低。原因可能是隨著進(jìn)氣量的逐漸增加,更多微納米氣泡中的NO沒(méi)有被氧化就破裂釋放,使得NO的吸收效率受到了影響。
2.4 Fe3O4的催化機(jī)理研究
圖5是Fe3O4反應(yīng)前后的XRD圖譜。
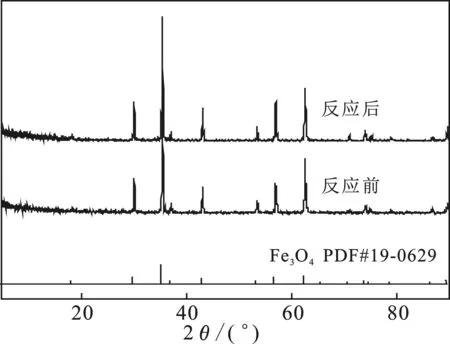
圖5 反應(yīng)前后Fe3O4的XRD圖譜Fig.5 XRD patterns of Fe3O4 before and after reaction
由圖5可知,反應(yīng)前后Fe3O4的特征峰沒(méi)有發(fā)生明顯變化,說(shuō)明樣品反應(yīng)前后物相沒(méi)有發(fā)生變化。
圖6是反應(yīng)前后的Fe3O4的Fe 2p XPS掃描圖。
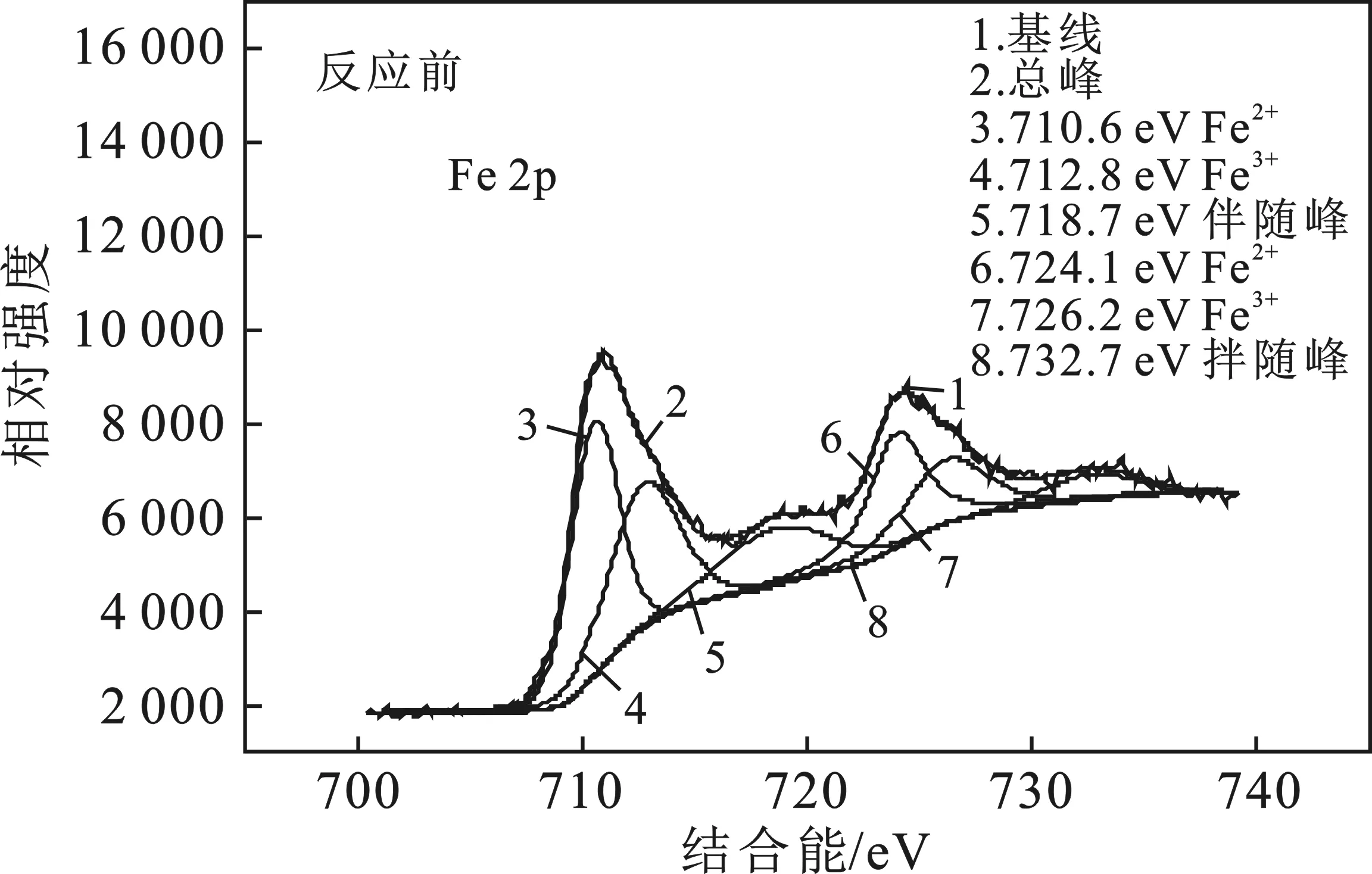
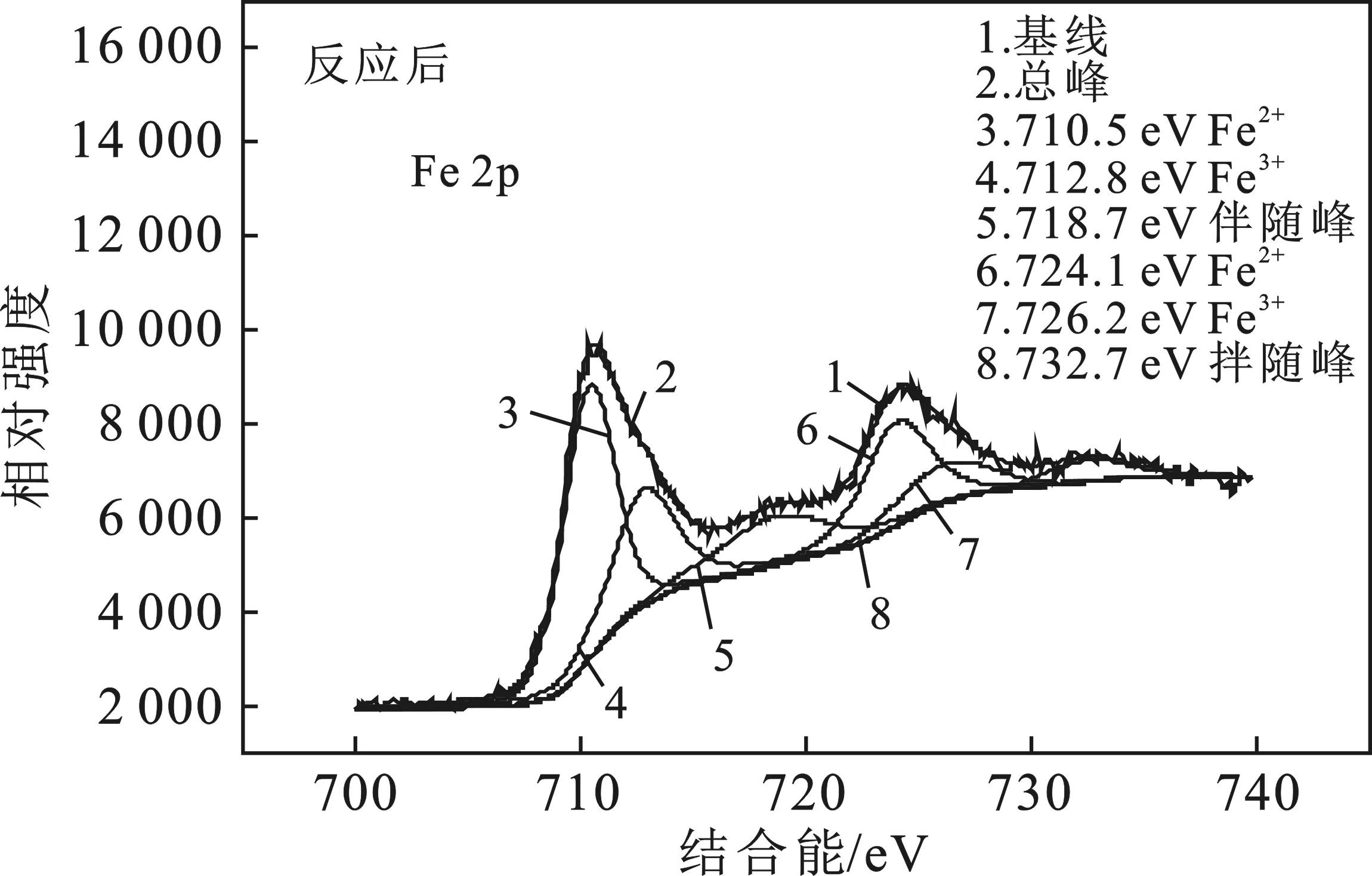
圖6 反應(yīng)前后的Fe3O4的Fe 2p XPS掃描圖Fig.6 XPS scanning chart of Fe 2p before andafter Fe3O4 reaction

(3)
(4)
Fe2++·OH→Fe3++OH-
(5)
Fe3++HO2·→Fe2++O2+H+
(6)
·OH+NO→HONO
(7)
·OH+HONO→NO2+H2O
(8)
2HO2·+2NO→2HNO2+O2
(9)
(10)
(11)
(12)
圖7是Fe3O4反應(yīng)前后的SEM照片。
由圖7可知,反應(yīng)前后的表面形貌沒(méi)有太大差異,樣品晶型也沒(méi)有變化。反應(yīng)后樣品表面略微粗糙,可能的原因是:①在NO的脫除過(guò)程中微量的Fe3O4溶于吸收液中;②由于微納米氣液體系的強(qiáng)氧化能力,表面微量的Fe3O4被氧化。


圖7 反應(yīng)前后Fe3O4的SEM圖Fig.7 SEM images of Fe3O4 before and after reactiona.反應(yīng)前;b.反應(yīng)后
圖8是反應(yīng)前后Fe3O4的SEM-EDS圖,表2是反應(yīng)前后Fe3O4的元素含量表。
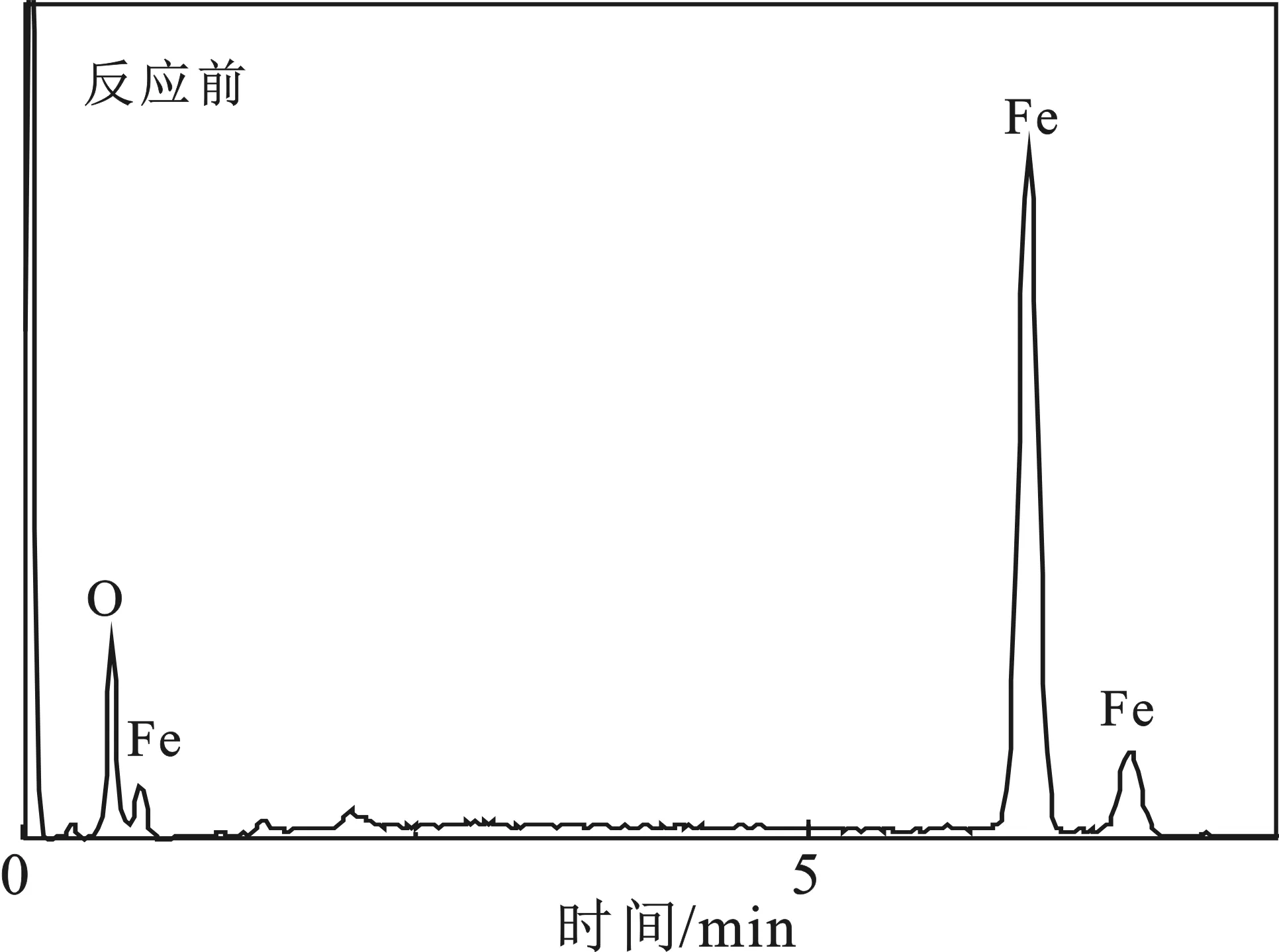

圖8 反應(yīng)前后Fe3O4的SEM-EDS圖Fig.8 SEM-EDS pictures of Fe3O4 before andafter reaction
由圖8和表2可知,反應(yīng)后樣品表面的鐵元素含量降低,氧元素含量增多。此現(xiàn)象是在催化氧化去除NO的過(guò)程中,由于溶液中的強(qiáng)氧化環(huán)境,使得Fe3O4表面的一些Fe2+發(fā)生了氧化反應(yīng),提高了氧元素的含量,并導(dǎo)致鐵元素含量的降低。
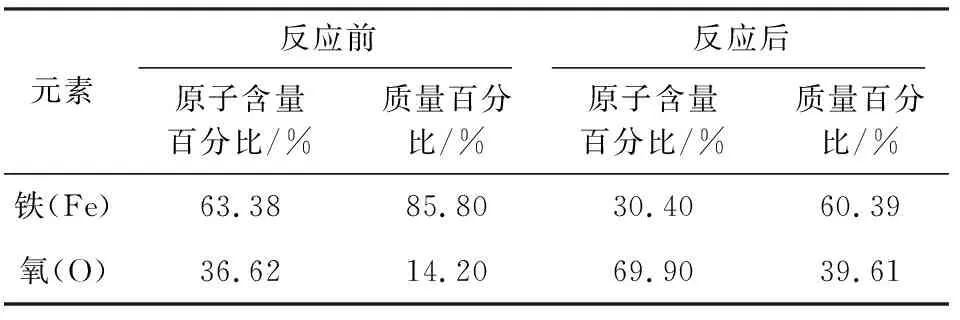
表2 反應(yīng)前后Fe3O4的元素含量Table 2 Element content table of Fe3O4before and after reaction
3 結(jié)論
以Fe3O4作為催化劑,耦合微納米氣泡催化氧化吸收NO,考察最佳脫硝效率條件。并采用XRD、SEM、EDS和XPS手段對(duì)使用前后的Fe3O4進(jìn)行了表征分析,得到的結(jié)論如下:
(1)Fe3O4具有很好的催化效果,雖然相對(duì)離子形態(tài)的Fe2+和Fe3+,固體形態(tài)的Fe3O4催化效果有所不如,但Fe3O4具有磁性,可回收,且無(wú)二次污染的特點(diǎn),比離子形態(tài)的Fe2+和Fe3+催化劑更具有工業(yè)可行性。
(2)Fe3O4投加量為5 g、pH為3,進(jìn)氣量為 50 mL/min 時(shí),NO的吸收效果最好,達(dá)到了93.8%。
(3)Fe3O4反應(yīng)前后物相和表面形貌沒(méi)有太大差異,但是使用后Fe3O4表面的Fe元素含量有所降低,O元素含量增高。Fe3O4本身同時(shí)具備Fe2+和Fe3+,可以促進(jìn)催化氧化NO的吸收。

