全國細菌耐藥監測網2014—2019年血標本病原菌耐藥性變遷
全國細菌耐藥監測網
血流感染(bloodstream infection,BSI)是由各種病原微生物和/或毒素侵入血流所引起的血液感染,可引起病死率較高的嚴重的全身感染性疾病[1],尤其是多重耐藥菌如耐碳青霉烯類革蘭陰性桿菌等感染,病死率高,患者負擔重[2],動態監測血流感染病原菌的分布及耐藥趨勢具有十分重要的臨床意義。研究2014—2019年全國細菌耐藥性監測網(China Antimicrobial Resistance Surveillance System, CARSS)血標本來源病原菌的分布和耐藥性變化,可為臨床治療血流感染提供合理用藥參考。
1 資料與方法
1.1 資料來源 2014年1月—2019年9月CARSS臨床血標本分離病原菌資料,所有菌株均為患者血標本分離的非重復菌株。經系統自動審核和人工審核后,CARSS不同年度最終納入數據分析的醫院數分別為1 110、1 143、1 273、1 307、1 353、1 375所。

1.3 質量控制 按照CLSI要求進行質量控制,在試驗條件穩定下每周施行一次常規質量控制程序。質控菌株包括大腸埃希菌 ATCC 25922、金黃色葡萄球菌 ATCC 29213、金黃色葡萄球菌 ATCC 25923、肺炎克雷伯菌 ATCC 700603、陰溝腸桿菌 ATCC 700323、銅綠假單胞菌 ATCC 27853、肺炎鏈球菌 ATCC 49619。
1.4 數據分析 應用WHONET軟件進行數據分析,采用株數、百分率對數據進行描述。
2 結果
2.1 病原菌構成 2014—2019年血標本分離細菌1 599 273株,革蘭陰性菌828 846株(51.8%),革蘭陽性菌770 427株(48.2%)。病原菌分離率居首位的為大腸埃希菌(402 818株,25.2%),其次分別為表皮葡萄球菌(193 968株,12.1%)、肺炎克雷伯菌(162 613株,10.2%)、人葡萄球菌(136 396株,8.5%)和金黃色葡萄球菌(106 915株,6.7%)。非發酵菌中銅綠假單胞菌(43 565株,2.7%)和鮑曼不動桿菌(37 244株,2.3%)所占比例最高,但呈逐年下降趨勢。革蘭陽性球菌以表皮葡萄球菌和人葡萄球菌為主。血標本細菌分離居前10位的細菌見圖1和表1。
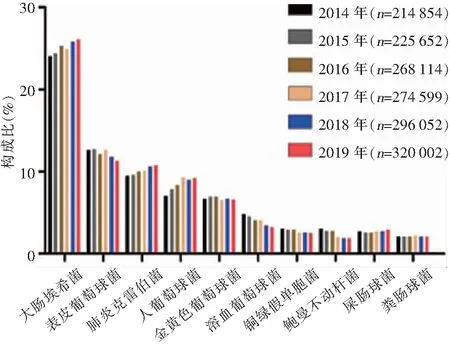
圖1 2014—2019年CARSS血標本分離居前10位的細菌及構成比
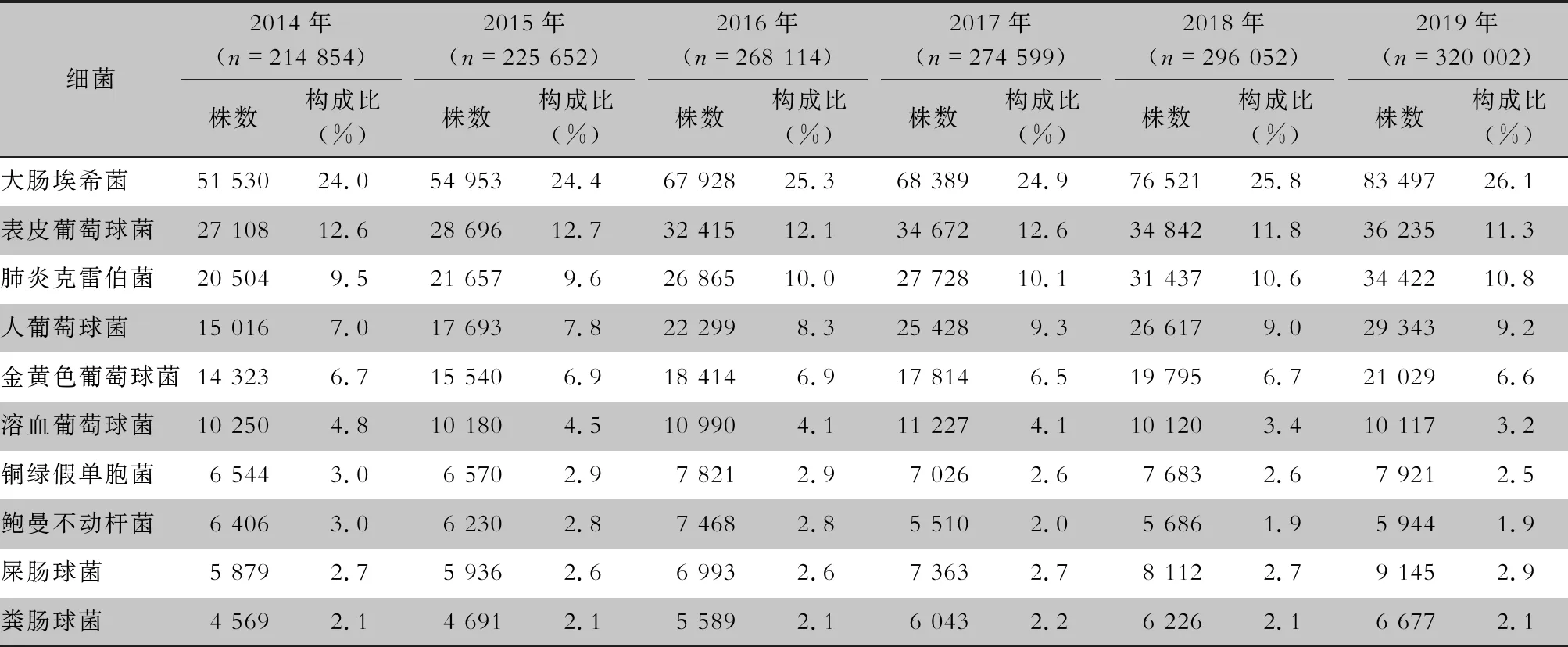
表1 2014—2019年CARSS血培養分離居前10位的菌種分布
2.2 病原菌耐藥情況
2.2.1 革蘭陰性菌耐藥情況 血流感染中分離的大腸埃希菌對碳青霉烯類、阿米卡星、哌拉西林/他唑巴坦及2019年開始檢測的替加環素持較高的體外抗菌活性,敏感率約90%;對亞胺培南的耐藥率有所增高,對美羅培南的耐藥率為0.8%~1.3%。肺炎克雷伯菌對碳青霉烯類、阿米卡星持較高的體外抗菌活性,敏感率約90%,但對亞胺培南、美羅培南的耐藥率有所增高,耐藥率為6.6%~11.7%。肺炎克雷伯菌整體耐藥性高于大腸埃希菌。2014—2019年銅綠假單胞菌對亞胺培南、美羅培南的耐藥率分別為13.0%~19.2%、10.8%~16.9%,對β-內酰胺類復合制劑、氨基糖苷類藥物和喹諾酮類藥物耐藥率均為10%左右,且對氨基糖苷類藥物和喹諾酮類藥物耐藥率呈逐年下降趨勢,其中對阿米卡星耐藥率由7.1%降至2.6%。鮑曼不動桿菌對亞胺培南、美羅培南的耐藥率分別為45.9%~60.9%、46.8%~61.7%,對米諾環素的耐藥率分別為14.6%~22.0%。見表2~5。
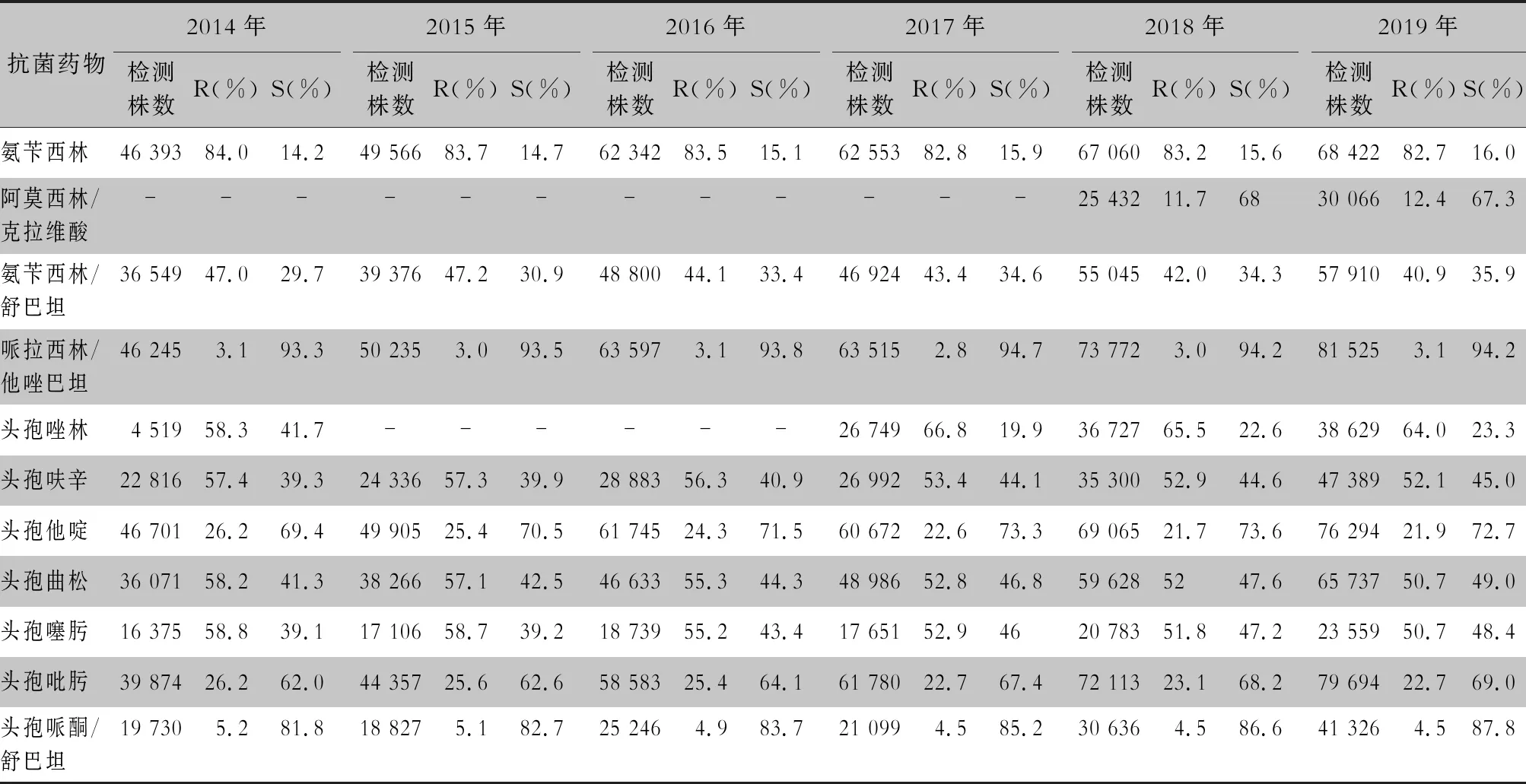
表2 2014—2019年CARSS血培養分離的大腸埃希菌對抗菌藥物的藥敏結果
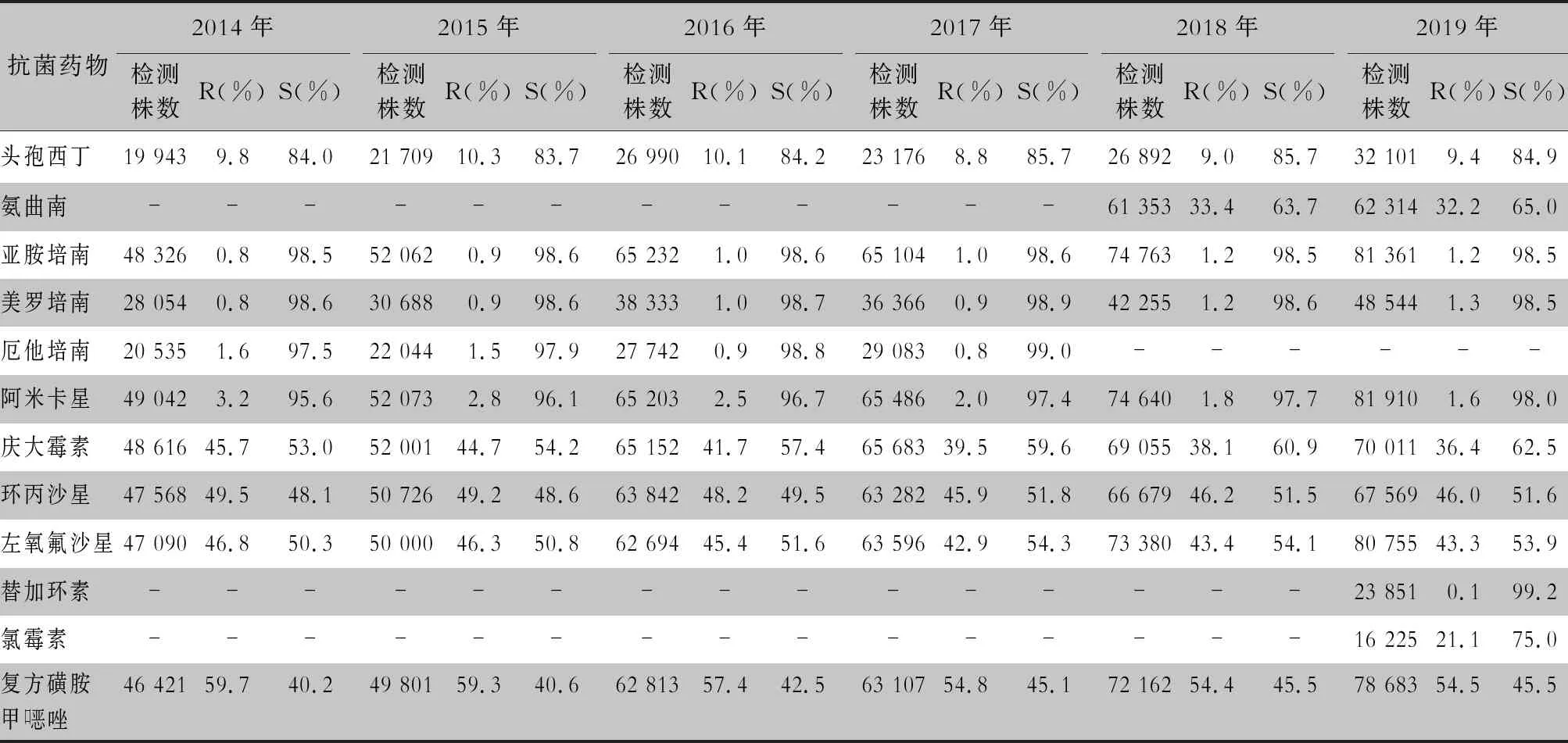
續表2 (Table 2, Continued)
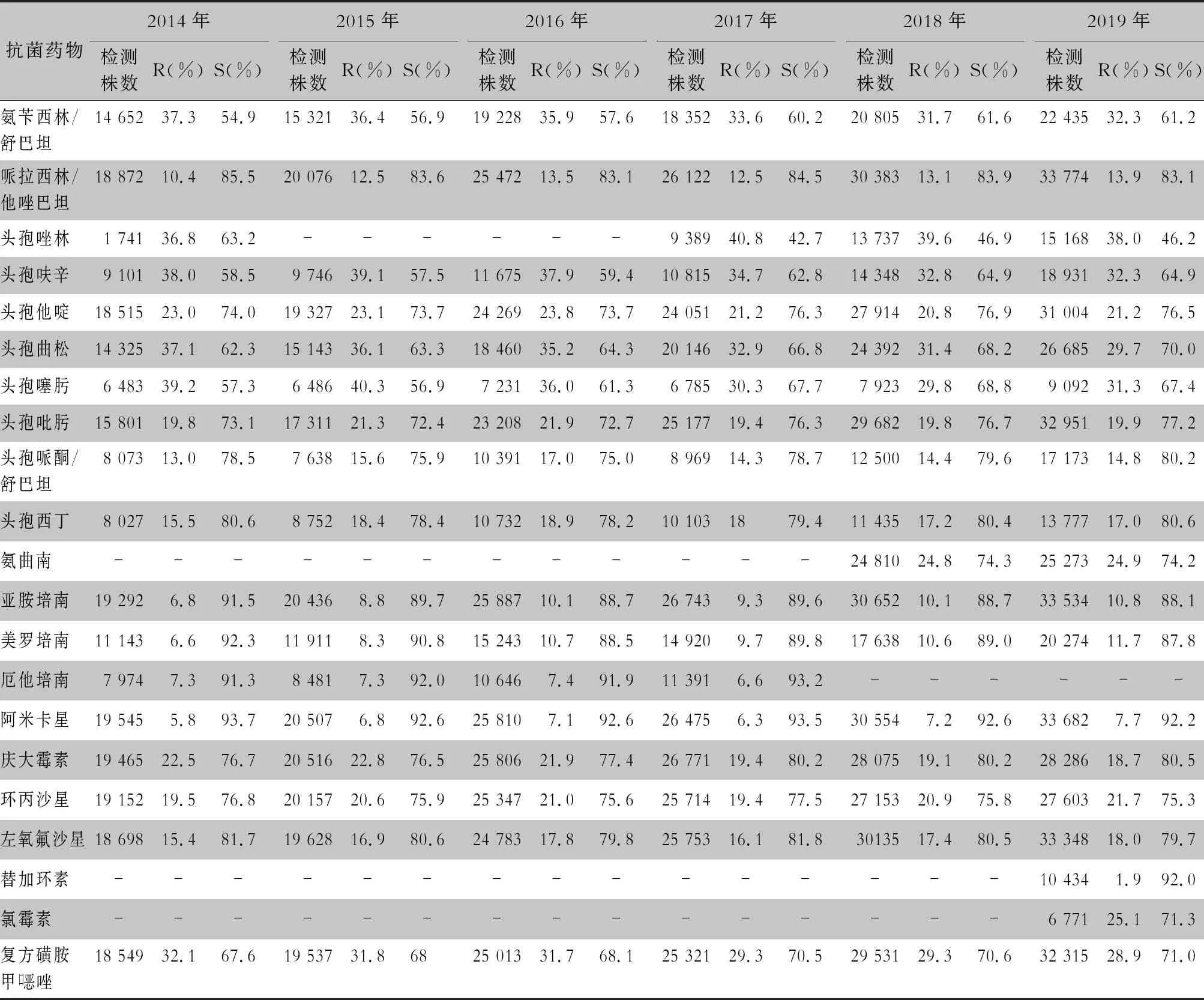
表3 2014—2019年CARSS血培養分離肺炎克雷伯菌對抗菌藥物的藥敏結果
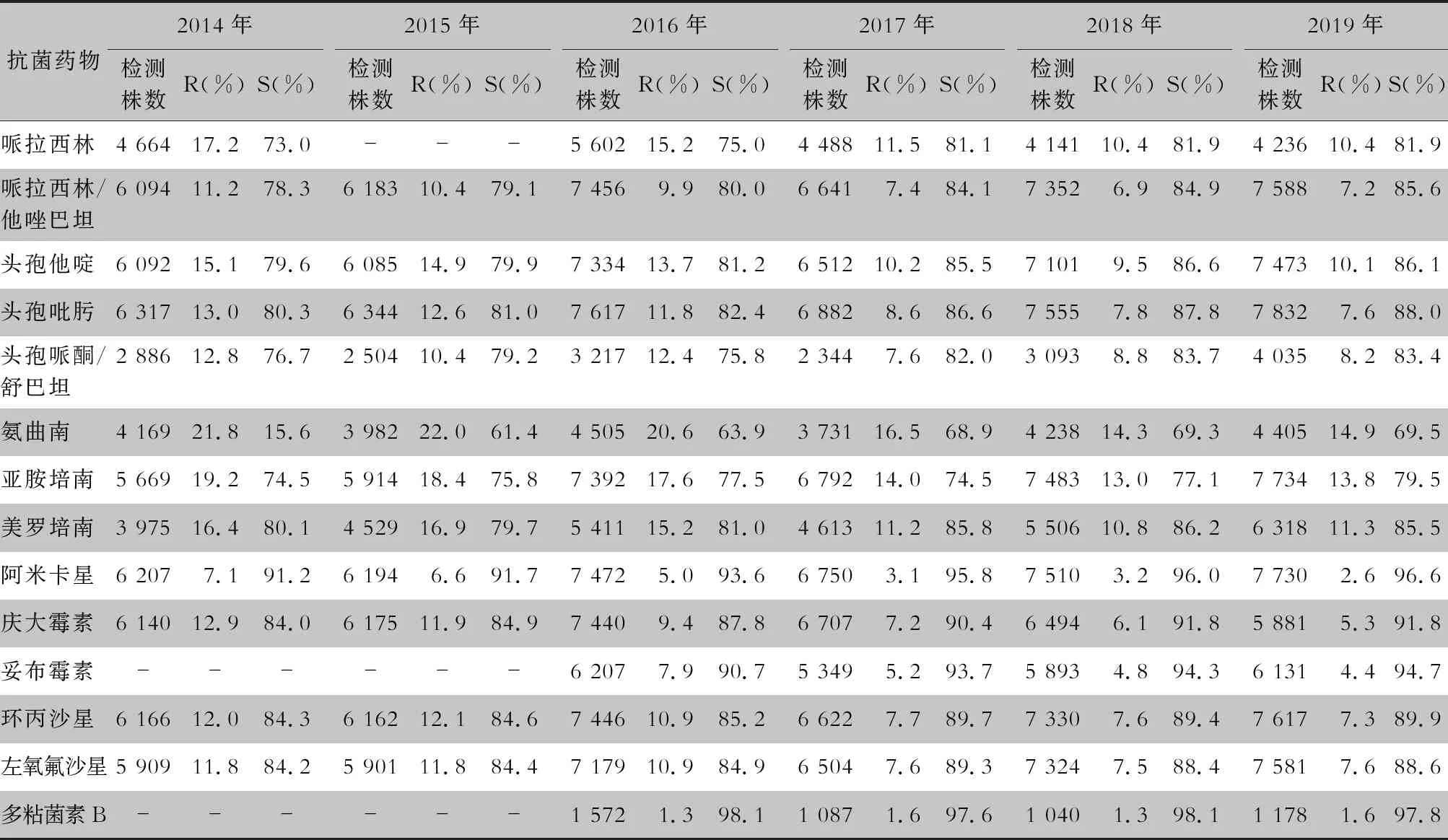
表4 2014—2019年CARSS血培養分離銅綠假單胞菌對抗菌藥物的藥敏結果
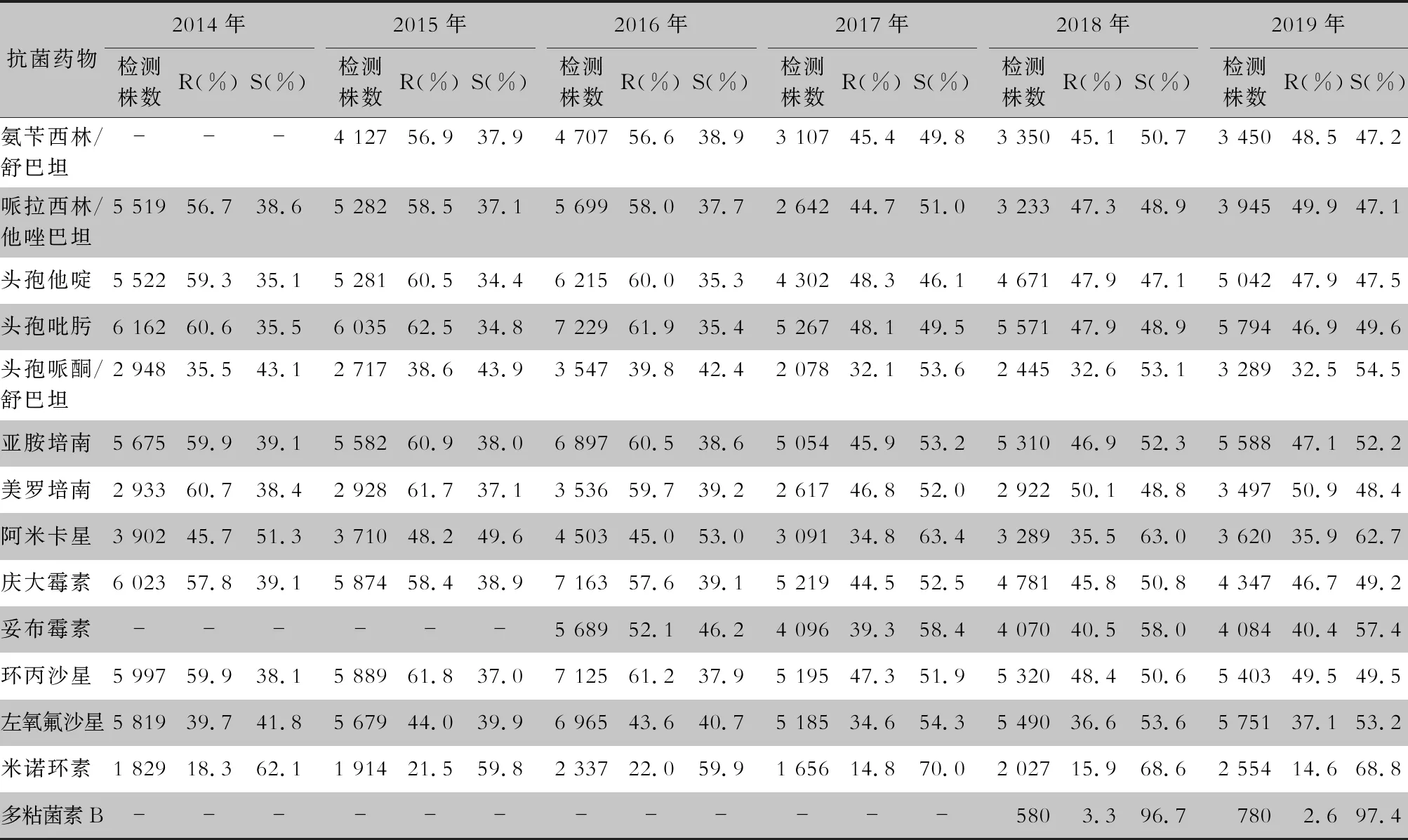
表5 2014—2019年CARSS血培養分離鮑曼不動桿菌對抗菌藥物的藥敏結果

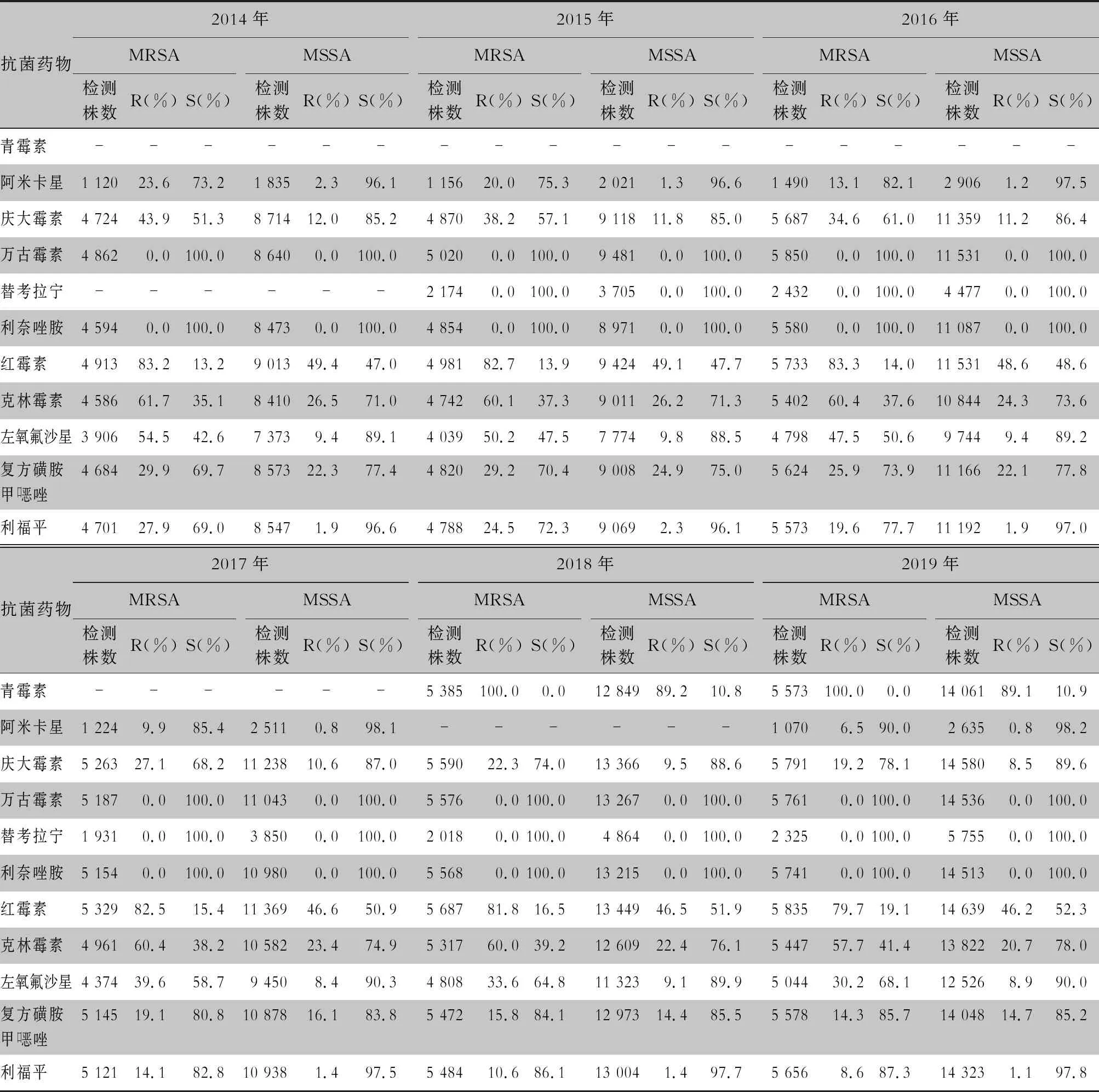
表6 2014—2019年CARSS血培養分離金黃色葡萄球菌對抗菌藥物的藥敏結果
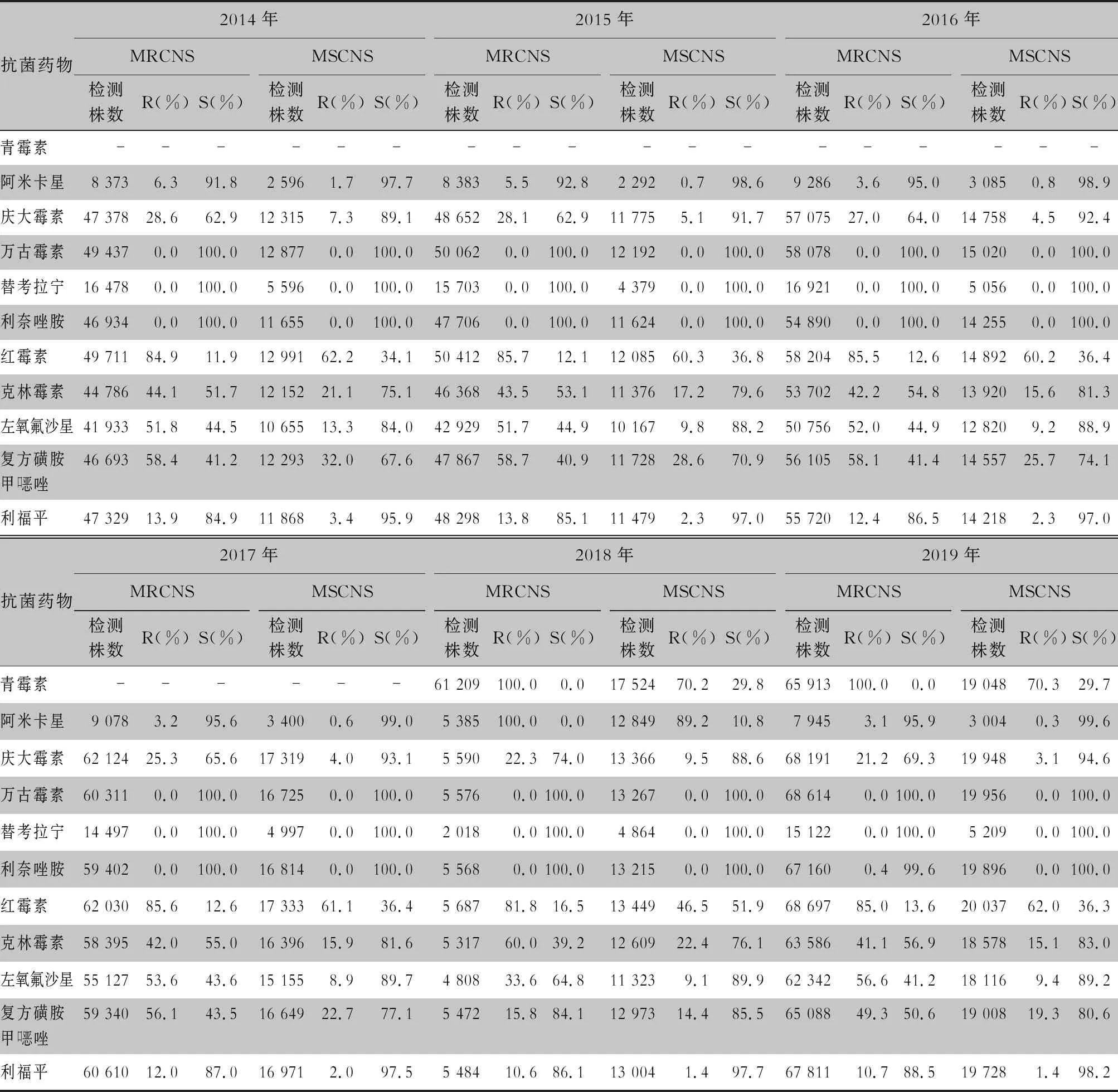
表7 2014—2019年CARSS血培養分離的凝固酶陰性葡萄球菌對抗菌藥物的藥敏結果
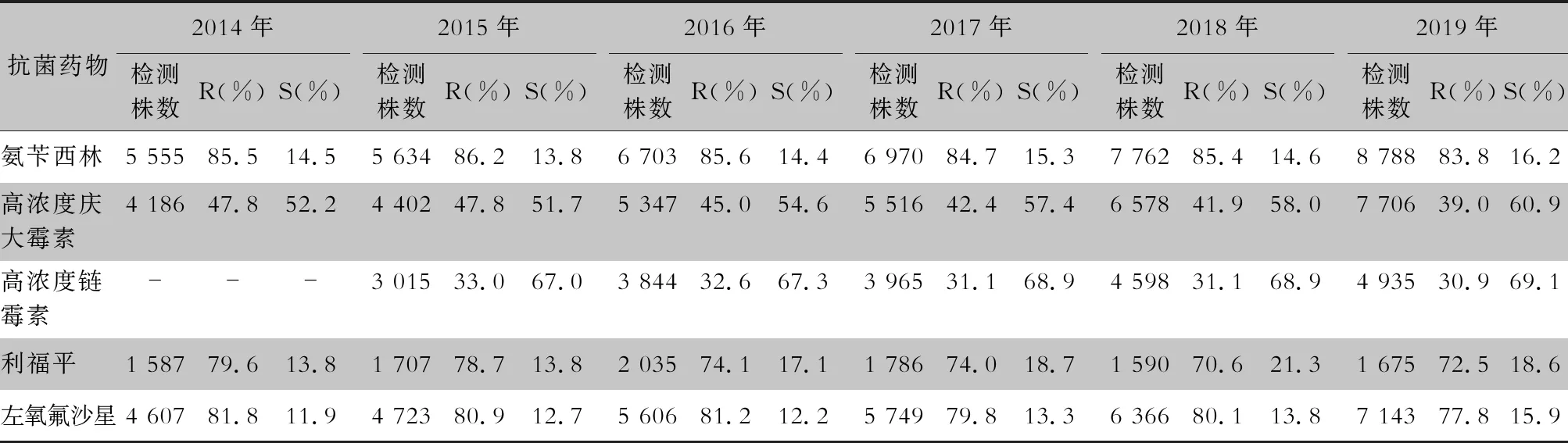
表8 2014—2019年CARSS血培養分離的屎腸球菌對抗菌藥物的藥敏結果
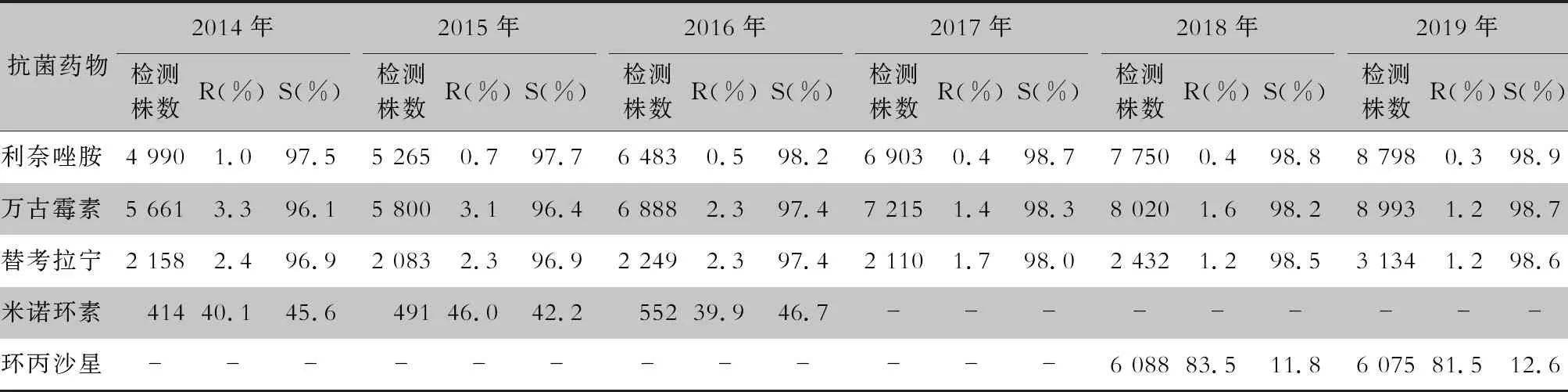
續表8 (Table 8, Continued)
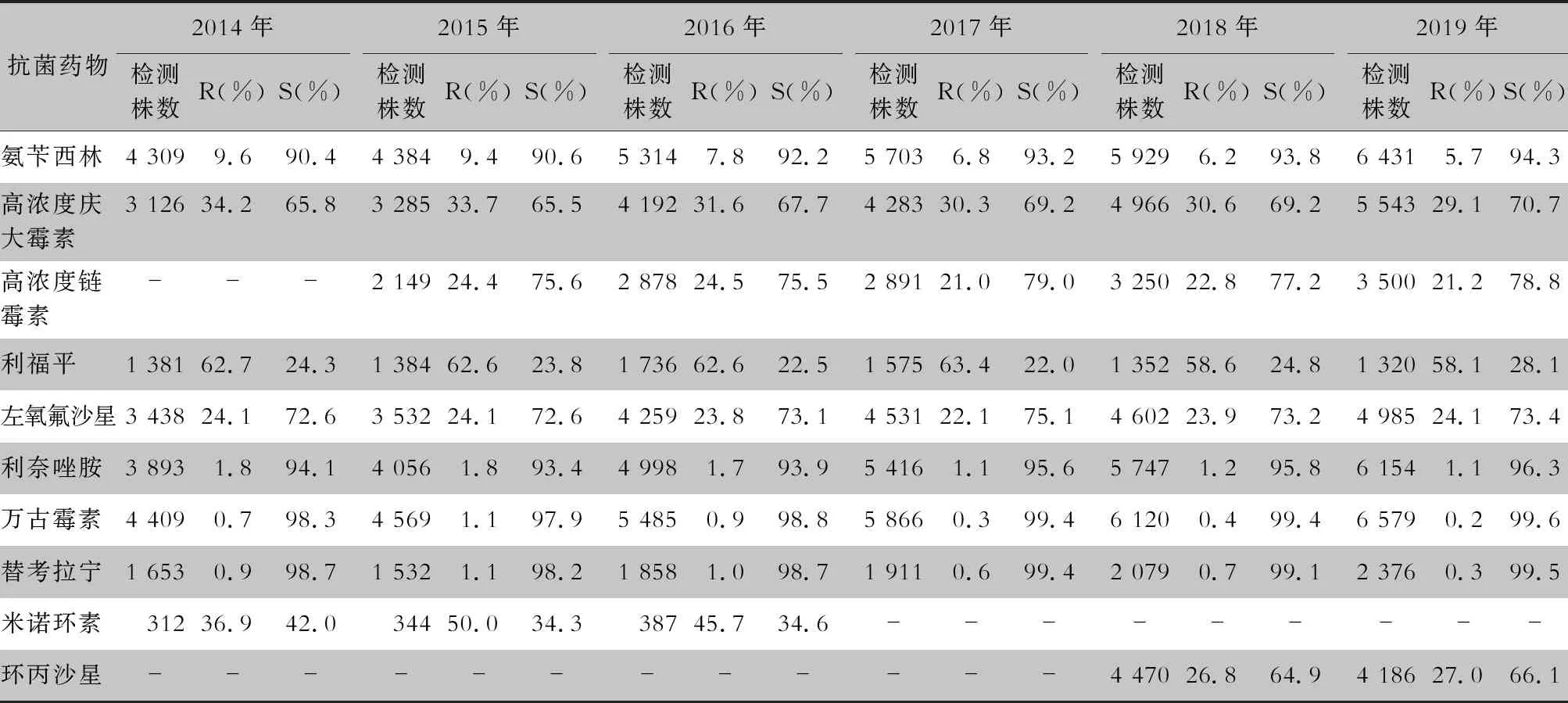
表9 2014—2019年CARSS血培養分離的糞腸球菌對抗菌藥物的藥敏結果
3 討論
本研究結果顯示,我國2014—2019年血標本分離病原菌菌種構成無明顯變化,大腸埃希菌、表皮葡萄球菌和肺炎克雷伯菌一直是居前3位的病原菌,與2013—2016年覆蓋45個國家200多個醫療中心的SENTRY耐藥監測項目[3](無我國數據)略有不同,其血標本病原菌分離居前3位的為大腸埃希菌、金黃色葡萄球菌和肺炎克雷伯菌。血標本病原菌中革蘭陰性桿菌所占構成比一直高于革蘭陽性球菌,其主要病原菌大腸埃希菌和肺炎克雷伯菌,對第一、二、三代頭孢菌素具有較高的耐藥率,且可通過質粒水平傳播耐藥性,臨床治療效果有限,致死率較高,已成為重大的公共衛生問題。
碳青霉烯類抗生素是治療產超廣譜β-內酰胺酶(ESBLs)多重耐藥革蘭陰性桿菌的一線用藥,本研究中大腸埃希菌對碳青霉烯類抗生素耐藥率為0.8%~1.6%,肺炎克雷伯菌對亞胺培南、美羅培南耐藥率在6.6%~11.7%,均呈逐年上升趨勢。全球耐碳青霉烯類腸桿菌目細菌(CRE)的主要耐藥機制之一為產碳青霉烯酶(carbapenemase-producing Enterobacteriales, CPE),且易水平傳播[4-5],提示臨床一旦發生CRE感染,應上報醫院感染并采取醫院感染防控措施[6]。Yoon等[7]報道,韓國細菌耐藥監測系統數據中血標本分離的CPE大腸埃希菌占0.2%,肺炎克雷伯菌占3.1%。我國CPE以KPC-2型酶為主要流行基因型,其次為NDM基因型,不同基因型其臨床治療策略及預后有所不同[8-9],推薦必要時檢測CPE的基因型或酶型。頭孢他啶/阿維巴坦、替加環素、粘菌素以及聯合用藥是治療CRE等多重耐藥菌的最后一道防線[10-13]。雖然本研究中沒有替加環素完整的藥敏結果,但已有多篇研究[8, 14-16]報道分離出替加環素不敏感的肺炎克雷伯菌和大腸埃希菌,其耐藥機制與RND 外排泵表達上調相關。已分離出耐粘菌素的腸桿菌目細菌,并檢測到可水平轉移的粘菌素耐藥基因mcr-1[17],以及同時攜帶碳青霉烯酶NDM 基因和mcr-1 基因的臨床菌株[18],并且有越來越多的粘菌素耐藥基因被檢測出,如mcr-2、mcr-3、mcr-4、mcr-5、mcr-6、mcr-7、mcr-8、mcr-9[19-21],這將加劇當前臨床抗菌藥物使用窘迫的局面,同時也給抗菌藥物使用管理提出了更高的要求。
血標本來源的非發酵菌以銅綠假單胞菌和鮑曼不動桿菌為主,連續6年CARSS監測數據顯示,銅綠假單胞菌對各類抗菌藥物的敏感性優于鮑曼不動桿菌,且6年來銅綠假單胞菌和鮑曼不動桿菌對臨床常用抗菌藥物的敏感性總體呈上升趨勢,但由銅綠假單胞菌引起的血流感染其病死率及進展速度高于其他革蘭陰性桿菌和金黃色葡萄球菌所致的血流感染[22-23],可能與銅綠假單胞菌毒力、藥敏變化快及易形成生物膜有關。鮑曼不動桿菌的敏感性雖然總體呈上升趨勢,但呈現多重耐藥,僅多粘菌素B(2018—2019年數據)的敏感率大于95%,米諾環素的敏感率不超過70%,其余大多常見抗菌藥物的敏感率低于60%,與2005—2014年CHINET不動桿菌屬細菌耐藥性監測數據基本一致[24]。盡管多粘菌素B的敏感率大于95%,但其毒副作用大,為臨床抗感染治療帶來困難。為遏制我國鮑曼不動桿菌耐藥性和感染的快速增長,2012年我國完成了《中國鮑曼不動桿菌感染診治與防控專家共識》[25],推薦以替加環素為基礎的聯合用藥治療鮑曼不動桿菌引起的嚴重感染。

綜上所述,我國2014—2019年血標本來源病原菌菌種構成無明顯變化,大腸埃希菌、表皮葡萄球菌、肺炎克雷伯菌仍是血流感染最主要的病原菌。雖然本次納入的均為血標本來源的病原菌,但并不一定都為病原菌,部分可能為污染菌,尤其是分離率居第二位的表皮葡萄球菌,提示應重視葡萄球菌感染,并不斷提高血培養送檢率和合格率。另外,常用抗菌藥物的體外敏感率上下浮動幅度較小。但仍需對多重耐藥菌,尤其是可以水平轉移耐藥性的菌株進行醫院感染防控,減緩耐藥性的發生,為臨床合理用藥保駕護航。

