分散固相萃取-超高效液相色譜-串聯(lián)質譜法測定茶葉強極性農藥殘留
何 江,宋 磊,羅先錕
(1.貴陽市農產品質量安全監(jiān)督檢驗測試中心,貴州 貴陽 5500811;2.貴州醫(yī)科大學 公共衛(wèi)生學院,貴州 貴陽 550026)
1 引言
茶葉中含有40多種無機礦物質和450多種有機化合物[1],具有提神清心、清熱解暑、消食化痰等作用,還對心腦血管病有一定的藥理功效,因此受到人們的喜愛。我國是世界上最大的茶葉生產國,茶園面積、產量及消費量均居世界第一[2]。同時,我國也是茶葉出口大國,茶葉出口為我國農民帶來了經(jīng)濟收入[3]。長期以來,為了降低病蟲害對茶葉的影響,保障茶葉的產量和品質,采用農藥防治茶樹病蟲害成為茶園的一項重要措施[4]。常用極性農藥中,如樂果可用于防治小綠葉蟬、茶蚜、介殼蟲等害蟲;氧樂果主要用于防治刺吸式口器的害蟲;敵百蟲主要用于防治茶毛蟲、刺蛾、卷葉蛾等食葉性害蟲;多菌靈可抑制茶樹輪斑病的病原菌生長;涕滅威是一種高毒殺蟲、殺螨、殺線蟲劑。由于這些強極性農藥殺蟲殺菌效果好,能有效的防止茶樹病害蟲的生長,在茶葉生產中發(fā)揮著重要的作用。但是,強極性農藥使用不當會造成茶葉中農藥殘留超標[5],影響茶葉的品質,損害消費者健康,還影響著茶葉產業(yè)的健康發(fā)展。如涕滅威及其代謝物過度使用,其致癌和致突變性可對環(huán)境和人體健康造成潛在危害[6,7];長期食用殘留有多菌靈的食物,經(jīng)消化道吸收后,能引起頭昏腦脹、惡心嘔吐等中毒癥狀,嚴重時可引起肝病和染色體畸變,同時對哺乳動物神經(jīng)具有一定的毒性作用[8,9]。
茶葉農藥殘留的樣品前處理技術呈現(xiàn)多方向發(fā)展、多個學科綜合的新局面。常用的前處理方法有[10~13]:固相微萃取技術、固相萃取法、基質固相分散萃取技術,它們共同的優(yōu)點是分離效率高、適用性廣,但試劑的用量大,花費的成本高,步驟繁瑣,耗時長。QuEChERS方法是近年來發(fā)展起來的一種樣品前處理技術,該方法是先將均質的樣品用乙腈提取,然后鹽析分層,吸附劑[14](C18、GCB等)凈化,比傳統(tǒng)的凈化方法更為快速簡易[15]。常用檢測方法包括生物檢測技術、氣相色譜法、氣相色譜-質譜法[16]、液相色譜法、高效液相色譜串聯(lián)質譜法等。UPLC-MS/MS是集UPLC的高分離能力與MS/MS的高靈敏度和高選擇性于一體的強有力分離分析方法,對復雜基體中的農藥殘留具有很強的定性能力。本實驗主要針對茶葉中強極性農藥的檢測,探索出更適合檢測茶葉中強極性農藥的色譜條件,采用QuEChERS前處理技術,結合UPLC-MS/MS法,建立一種更經(jīng)濟、快速、簡便的檢測茶葉12種強極性農藥的方法。
2 實驗部分
2.1 樣品、試劑與儀器
茶葉樣品均來自于市場和茶園抽樣,按照GB 23200.13-2016 進行制樣與保存。
乙腈、甲醇、甲酸(色譜純,美國賽默飛世爾公司);N-丙基乙二胺(PSA)、十八烷基硅烷鍵合硅膠(C18)、石墨化炭黑(GCB)(上海安譜實驗科技股份有限公司);無水硫酸鎂(分析純,天津市永大化學試劑有限公司);乙酸鈉(分析純,天津市申泰化學試劑有限公司);醋酸(優(yōu)級純,國藥集團化學試劑有限公司);涕滅威、涕滅威亞砜、涕滅威砜、多菌靈、甲胺磷、噻蟲嗪、敵百蟲、氧樂果、樂果9種標準品溶液(1000μg/mL,北京壇墨公司);實驗室用水為Milli-Q超純水。
三重四級桿液相色譜質譜聯(lián)用儀(Waters Xeve TQ,Waters公司);渦旋振蕩器(SK-1,上海梅香儀器有限公司);高速離心機(HC-3515,安徽中科中佳科學儀器有限公司);電子天平(AX205,瑞士梅特勒托利多公司);Milli-Q超純水凈儀(美國Millipore公司)。
單標儲備液:甲醇配制質量濃度為100 μg/mL的涕滅威、涕滅威亞砜、涕滅威砜、多菌靈、甲胺磷、噻蟲嗪、敵百蟲、氧樂果、樂果單標儲備液,于 4 ℃保存。
2.2 樣品前處理
稱取2.00 g茶葉樣品于50 mL離心管中,加入10 mL純水,渦旋1 min,靜置30 min;加入15 mL 1%醋酸-乙腈和一顆陶瓷質子于樣品管中,渦旋1 min,加入6 g MgSO4、1.5 g乙酸鈉,快速震蕩后,渦旋2 min,10000 r/min離心5 min。
固相萃取法:取2 mL上清液過PRiME HLB小柱,收集濾液,UPLC-MS/MS測定。
QuEChERS法:取6 mL乙腈層加入10 mL離心管中,加入1.2 g MgSO4、400 mg PSA、400mgC18和200mgGCB,渦旋2 min,10000 r/min離心5 min。準確吸取2 mL上清液于10 mL試管中,40 ℃氮吹濃縮近干,加入1 mL初始流動相復溶,用0.22 μm濾膜過濾,UPLC-MS/MS測定。
2.3 UPLC-MS/MS 測定條件
色譜條件:ACQUITY UPLC HSS T3柱(1.8 μm,2.1×100 mm);柱溫:30 ℃;進樣體積:1 μL;流動相:A為水,B為乙腈。梯度洗脫程序:0~3 min,5% B;3~7 min,70% B;7~9 min,5% B;9~10 min,5% B;流速:0.3 mL/min;外標法定量。
質譜條件:電噴霧電離源(ESI);多反應監(jiān)測(MRM);正離子模式;離子源溫度:110 ℃;脫溶劑氣溫度:350 ℃;錐孔反吹氣:50 L/Hr;脫溶劑氣:1000 L/Hr。詳細質譜參數(shù)見表1。
3 結果與討論
3.1 色譜-質譜條件的選擇
用甲醇配制濃度為0.2 μg/mL的混合標準溶液,選用保留特性差異大的3種類型色譜柱在同一梯度條件下比較,分別為ACQUITY UPLC BEH C18柱(1.7 μm,2.1×100 mm)、ACQUITY UPLC BEH HILIC柱(1.7 μm,3.0×100 mm)和ACQUITY UPLC HSS T3柱(1.8 μm,2.1×100 mm)。圖1顯示了3種色譜柱的保留時間,強極性農藥在BEH C18柱上的保留時間最短,大部分強極性農藥的保留時間均在1 min以內,保留時間密集;HILIC柱檢測得到的色譜圖保留時間大多在1~2 min,保留時間也比較密集,其中樂果、甲胺磷的保留時間均為1.47 min,涕滅威、氧樂果的保留時間均為1.49 min;強極性農藥經(jīng)HSS T3柱的分離,獲得到有效分離,色譜圖峰形都較好。對比3種色譜柱的檢測結果,HSS T3柱分離檢測的效果最好。強極性農藥在BEH C18柱和HILIC的保留時間都集中在1~2 min,形成離子對時容易相互競爭,影響定量的結果,還容易受到基質的干擾,并且峰形對稱性差。HSST3柱是硅膠基體C18柱,能夠增強極性化合物的保留,減弱疏水性化合物的保留,9種化合物的分離效果見圖1中HSS T3色譜圖部分,保留時間具體是樂果5.76 min、甲胺磷1.54 min、多菌靈5.56 min、涕滅威6.21 min、氧樂果3.29 min、敵百蟲5.38 min、噻蟲嗪5.28 min、涕滅威砜4.85 min和涕滅威亞砜4.27 min;色譜峰峰形對稱性比前兩種好,積分定量更加準確。
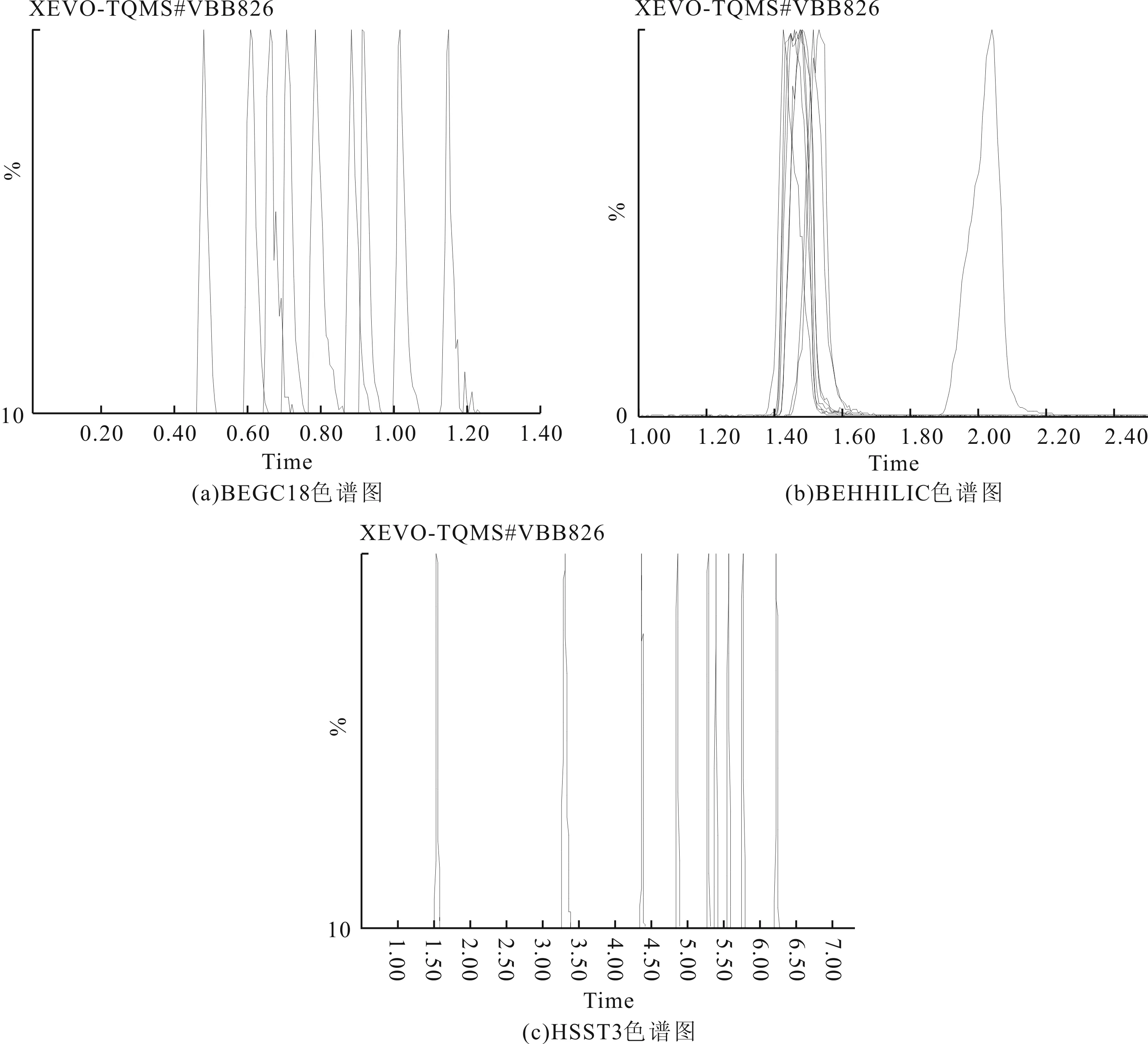
圖1 9種極性農藥在3種色譜柱上的色譜圖
甲醇配制9種藥物濃度0.2 μg/mL的混合標準溶液,質譜注射泵直接進入質譜做一級質譜MS掃描,優(yōu)化毛細管電壓尋找母離子;優(yōu)化碰撞能量,選擇響應高和干擾小的子離子作為定量離子。電離模式、定量離子對、定性離子對、碰撞能量及錐孔電壓見表1。
3.2 凈化方法的選擇及優(yōu)化
3.2.1 凈化劑的優(yōu)化
基質分散劑C18可以去除茶葉提取液中脂肪、甾醇和維生素等非極性物質,降低干擾和減小基質效應,提高分析結果準確性和重現(xiàn)性;PSA 可有效去除茶葉中脂肪酸、有機酸和糖類等干擾雜質;茶葉樣品經(jīng)提取色素比較重,而GCB可以消除色素對實驗結果的干擾和質譜離子化的影響。按照步驟2.2節(jié)處理茶葉樣品,添加水平為100 μg/kg。另設置4組不同的吸附劑的對照實驗,吸附劑組合分別為400 mg PSA、400 mg C18、400 mg PSA和200 mg GCB、400 mg C18和200 mg GCB,同時加入1.2 g MgSO4,每組設置6個平行樣,基質標準曲線校正,平均回收率見表2。結果顯示,凈化劑為PSA和C18對茶葉基質中的所有目標農藥的平均回收率沒有差異性,大部分目標物的回收率均低于70%;而當加入GCB時,茶葉凈化液接近無色,其中甲胺磷、多菌靈、噻蟲嗪、涕滅威砜和涕滅威亞砜回收率增加明顯;PSA、C18和GCB同時加入時,9種化合物平均回收范圍為76.48%~99.57%,符合農藥殘留分析要求。因此,本實驗選擇PSA、C18和GCB組合為茶葉基質的凈化劑。
3.2.2 凈化方法的選擇
實驗同時對比較了固相萃取法和QuEChERS法的凈化效果,按照步驟2.2節(jié)處理茶葉樣品,添加水平為50 μg/kg,基質標準曲線校正,平均回收率見表2。數(shù)據(jù)顯示,QuEChERS法和固相萃取法處理后,9種化合物平均回收范圍分別為76.48%~99.57%和63.15%~87.70%,大部分化合物差異不明顯,但敵百蟲、噻蟲嗪和涕滅威砜已經(jīng)明顯低于70%。固相萃取小柱的價格比較貴,綜合考慮選擇QuEChERS為本實驗的凈化方法。
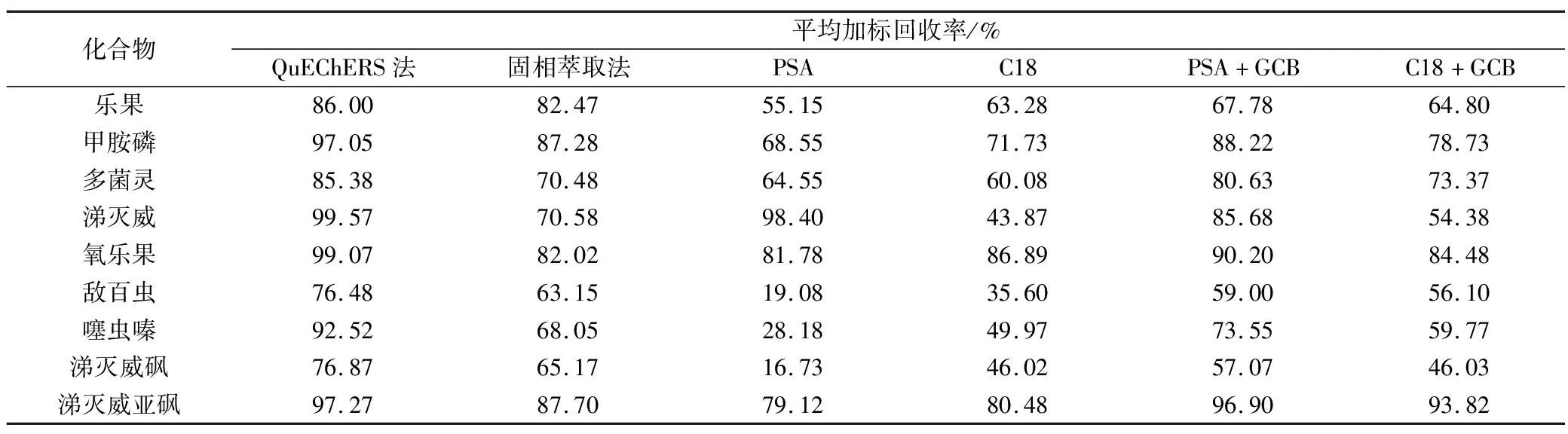
表2 不同凈化條件下得到的回收率(n=6)
3.3 基質效應
在UPLC-MS/MS檢測復雜樣品時,通常會受到樣品基質的干擾,影響目標物的離子化,產生增強或抑制效應,這種現(xiàn)象稱為基質效應(matrix effect,ME),基質效應(ME)=基質校正曲線斜率/溶劑校正曲線斜率)[17]。溶劑相配制標準溶液系列和空白茶葉樣品配制相同濃度的基質標準溶液系列,UPLC-MS/MS測定,表3結果顯示:涕滅威、涕滅威砜、多菌靈、甲胺磷的ME比值在0.8~1.2范圍內,為弱基質效應;樂果、氧樂果、噻蟲嗪、敵百蟲、涕滅威亞砜的ME比值在1.2~1.5或0.5~0.8范圍內,為中等基質效應。茶葉基質中9種目標物存在不同程度的基質效應,選擇空白茶葉基質匹配標準溶液進行定量分析。
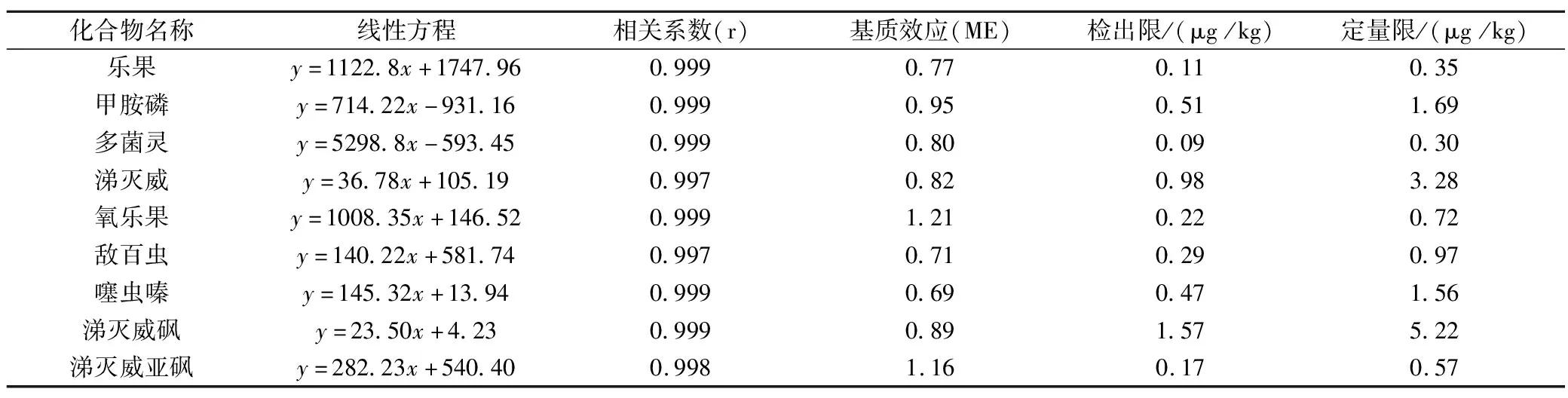
表3 空白茶葉的回歸方程、相關系數(shù)、基質效應、檢出限和定量限
3.4 線性范圍、檢出限和定量限
采用基質匹配標準工作溶液繪制標準工作曲線,濃度范圍在0.005~0.1 μg/mL,UPLC-MS/MS 檢測,以各組分的色譜峰面積對基質標準溶液濃度進行線性回歸,表3數(shù)據(jù)顯示,相關系數(shù)(r)均≥0.997,線性關系良好。檢出限(LOD)以定量離子的3倍以信噪比(S/N=3)計算,定量限(LOQ)以定量離子的10倍信噪比(S/N=10)計算[18]。9種強極性農藥的LOD在0.09~1.57 μg/kg,LOQ在0.30~5.22 μg/kg。檢出限和定量限均低于食品安全國家標準GB23200.13-2016《茶葉中448種農藥及相關化學品殘留量的測定液相色譜-質譜法》中的檢出限及定量限[19]。
3.5 準確度和精密度
實驗選擇4個不同濃度水平5 μg/kg、10 μg/kg、50 μg/kg和100 μg/kg的添加回收率實驗,每個濃度水平進行6次重復,基質標準曲線校正,平均回收率見表4。9種強極性農藥的平均回收率在74.47%~101.9%之間,相對標準偏差(RSD%)在0.34%~12.71%之間。準確度和精密度符合《中華人民共和國農業(yè)部公告第2386號》的要求,表明9種強極性農藥在茶葉油基質中的分析檢測方法可行。
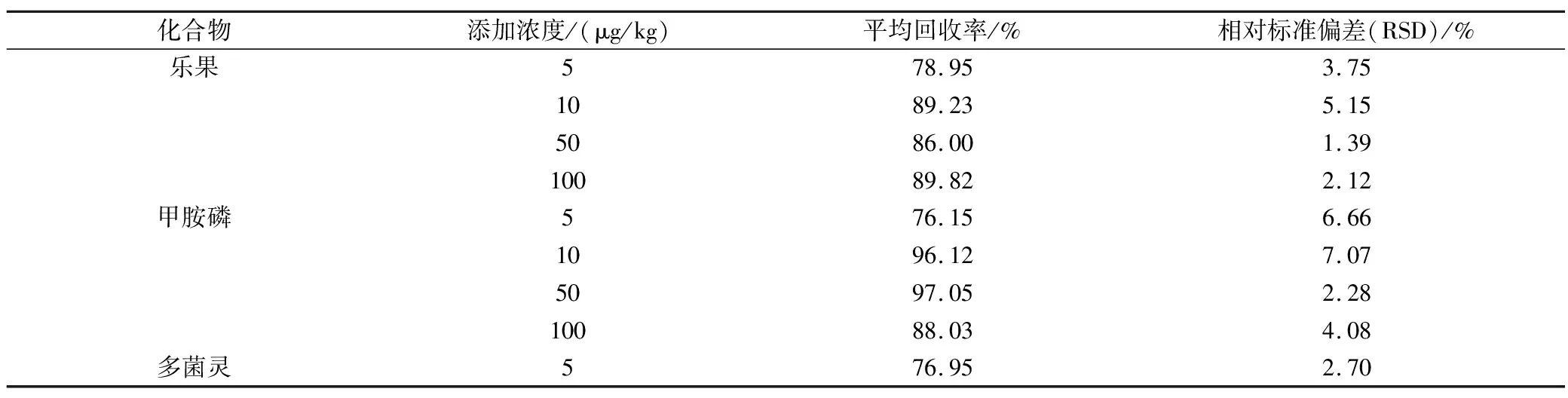
表4 空白茶葉基質中4種不同添加濃度目標物的平均回收率及相對標準偏差(n=6)
3.6 實際樣品分析
采用本方法對市場和茶園上購買的5種不同批次的63個茶葉樣品進行分析檢測,9強極性農藥均未檢測出。
5 結論
本實驗探究得到了適用于檢測茶葉中強極性農藥的色譜條件,采用QuEChERS前處理技術對茶葉進行簡單、高效的前處理,用UPLC-MS/MS分析檢測。本方法步驟簡單易操作、試劑用量小、回收率好、精密度高,且有效除去茶葉中基質干擾,同時檢出限和定量限滿足于農藥殘留檢測要求。因此,本方法適用于茶葉中涕滅威、涕滅威亞砜、涕滅威砜、氧樂果、樂果、甲胺磷、敵百蟲、多菌靈、噻蟲嗪9種強極性農藥的檢測。

